Перейти к:
Экспрессионные маркеры скелетной мышцы человека, ассоциированные с нарушениями глюкозного метаболизма в базальном состоянии и после приема пищи
https://doi.org/10.14341/DM13166
Аннотация
ВВЕДЕНИЕ. Скелетные мышцы играют ключевую роль в углеводном метаболизме организма. Дисрегуляция инсулин-зависимого захвата глюкозы в скелетной мускулатуре нарушает обмен углеводов в организме и может приводить к развитию ожирения и сахарного диабета 2 типа (СД2).
ЦЕЛЬ. Выявить экспрессионные маркеры (гены) скелетной мышцы человека, ассоциированные с нарушениями глюкозного метаболизма в базальном состоянии и после приема смешанной пищи, нормированной на массу тела.
МАТЕРИАЛЫ И МЕТОДЫ. В исследовании приняли участие три группы по 8 человек: здоровые добровольцы, пациенты с ожирением без и с СД2. Пробы венозной крови брали утром натощак (09:00) и через 30 мин, 60 мин, 90 мин, 120 мин и 180 мин после приема смешанной пищи, нормированной на массу тела (6 ккал/кг). Биопсические пробы из m. vastus lateralis брали до и через 1 ч после приема пищи для оценки экспрессии генов (РНК-секвенирование) и поиска генов, коррелирующих с маркерами нарушения глюкозного метаболизма в базальном состоянии и после приема пищи.
РЕЗУЛЬТАТЫ. Для 75 генов была найдена сильная корреляция (|ρ|>0,7 и р<0,001) между их экспрессией и уровнем инсулина, C-пептида, глюкозы или гликированного гемоглобина в базальном и/или постпрандиальном состоянии. Экспрессия 17 из этих генов имела выраженные отличия (>1,5 раза) между здоровыми людьми и пациентами либо выраженные изменения в ответ на прием пищи. Для них можно отметить такие гены, роль которых в нарушении метаболизма глюкозы уже была показана ранее (FSTL1, SMOC1, GPCPD1), а также другие — которые перспективны для дальнейшего изучения механизмов возникновения инсулиновой резистентности в скелетной мышце.
ЗАКЛЮЧЕНИЕ. Были выявлены экспрессионные маркеры скелетной мышцы, являющиеся перспективными кандидатами для будущих целевых исследований, направленных на изучение механизмов возникновения инсулинорезистентности и поиск потенциальных терапевтических мишеней.
Ключевые слова
Для цитирования:
Махновский П.А., Курочкина Н.С., Вепхвадзе Т.Ф., Томилова А.О., Леднев Е.М., Шестакова М.В., Попов Д.В. Экспрессионные маркеры скелетной мышцы человека, ассоциированные с нарушениями глюкозного метаболизма в базальном состоянии и после приема пищи. Сахарный диабет. 2024;27(5):411-421. https://doi.org/10.14341/DM13166
For citation:
Makhnovskii P.A., Kurochkina N.S., Vepkhvadze T.F., Tomilova A.O., Lednev E.M., Shestakova M.V., Popov D.V. Expression markers of human skeletal muscle associated with disorders of glucose metabolism in the basal and postprandial state. Diabetes mellitus. 2024;27(5):411-421. (In Russ.) https://doi.org/10.14341/DM13166
ВВЕДЕНИЕ
Ожирение — одна из основных причин развития социально-значимых хронических метаболических заболеваний, таких как метаболический синдром и сахарный диабет 2 типа (СД2). В России численность пациентов с СД2 растет и сегодня составляет около 3% населения [1]. Скелетные мышцы играют ключевую роль в углеводном обмене организма, так как даже в состоянии покоя их вклад в инсулин-зависимое потребление глюкозы составляет более 80% [2]. Это означает, что дисрегуляция инсулин-зависимого захвата глюкозы скелетной мускулатурой нарушает углеводный метаболизм в организме и может приводить к развитию ожирения и СД2.
Инсулинорезистентность скелетных мышц связывают главным образом с нарушением инсулин-зависимой сигнализации, регулирующей транслокацию транспортера глюкозы GLUT4 и постпрандиальный захват глюкозы из кровотока. Однако оказалось, что при ожирении и СД2 в скелетных мышцах в базальном состоянии (натощак) наблюдаются выраженные изменения в фосфорилировании множества сигнальных молекул, не входящих в канонический инсулиновый сигнальный каскад, а также ряда транскрипционных факторов [3], что хорошо согласуется с изменением транскрипционного профиля мышц пациентов [4–6]. Эти изменения могут быть вызваны изменением содержания инсулина, других гормонов и метаболитов в крови в базальном состоянии, а также чувствительности скелетных мышц к ним. Действительно, в ряде исследований были найдены значимые корреляции экспрессии генов в скелетной мышце натощак с уровнем инсулина в крови и некоторыми маркерами метаболических нарушений. Так, исследование транскриптома скелетных мышц людей с различным индексом массы тела выявило 180 значимых корреляций экспрессии генов с индексом инсулинорезистентности (HOMA-IR), включающих в том числе некоторые регуляторы липидного метаболизма и сигнального пути AKT-mTOR, регулирующего синтез и протеолиз белков, экспрессию генов и т.д. [7]. Помимо этого, метаанализ транскриптомных данных показал, что экспрессия гена инсулинового рецептора (INSR) и его субстрата (IRS2) отрицательно коррелируют с уровнем инсулина натощак в скелетной мышце людей с разным уровнем инсулиновой чувствительности [8].
С другой стороны, изменение базальной экспрессии генов скелетной мышцы может регулироваться изменением содержания инсулина и других веществ, вызываемыми регулярными приемами пищи. Действительно, в нескольких исследованиях было показано, что увеличение содержания инсулина в крови во время клэмп-теста (до 100 мЕд/л или ~0,6 нМ) через 3–4 ч изменяет экспрессию нескольких сотен генов в скелетной мышце здоровых людей [9][10]. Кроме этого, уже были найдены значимые ассоциации экспрессии генов в мышечной и жировой ткани с показателями обмена углеводов при стимуляции инсулином (клэмп-тест) [11]. Однако нужно заметить, что у здоровых людей, пациентов с ожирением без или с СД2 прирост инсулина и его абсолютный уровень во время повседневного приема пищи может значительно отличаться от условий клэмп-теста и между собой. Поэтому большой интерес представляют исследования, изучающие изменение показателей метаболизма глюкозы, а также экспрессии генов в скелетной мышце на прием пищи, нормированный на массу тела [12–14].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Цель исследования — выявить экспрессионные маркеры (гены) скелетной мышцы человека, ассоциированные с нарушениями глюкозного метаболизма в базальном состоянии и после приема пищи, нормированной на массу тела.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Многоцентровое интервенционное проспективное сравнительное исследование.
Место и время проведения исследования
Организация исследования была описана нами ранее [15][16]. Исследования с пациентами проводили в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ, 04.2022–05.2023 гг., а со здоровыми добровольцами в ГНЦ РФ Институт медико-биологических проблем РАН, 03.2022–09.2023 гг.
Изучаемые популяции
Характеристики добровольцев представлены в табл. 1. В исследовании участвовало 8 здоровых добровольцев (Н) (критерии включения: ИМТ<25 кг/м²; отсутствие диагностированного СД2), 8 пациентов с ожирением (Ob) (ИМТ>30 кг/м²; отсутствие диагностированного СД2) и 8 пациентов с ожирением и СД2 (T2D) (ИМТ>30 кг/м²; диагностированный СД2). Пациенты группы T2D находились на сахароснижающей терапии; прием препаратов был приостановлен за 1–2 дня (ингибиторы натрий-глюкозного котранспортера-2, ингибиторы дипептидилпептидазы-4, производные сульфонилмочевины, бигуанид [метформин]) и/или за 7 дней (агонист рецептора глюкагоноподобного пептида-1 [семаглутид]) до теста со смешанной пищей.
Таблица 1. Характеристика добровольцев
|
Норма |
H |
Ob |
T2D |
|
|
Мужчины/женщины |
4/4 |
3/5 |
4/4 |
|
|
Возраст, лет |
41,0 (34,5–46,8) |
40,0 (25,0–51,0) |
58,0*# (48,0–63,5) |
|
|
Индекс массы тела, кг/м² |
18,5–25 |
22,5 (19,4–24,0) |
43,5*** (37,2–50,1) |
39,3** (38,2–45,1) |
|
Глюкоза, ммоль/л |
<6,1 |
4,9 (4,5–5,2) |
5,1 (5,0–5,4) |
6,4** (5,8–9,9) |
|
Инсулин, мЕд/л |
2,6–24,9 |
7,2 (5,7–7,5) |
19,5** (16,3–32,3) |
24,0** (16,4–35,7) |
|
С-пептид, нг/мл |
1,1–4,4 |
2,0 (1,7–2,3) |
3,4* (2,6–5,0) |
4,4** (3,3–6,4) |
|
HbA1c, % |
4,0–6,0 |
5,3 (5,0–5,6) |
5,2 (5,0–5,5) |
6,3*## (5,8–8,3) |
Примечание. Представлены медиана и межквартильный размах; * — отличие от контроля, # — отличие от Ob; один, два и три символа — p≤0,05, ≤0,01 и ≤0,001 соответственно.
Описание вмешательства
Все добровольцы прошли анкетирование (опросник SF-12 [17]) для субъективной оценки своих физических возможностей. Пробы венозной крови из v. cephalica брали утром натощак (09:00) и через 30 мин, 60 мин, 90 мин, 120 мин и 180 мин после приема пищевой смеси Resource 2.0 (Nestle Health Science, Франция, 3 мл или 6 ккал/кг массы тела, соотношение по энергоемкости белков: жиров: углеводов 1: 2,3:2,7 ккал/кг массы тела) (рис. 1А). Игольчатую биопсию брали из срединной части m. vastus lateralis под местной анестезией (2 мл 2% лидокаина), до и через час после приема пищи (вторая биопсия была взята на 10 см проксимальнее первой), как описано ранее [15][16].
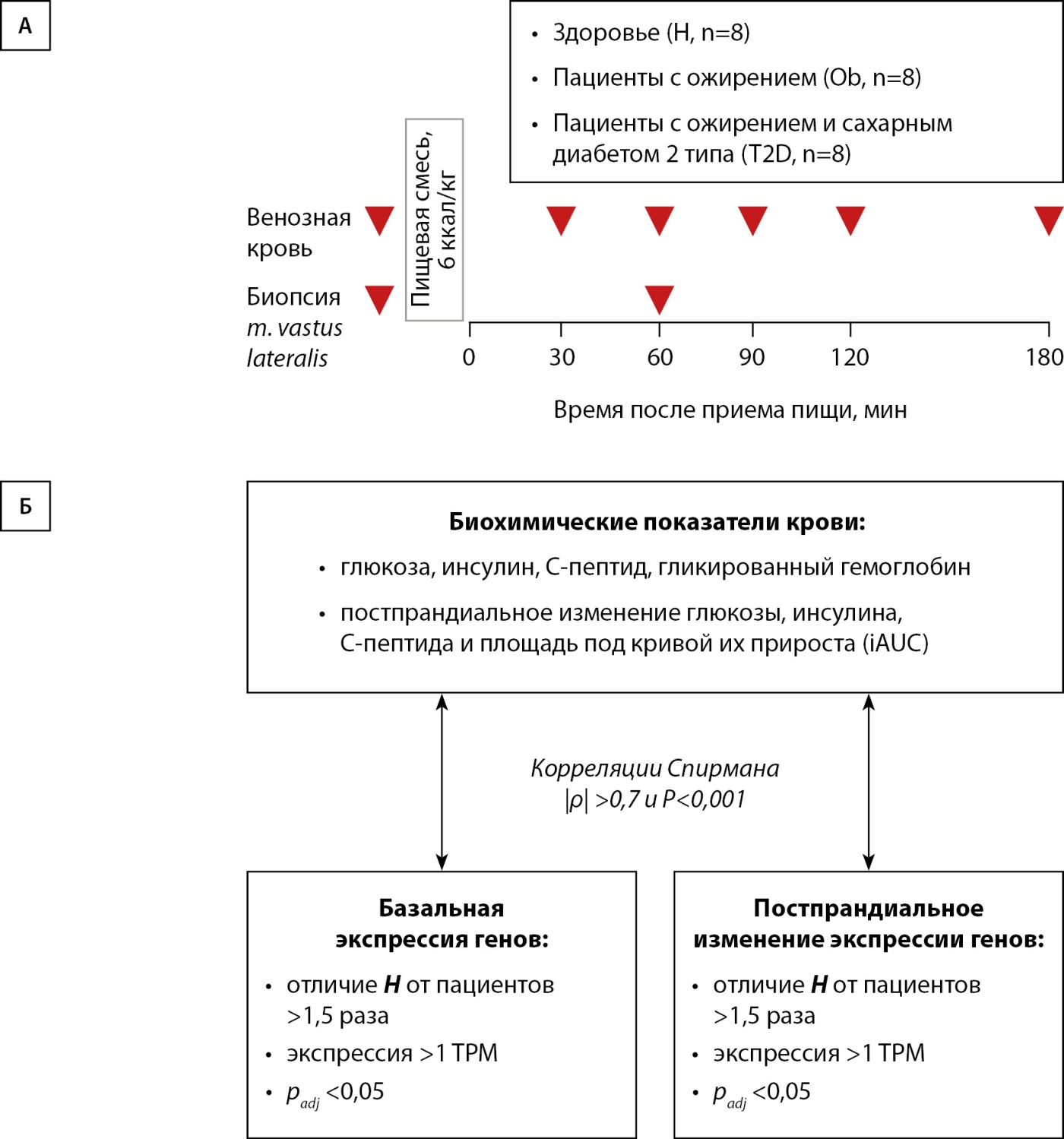
Рисунок 1. Схема эксперимента (А) и поиска экспрессионных маркеров, ассоциированных с показателями обмена глюкозы (Б).
Лабораторные методы исследования
Гликированный гемоглобин (HbA1c) в цельной крови определяли методом высокоэффективной жидкостной хроматографии на анализаторе D10 (BioRad, США), уровень глюкозы в сыворотке определяли на автоматическом анализаторе Architect c8000 (Abbott Diagnostics, США); иммуннореактивный инсулин и С-пептид определяли в сыворотке крови на электрохемилюминесцентном анализаторе Cobas 6000 (Roche, Швейцария), как описано ранее [15][16].
Полногеномное секвенирование РНК и биоинформатическую обработку данных проводили как описано ранее [16]. Кратко тотальную РНК выделяли с помощью спин-колонок (набор RNeasy Mini Kit, Qiagen, Германия) и измеряли ее концентрацию (флуориметр Qubit 4 и набор Qubit RNA HS Assay Kit (Thermo Scientific, США). После оценки целостности РНК (RIN>7; капиллярный электрофорез на анализаторе TapeStation 4150 и набор High Sensitivity RNA ScreenTape, Agilent, Германия), цепь-специфичные библиотеки были приготовлены с помощью набора NEBNext Ultra II Directional RNA Library Preparation Kit (New England BioLabs, США) и затем секвенированы (75 нуклеотидов с одного конца, покрытие около 55 млн прочтений на образец) на анализаторе NextSeq 550 (Illumina, США).
Биоинформатические методы и статистический анализ
Прочтения РНК картировали на человеческий геном (первичная сборка GRCh38.p13), используя программу Hisat2 v.2.2.1. Количество уникально картированных прочтений для экзонов каждого гена рассчитывали с помощью пакета Rsubread (среда программирования R). Гены, изменившие экспрессию, определяли с помощью метода DESeq2 с коррекцией на множественное сравнение Бенжамина-Хохберга (padj<0,05; среда R), уровень экспрессии с помощью показателя TPM (программа kallisto, v0.46.2).
После удаления низкоэкспрессируемых генов (TPM<1) определяли корреляции между экспрессией белок-кодирующих генов и биохимическими показателями с помощью рангового коэффициента корреляции Спирмана; для дальнейшего анализа использовали только сильные взаимосвязи: |ρ|>0,7 и р<0,001 (рис. 1Б, 3А).
Для биологической интерпретации корреляций между экспрессией генов в базальном состоянии и биохимическими показателями брали только те гены, экспрессия которых различалась более чем в 1,5 раза между здоровыми добровольцами и пациентами (тест DESeq2, padj<0,05) (рис. 1Б, 3Б).
Для биологической интерпретации корреляций между изменениями экспрессии генов после приема пищи и биохимическими показателями использовали только те гены, изменения экспрессии которых в ответ на прием пищи значимо различались более чем в 1,5 раза между здоровыми добровольцами и пациентами (тест Манна-Уитни, p<0,05).
Для оценки различий между выборками для биохимических показателей использовали однофакторный дисперсионный анализ Краскела-Уоллиса с коррекцией на множественное сравнение (тест Данна) при уровне значимости 0,05.
Классы белков определяли, используя базу данных KEGG BRITE.
Этическая экспертиза
Исследование было проведено в соответствии с Хельсинкской декларацией и одобрено Комитетом по биомедицинской этике Института медико-биологических проблем РАН (№613 от 29 марта 2022 г.) и Локальным этическим комитетом ГНЦ ФГБУ«НМИЦ Эндокринологии» МЗ РФ (№4 от 14 февраля 2022 г.). Письменное информированное согласие было получено от всех добровольцев.
РЕЗУЛЬТАТЫ
Характеристики групп и тест со смешанной пищей
Пациенты с ожирением (Ob) и пациенты с ожирением и СД2 (T2D) отличались от здоровых (H) повышенным базальным уровнем инсулина и С-пептида, пациенты с ожирением и СД2 имели повышенный уровень глюкозы и HbA1c (табл. 1). Как было описано нами ранее [15], динамика биохимических показателей отличалась у разных групп после приема пищи. В группах Ob и T2D наблюдался повышенный постпрандиальный уровень и прирост площади под кривой (iAUC) С-пептида и инсулина (рис. 2А и Б). У пациентов, в отличие от контроля, уровень глюкозы ожидаемо был повышен вплоть до второго часа после приема пищи, тогда как iAUC был увеличен только в группе T2D (рис. 2).
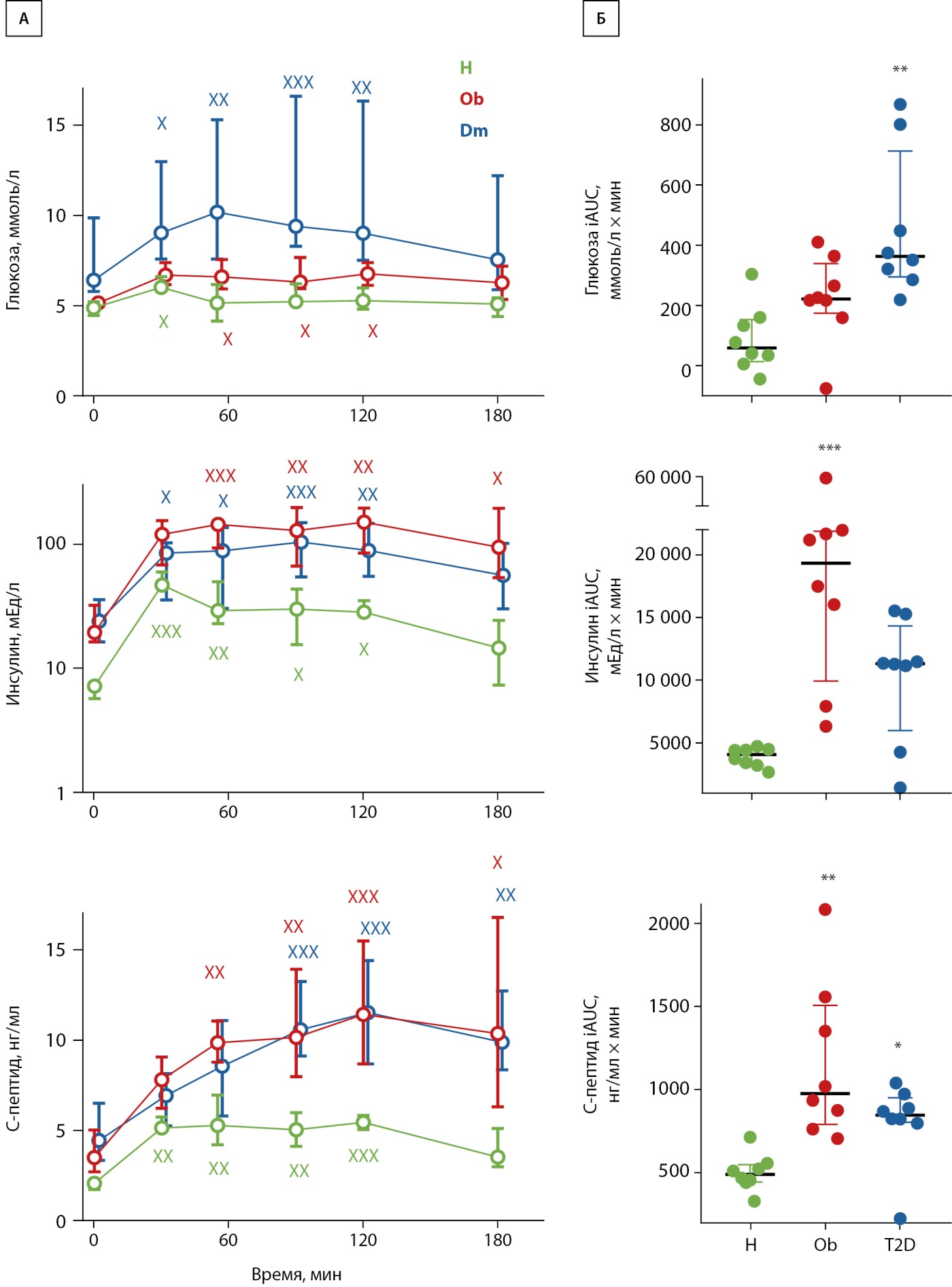
Рисунок 2. Изменение содержания глюкозы, инсулина и С-пептида в крови после приема смешанной пищи, нормированной на массу тела, у здоровых людей (H), пациентов с ожирением без (Ob) и с СД2 (T2D). Представлена динамика этих показателей (А) и прирост площади под кривой (iAUC) (Б); × — отличие от исходного уровня; * — отличие от контроля. Один, два и три символа — p≤0,05, ≤0,01 и ≤0,001 соответственно.
Корреляции базальной экспрессии генов с показателями метаболизма глюкозы
В базальном состоянии в группе Ob, T2D и объеденной группе пациентов было найдено 526, 174 и 397 генов, изменивших экспрессию относительно здорового контроля. Однако только для 38 из них были найдены значимые и сильные корреляции (|ρ|>0,7) с базальным уровнем инсулина, С-пептида, глюкозы натощак или HbA1c. Для того, чтобы выявить потенциальные биологически значимые корреляции, мы выбрали 11 генов, экспрессия которых различалась между здоровым контролем и любой группой пациентов >1,5 раза (рис. 3А, табл. 2, доп. рис.). При анализе зависимости базальной экспрессии с изменением уровня глюкозы в ответ на прием пищи были обнаружены значимые корреляции для четырех генов: положительные для NFIL3 и VGLL2, отрицательные для CADM1 и GPCPD1) (рис. 3А, табл. 2, доп. рис.).
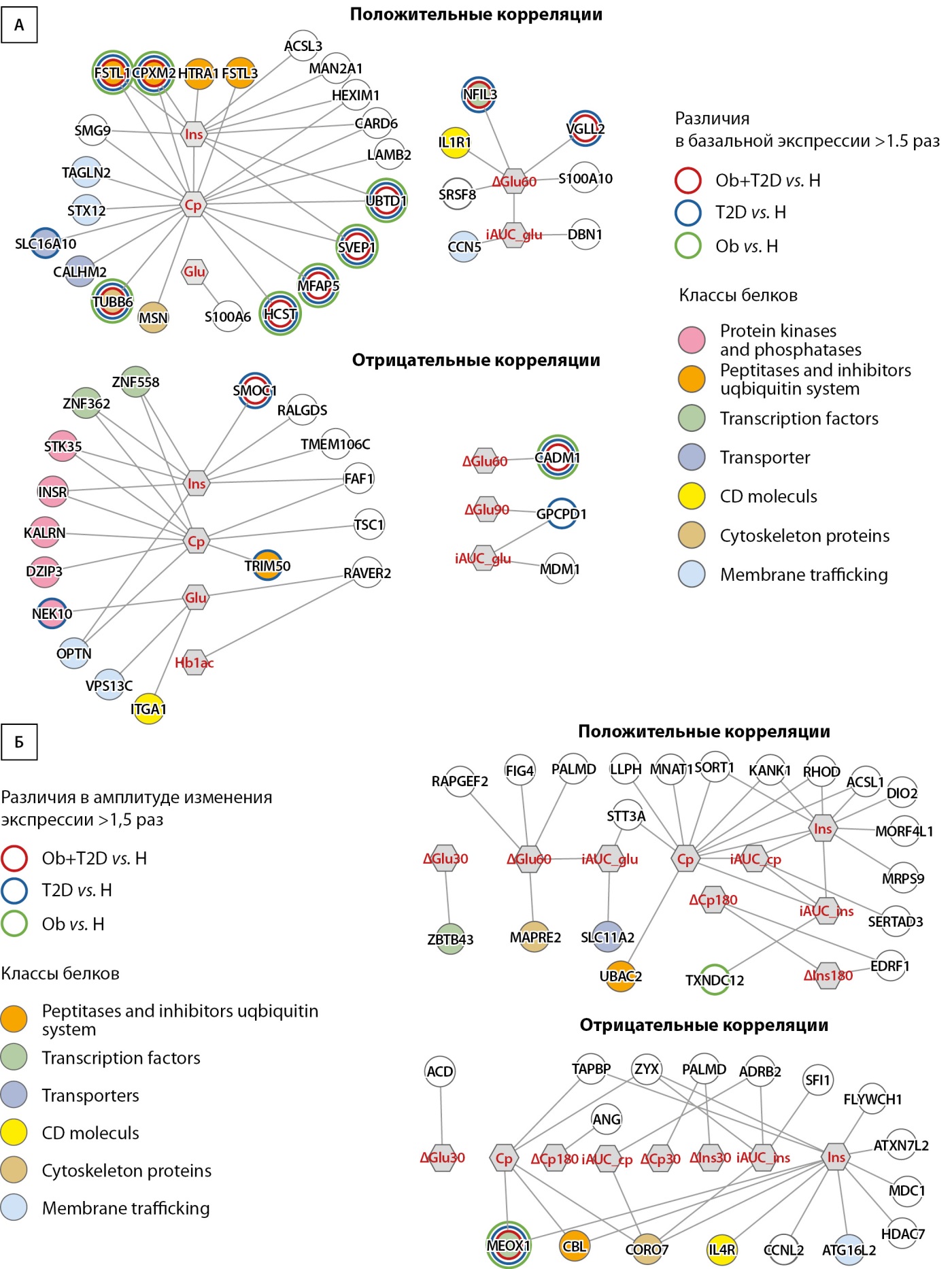
Рисунок 3. Корреляции базальной экспрессии (А) и изменений экспрессии генов в скелетной мышце после приема пищи (Б) с базальным уровнем (утром натощак) С-пептида, инсулина и глюкозы в венозной крови, а также с их приростом после приема пищи. Линиями обозначены сильные значимые корреляции (|ρ|>0,7; p<0,001). Цветные круги показывают гены, базальная экспрессия (А) или изменение экспрессии (Б) которых в ответ на прием пищи различается между группами >1,5 раза (зеленый — Ob vs. H, синий T2D vs. H, красный — объединенная группа Ob + T2D vs. H). Заливка круга показывает класс белка. Ins — инсулин, Cp — С-пептид, Glu — глюкоза, HbА1c — гликированный гемоглобин, iAUC — площадь под кривой прироста глюкозы за 180 мин после приема пищи, Δ — постпрандиальные изменения.
Таблица 2. Функции генов с различиями в экспрессии между группами >1,5 раза и демонстрирующих значимые сильные корреляции базальной экспрессии с показателями метаболизма глюкозы натощак и их изменениями после приема пищи
|
Символ гена |
Название гена |
Молекулярная функция (база данных Genecards) |
Изменение экспрессии у пациентов |
|
CADM1 |
Cell Adhesion Molecule 1 |
Регулятор межклеточной адгезии |
i T2D, Ob |
|
CPXM2 |
Carboxypeptidase X, M14 Family Member 2 |
Внеклеточная карбоксипептидаза |
h T2D, Ob |
|
FSTL1 |
Follistatin Like 1 |
Секретируемый гликопротеин, вовлеченный в разнообразные физиологические процессы |
h T2D, Ob |
|
GPCPD1 |
Glycerophosphocholine Phosphodiesterase 1 |
Фермент метаболизма глицерофосфолипидов |
i T2D |
|
HCST |
Hematopoietic Cell Signal Transducer |
Мембранный белок, адаптерный для фосфоинозитид-3-киназы |
h T2D, Ob |
|
MFAP5 |
Microfibril Associated Protein 5 |
Гликопротеин, компонент микрофибрилл внеклеточного матрикса |
h T2D, Ob |
|
NEK10 |
NIMA Related Kinase 10 |
Киназа, активатор ERK1/ERK2 сигналинга |
i T2D |
|
NFIL3 |
Nuclear Factor, Interleukin 3 Regulated |
Транскрипционный фактор |
h T2D |
|
SLC16A10 |
Solute Carrier Family 16 Member 10 |
Транспортер тиреоидных гормонов и ароматических аминокислот |
h T2D, Ob |
|
SMOC1 |
SPARC Related Modular Calcium Binding 1 |
Секретируемый белок |
i T2D |
|
SVEP1 |
Sushi, Von Willebrand Factor Type A, EGF And Pentraxin Domain Containing 1 |
Регулятор обмена Ca²⁺ и вазоконстрикции |
h T2D, Ob |
|
TRIM50 |
Tripartite Motif Containing 50 |
E3 убиквитин-трансфераза |
i T2D |
|
TUBB6 |
Tubulin Beta 6 Class V |
Компонент цитоскелета микротрубочек |
h T2D, Ob |
|
UBTD1 |
Ubiquitin Domain Containing 1 |
Убиквитиноподобный белок, может быть вовлечен в клеточное старение |
h T2D, Ob |
|
VGLL2 |
Vestigial Like Family Member 2 |
Транскрипционный кофактор |
h T2D |
Примечание. Стрелками указано направление изменения экспрессии у пациентов с ожирением и ожирением (Ob) и сахарным диабетом 2 типа (T2D) в сравнении со здоровыми добровольцами.
Корреляции постпрандиальных изменений экспрессии генов с показателями метаболизма глюкозы
Значимые корреляции между здоровыми добровольцами и пациентами были обнаружены для 37 генов; среди них только для двух генов было обнаружено выраженное (>1,5 раза) изменение амплитуды постпрандиальной экспрессии — MEOX1 (Mesenchyme Homeobox 1) и TXNDC12 (Thioredoxin Domain Containing 12) (рис. 3Б, доп. рис.).
ОБСУЖДЕНИЕ
В нашем исследовании мы изучали ассоциации между биохимическими показателями крови, характеризующими нарушения метаболизма глюкозы, и экспрессией генов в скелетной мышце в базальном состоянии и после приема пищи у здоровых людей, пациентов с ожирением без и с СД2. Важно отметить, что изменение этих показателей изучалось в условиях, близких к физиологическим, а именно после приема смешанной пищи, нормированной на массу тела. В результате работы удалось выявить 17 генов, экспрессия которых была ассоциирована с метаболическими нарушениями и уровнем инсулина, C-пептида или глюкозы (натощак или в ответ на прием пищи) (доп. рис.).
Экспрессионные маркеры, ассоциированные с уровнем инсулина и С-пептида натощак
Инсулин — анаболический гормон, который регулирует множество процессов в скелетных мышцах. При инсулинорезистентности хронически повышенный уровень инсулина и/или его чрезмерный постпрандиальный прирост может приводить к изменению в инсулин-зависимой клеточной сигнализации и экспрессии генов в скелетных мышцах. Мы выявили несколько экспрессионных маркеров скелетной мышцы, которые тесно коррелируют с базальным уровнем или постпрандиальным изменением уровня инсулина. Среди них были обнаружены гены, для которых ранее была показана роль в регуляции глюкозного метаболизма и развитии метаболических нарушений.
Так, по аналогии с нашим исследованием, показавшим, что базальная экспрессия гена адипомиокина FSTL1 положительно коррелирует с уровнем С-пептида и инсулина натощак (рис. 4А), было обнаружено, что уровень FSTL1 в крови людей положительно связан с ожирением и инсулинорезистентностью [18]. На миобластах L6 и первичных миобластах собаки было показано, что FSTL1 регулирует AMPK-зависимый захват глюкозы и экспрессию GLUT4 [19]. Более того, инфузия FSTL1 собакам с индуцированной сердечной недостаточностью положительно повлияла на метаболизм жирных кислот и окисление глюкозы [20]. Эти данные и наши результаты позволяют предположить, что инсулин-индуцированное увеличение экспрессии FSTL1 у пациентов может быть одним из компенсаторных механизмов, направленных на предотвращение нарушений в захвате глюкозы мышцами.
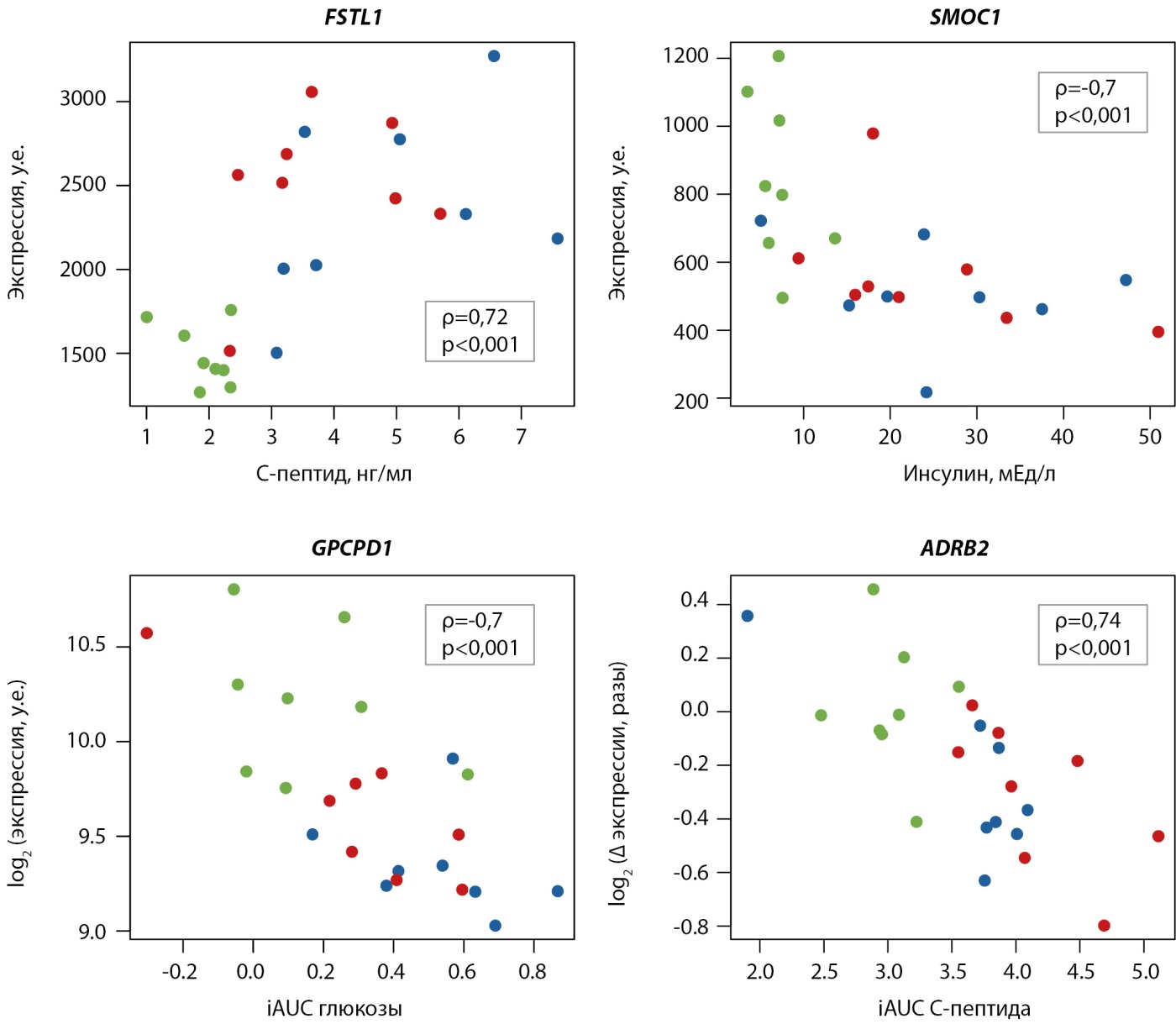
Рисунок 4. Примеры корреляций между потенциальными экспрессионными маркерами метаболических нарушений (гены Follistatin like 1, SPARC Related Modular Calcium Binding 1, Glycerophosphocholine Phosphodiesterase, Adrenoceptor Beta 2) и показателями метаболизма глюкозы. Здоровые добровольцы (H) — зеленый, пациенты с ожирением (Ob) — синий, пациенты с ожирением и сахарным диабетом 2 типа (T2D) — красный.
Обнаруженные нами отрицательные корреляции экспрессии гена SMOC1 с уровнем инсулина и С-пептида согласуются с данными о положительной корреляции уровня его белка в плазме с инсулиновой чувствительностью у людей [21]. У мышей внутрибрюшинное введение SMOC1 или увеличение экспрессии его гена в печени улучшило метаболизм глюкозы и чувствительность к инсулину за счет увеличения экспрессии генов-регуляторов глюконеогенеза [21]. У человека взаимосвязь между уровнем SMOC1 в крови и нарушением углеводного метаболизма остается не изученной, однако наше исследование указывает на потенциальную роль изменений экспрессии этого гена в скелетных мышцах в развитии метаболических нарушений.
Гены UBTD1 и MFAP5 имели положительную корреляцию базальной экспрессии с уровнем C-пептида натощак. Это согласуется с другими исследованиями, где они описаны как экспрессионные маркеры, положительно коррелирующие с уровнем глюкозы натощак, скоростью потребления глюкозы (UBTD1) либо степенью ожирения или уровнем инсулина натощак (MFAP5) [11][22].
Экспрессионные маркеры, ассоциированные с уровнем глюкозы натощак
Гипергликемия является ключевой причиной нарушения функционирования различных тканей, органов и систем, в том числе скелетной мускулатуры, в частности показана ее взаимосвязь с появлением диабетической миопатии [23]. Однако молекулярные механизмы негативных эффектов гипергликемии на скелетную мышцу изучены слабо. Мы обнаружили несколько экспрессионных маркеров, взаимосвязанных с постпрандиальным уровнем глюкозы. Так, базальная экспрессия GPCPD1 отрицательно коррелировала с изменением глюкозы в ответ на тест со смешанной пищей (рис. 4Б). Влияние GPCPD1 на развитие инсулинорезистентности у человека не изучено, но показано, что инактивация этого гена в мышцах мышей вызывает накопление глицерофосфохолина, гипергликемию и инсулинорезсистентность, что согласуется данными об увеличении глицерофосфохолина в скелетной мышце пожилых людей и пациентов с СД2 [24].
Роль других генов, экспрессия которых была связана с постпрандиальным изменением глюкозы, в регуляции метаболизма глюкозы в скелетных мышцах не изучена. Однако было показано, что в культуре первичных бета-клеток поджелудочной железы экспрессия гена CADM1 связана с секрецией инсулина и уровнем глюкозы [25], а в культуре первичных гепатоцитов ген NFIL3 регулирует продукцию глюкозы и глюконеогенез [26].
Постпрандиальные изменения экспрессии генов, ассоциированные с уровнем инсулина и C-пептида
Постпрандиальные изменения экспрессии только двух генов (транскрипционный фактор MEOX1 и белок эндоплазматического ретикулума TXNC12) коррелировали с различными показателями метаболизма глюкозы; роль этих генов в регуляции метаболизма глюкозы до сих пор неизвестна. Стоит отметить, что в наш анализ были включены только гены с выраженными различиями (>1,5 раза) в постпрандиальном ответе между пациентами и здоровыми людьми. Тем не менее интересно отметить негативную отрицательную корреляцию изменения экспрессии гена бета-адренорецептора 2 ADRB2 (различие в изменении экспрессии между здоровыми и пациентами в 1,3 раза) с изменениями инсулина и С-пептида (рис. 4В). ADRB2 ранее неоднократно был ассоциирован с инсулинорезистентностью и имеет несколько полиморфизмов, надежно ассоциированных с ожирением [27][28], а его экспрессия положительно коррелирует с потерей жировой массы [29].
ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ
Результаты нашего исследования получены на малой выборке, поэтому требуются последующие исследования для верификации обнаруженных нами маркеров. Помимо этого, наличие сопутствующих патологий у пациентов, а также прием ими сахароснижающих препаратов (несмотря на их отмену за сутки до исследования) могли повлиять на вариативность полученных данных. В нашем исследовании только двое пациентов принимали исключительно сахароснижающую терапию, остальные дополнительно принимали другие препараты, в основном направленные на терапию артериальной гипертензии и гиперхолестеринемии.
ЗАКЛЮЧЕНИЕ
В нашей работе было выявлено 17 экспрессионных маркеров (генов), ассоциированных с показателями, характеризующими нарушения глюкозного метаболизма в базальном состоянии и после приема пищи. Валидность нашего предсказания подтверждается тем, что для 7 из них уже была показана взаимосвязь с метаболическими нарушениями, а гены FSTL1 и SMOC1 рассматривались ранее как потенциальные терапевтические мишени для контроля уровня глюкозы в крови. Другие экспрессионные маркеры, выявленные в нашем исследовании, являются перспективными кандидатами для будущих целевых исследований, направленных на изучение механизмов возникновения инсулинорезистентности, и могут быть рассмотрены как потенциальные терапевтические мишени. Помимо этого, следует отметить, что в нашем исследовании изучался ранний ответ транскриптома на прием смешанной пищи; исследование этого ответа на более поздних этапах (и поиск ассоциаций с нарушениями метаболизма глюкозы) представляется перспективным направлением для дальнейших исследований.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Дополнительный рисунок доступен по адресу https://zenodo.org/records/10998825
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена при финансовой поддержке Российского научного фонда в рамках проекта № 21-75-10146.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Махновский П.А. — биоинформатический и статистический анализ данных и их биологическая интерпретация, написание рукописи статьи и ее редактирование; Курочкина Н.С. — пробоподготовка образцов РНК, РНК-секвенирование, внесение существенных правок в рукопись статьи; Вепхвадзе Т.Ф. — проведение интервенций и их организация, пробоподготовка образцов РНК, внесение существенных правок в рукопись статьи; Томилова А.О. — работа с пациентами, проведение интервенций и их организация, внесение существенных правок в рукопись статьи; Леднев Е.М. — проведение интервенций и их организация, статистический анализ данных, внесение существенных правок в рукопись статьи; Шестакова М.В. — научное руководство исследования, организация и концепция исследования, биологическая интерпретация результатов, внесение существенных правок в рукопись статьи; Попов Д.В. — научное руководство исследования, организация и концепция исследования, биологическая интерпретация результатов, написание рукописи статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы благодарят к.м.н. И.А. Скляника (Институт диабета ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России) за помощь в работе с пациентами.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А., Сазонова Д.В., Мокрышева Н.Г. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С.104-123. https://doi.org/10.14341/DM13035
2. DeFronzo RA, Ferrannini E, Sato Y, Felig P, Wahren J. Synergistic interaction between exercise and insulin on peripheral glucose uptake. J Clin Invest. Dec. 1981;68(6):1468-74. https://doi.org/10.1172/jci110399
3. Ohman T, Teppo J, Datta N, Makinen S, Varjosalo M, Koistinen HA. Skeletal muscle proteomes reveal downregulation of mitochondrial proteins in transition from prediabetes into type 2 diabetes. iScience. 2021;24(7):102712. https://doi.org/10.1016/j.isci.2021.102712
4. Timmons JA, Atherton PJ, Larsson O, et al. A coding and non-coding transcriptomic perspective on the genomics of human metabolic disease. Nucleic Acids Res. 2018;46(15):7772-7792. https://doi.org/10.1093/nar/gky570
5. Scott LJ, Erdos MR, Huyghe JR, et al. The genetic regulatory signature of type 2 diabetes in human skeletal muscle. Nat Commun. 2016;7:11764. https://doi.org/10.1038/ncomms11764
6. Varemo L, Scheele C, Broholm C, et al. Proteome- and transcriptome-driven reconstruction of the human myocyte metabolic network and its use for identification of markers for diabetes. Cell Rep. 2015;11(6):921-933. https://doi.org/10.1016/j.celrep.2015.04.010
7. Parikh HM, Elgzyri T, Alibegovic A, et al. Relationship between insulin sensitivity and gene expression in human skeletal muscle. BMC Endocr Disord. 2021;21(1):32. https://doi.org/10.1186/s12902-021-00687-9
8. Cen HH, Hussein B, Botezelli JD, et al. Human and mouse muscle transcriptomic analyses identify insulin receptor mRNA downregulation in hyperinsulinemia-associated insulin resistance. FASEB J. 2022;36(1):e22088. https://doi.org/10.1096/fj.202100497RR
9. Coletta DK, Balas B, Chavez AO, et al. Effect of acute physiological hyperinsulinemia on gene expression in human skeletal muscle in vivo. Am J Physiol Endocrinol Metab. 2008;294(5):E910-7. https://doi.org/10.1152/ajpendo.00607.2007
10. Wu X, Wang J, Cui X, et al. The effect of insulin on expression of genes and biochemical pathways in human skeletal muscle. Endocrine. 2007;31(1):5-17. https://doi.org/10.1007/s12020-007-0007-x
11. Lutter D, Sachs S, Walter M, et al. Skeletal muscle and intermuscular adipose tissue gene expression profiling identifies new biomarkers with prognostic significance for insulin resistance progression and intervention response. Diabetologia. May 2023;66(5):873-883. https://doi.org/10.1007/s00125-023-05874-y
12. van Bussel IPG, Fazelzadeh P, Frost GS, Rundle M, Afman LA. Measuring phenotypic flexibility by transcriptome time-course analyses during challenge tests before and after energy restriction. FASEB J. 2019;33(9):10280-10290. https://doi.org/10.1096/fj.201900148R
13. Rijkelijkhuizen JM, Girman CJ, Mari A, et al. Classical and model-based estimates of beta-cell function during a mixed meal vs. an OGTT in a population-based cohort. Diabetes Res Clin Pract. 2009;83(2):280-8. https://doi.org/10.1016/j.diabres.2008.11.017
14. Shankar SS, Vella A, Raymond RH, et al. Standardized Mixed-Meal Tolerance and Arginine Stimulation Tests Provide Reproducible and Complementary Measures of beta-Cell Function: Results From the Foundation for the National Institutes of Health Biomarkers Consortium Investigative Series. Diabetes Care. 2016;39(9):1602-13. https://doi.org/10.2337/dc15-0931
15. Lednev EM, Gavrilova AO, Vepkhvadze TF, et al. Disturbances in Dynamics of Glucose, Insulin, and C-Peptide in Blood after a Normalized Intake of a Mixed Meal in Obesity and Type 2 Diabetes Mellitus. Hum Physiol. 2023;49:668–674. https://doi.org/10.1134/S0362119723600297
16. Makhnovskii PA, Lednev EM, Gavrilova AO, et al. Dysregulation of early gene response to a mixed meal in skeletal muscle in obesity and type 2 diabetes. Physiol Genomics. 2023;55(10):468-477. https://doi.org/10.1152/physiolgenomics.00046.2023
17. Ware JJr, Kosinski M, Keller SD. A 12-Item Short-Form Health Survey: construction of scales and preliminary tests of reliability and validity. Med Care. 1996;34(3):220-33. https://doi.org/10.1097/00005650-199603000-00003
18. Xu X, Zhang T, Mokou M, et al. Follistatin-like 1 as a Novel Adipomyokine Related to Insulin Resistance and Physical Activity. J Clin Endocrinol Metab. 2020;105(12) https://doi.org/10.1210/clinem/dgaa629
19. Lee HJ, Lee JO, Lee YW, Kim SA, Park SH, Kim HS. Kalirin, a GEF for Rac1, plays an important role in FSTL-1-mediated glucose uptake in skeletal muscle cells. Cell Signal. 2017;29:150-157. https://doi.org/10.1016/j.cellsig.2016.10.013
20. Seki M, Powers JC, Maruyama S, et al. Acute and Chronic Increases of Circulating FSTL1 Normalize Energy Substrate Metabolism in Pacing-Induced Heart Failure. Circ Heart Fail. 2018;11(1):e004486. https://doi.org/10.1161/CIRCHEARTFAILURE.117.004486
21. Montgomery MK, Bayliss J, Devereux C, et al. SMOC1 is a glucose-responsive hepatokine and therapeutic target for glycemic control. Sci Transl Med. 2020;12(559). https://doi.org/10.1126/scitranslmed.aaz8048
22. Vaittinen M, Kolehmainen M, Schwab U, Uusitupa M, Pulkkinen L. Microfibrillar-associated protein 5 is linked with markers of obesity-related extracellular matrix remodeling and inflammation. Nutr Diabetes. 2011;1(8):e15. https://doi.org/10.1038/nutd.2011.10
23. Hirata Y, Nomura K, Senga Y, et al. Hyperglycemia induces skeletal muscle atrophy via a WWP1/KLF15 axis. JCI Insight. 2019;4(4) https://doi.org/10.1172/jci.insight.124952
24. Cikes D, Leutner M, Cronin SJF, et al. Gpcpd1-GPC metabolic pathway is dysfunctional in aging and its deficiency severely perturbs glucose metabolism. Nat Aging. 2024;4(1):80-94. https://doi.org/10.1038/s43587-023-00551-6
25. Zhang C, Caldwell TA, Mirbolooki MR, et al. Extracellular CADM1 interactions influence insulin secretion by rat and human islet beta-cells and promote clustering of syntaxin-1. Am J Physiol Endocrinol Metab. 2016;310(11):E874-85. https://doi.org/10.1152/ajpendo.00318.2015
26. Kang G, Han HS, Koo SH. NFIL3 is a negative regulator of hepatic gluconeogenesis. Metabolism. 2017;77:13-22. https://doi.org/10.1016/j.metabol.2017.08.007
27. Saliba LF, Reis RS, Brownson RC, et al. Obesity-related gene ADRB2, ADRB3 and GHRL polymorphisms and the response to a weight loss diet intervention in adult women. Genet Mol Biol. 2014;37(1):15-22. https://doi.org/10.1590/s1415-47572014000100005
28. Mitra SR, Tan PY, Amini F. Association of ADRB2 rs1042713 with Obesity and Obesity-Related Phenotypes and Its Interaction with Dietary Fat in Modulating Glycaemic Indices in Malaysian Adults. J Nutr Metab. 2019;2019:8718795. https://doi.org/10.1155/2019/8718795
29. de Souza ESS, Leite N, Furtado-Alle L, et al. ADRB2 gene influences responsiveness to physical exercise programs: A longitudinal study applied to overweight or obese Brazilian children and adolescents. Gene. 2022;820:146296. doi: https://doi.org/10.1016/j.gene.2022.146296
Об авторах
П. А. МахновскийРоссия
Махновский Павел Александрович - к.б.н.; RecearcherID: S-7611-2018; Scopus Author ID: 55985671700; eLibrary SPIN: 6720-5905
123007, Москва, Хорошевское шоссе, 76А
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. С. Курочкина
Россия
Курочкина Надежда Сергеевна - RecearcherID: JWP-2837-2024; Scopus Author ID: 55887468500.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Т. Ф. Вепхвадзе
Россия
Вепхвадзе Татьяна Федоровна - к.б.н.; RecearcherID: E-3870-2014; Scopus Author ID: 56904245200; eLibrary SPIN: 1411-7760.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. О. Томилова
Россия
Томилова Алина Олеговна – аспирант; eLibrary SPIN: 8814-0121.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. М. Леднев
Россия
Леднев Егор Михайлович - к.м.н.; RecearcherID: R-9019-2018; Scopus Author ID: 57192209774; eLibrary SPIN: 5096-2065.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. В. Шестакова
Россия
Шестакова Марина Владимировна - д.м.н., профессор, академик РАН; RecearcherID: HKO-5485-2023; Scopus Author ID: 7004195530; eLibrary SPIN: 7584-7015.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Д. В. Попов
Россия
Попов Даниил Викторович - д.б.н., профессор РАН; RecearcherID: E-3913-2014; Scopus Author ID: 25643759400.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Схема эксперимента (А) и поиска экспрессионных маркеров, ассоциированных с показателями обмена глюкозы (Б). | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(339KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Изменение содержания глюкозы, инсулина и С-пептида в крови после приема смешанной пищи, нормированной на массу тела, у здоровых людей (H), пациентов с ожирением без (Ob) и с СД2 (T2D). Представлена динамика этих показателей (А) и прирост площади под кривой (iAUC) (Б); × — отличие от исходного уровня; * — отличие от контроля. Один, два и три символа — p≤0,05, ≤0,01 и ≤0,001 соответственно. | |
| Тема | ||
| Тип | Результаты исследования | |
Посмотреть
(564KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Корреляции базальной экспрессии (А) и изменений экспрессии генов в скелетной мышце после приема пищи (Б) с базальным уровнем (утром натощак) С-пептида, инсулина и глюкозы в венозной крови, а также с их приростом после приема пищи. Линиями обозначены сильные значимые корреляции (|ρ|>0,7; p<0,001). Цветные круги показывают гены, базальная экспрессия (А) или изменение экспрессии (Б) которых в ответ на прием пищи различается между группами >1,5 раза (зеленый — Ob vs. H, синий T2D vs. H, красный — объединенная группа Ob + T2D vs. H). Заливка круга показывает класс белка. | |
| Тема | ||
| Тип | Результаты исследования | |
Посмотреть
(872KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Примеры корреляций между потенциальными экспрессионными маркерами метаболических нарушений (гены Follistatin like 1, SPARC Related Modular Calcium Binding 1, Glycerophosphocholine Phosphodiesterase, Adrenoceptor Beta 2) и показателями метаболизма глюкозы. Здоровые добровольцы (H) — зеленый, пациенты с ожирением (Ob) — синий, пациенты с ожирением и сахарным диабетом 2 типа (T2D) — красный. | |
| Тема | ||
| Тип | Анализ данных | |
Посмотреть
(311KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Махновский П.А., Курочкина Н.С., Вепхвадзе Т.Ф., Томилова А.О., Леднев Е.М., Шестакова М.В., Попов Д.В. Экспрессионные маркеры скелетной мышцы человека, ассоциированные с нарушениями глюкозного метаболизма в базальном состоянии и после приема пищи. Сахарный диабет. 2024;27(5):411-421. https://doi.org/10.14341/DM13166
For citation:
Makhnovskii P.A., Kurochkina N.S., Vepkhvadze T.F., Tomilova A.O., Lednev E.M., Shestakova M.V., Popov D.V. Expression markers of human skeletal muscle associated with disorders of glucose metabolism in the basal and postprandial state. Diabetes mellitus. 2024;27(5):411-421. (In Russ.) https://doi.org/10.14341/DM13166

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































