Перейти к:
Гипонатриемия как проявление хронической надпочечниковой недостаточности у пациентки с сахарным диабетом 1 типа и трансплантацией почки вследствие терминальной хронической болезни почек
https://doi.org/10.14341/DM13163
Аннотация
Сахарный диабет 1 типа и хроническая надпочечниковая недостаточность (ХНН) являются одними из наиболее частых аутоиммунных эндокринных заболеваний, которые развиваются как изолированно, так и в сочетании друг с другом и с другими заболеваниями аутоиммунного генеза, в составе различных синдромов. При этом СД 1 достаточно часто является первым компонентом системного аутоиммунного поражения и выступает в качестве предиктора развития хронической надпочечниковой недостаточности. В свою очередь, ХНН на фоне СД 1 приобретает стертое, подчас нетипичное течение, что затрудняет диагностику и назначение терапии. Клинический случай описывает пациентку с СД 1 типа и терминальной стадией ХБП, аллотрансплантацией почки, находившейся на трехкомпонентной иммуносупрессивной терапии, с развившейся хронической надпочечниковой недостаточностью, которая проявлялась выраженной гипонатриемией и возникновением частых гипогликемических состояний.
Ключевые слова
Для цитирования:
Хагабанова И.С., Викулова О.К., Шамхалова М.Ш., Пигарова Е.А., Мартынов С.А., Калашников В.Ю. Гипонатриемия как проявление хронической надпочечниковой недостаточности у пациентки с сахарным диабетом 1 типа и трансплантацией почки вследствие терминальной хронической болезни почек. Сахарный диабет. 2024;27(3):295-301. https://doi.org/10.14341/DM13163
For citation:
Khagabanova I.S., Vikulova O.K., Shamkhalova M.S., Pigarova E.A., Martinov S.A., Kalashnikov V.Y. Hyponatremia as acute adrenal insufficiency in patients with type 1 diabetes mellitus and kidney transplantation cause end-stage chronic kidney disease. Diabetes mellitus. 2024;27(3):295-301. (In Russ.) https://doi.org/10.14341/DM13163
АКТУАЛЬНОСТЬ
Сахарный диабет (СД) признан всемирно значимой неинфекционной эпидемией, преимущественно за счет стремительного роста распространенности СД 2 типа (СД2). Согласно масштабному динамическому наблюдению, по данным Федерального регистра сахарного диабета, общая численность пациентов с СД в РФ, состоящих на диспансерном учете, на 01.01.2023 г. составила 4 962 762 (3,31% населения РФ), из них с СД 1 типа (СД1) — 5,58% (277,1 тыс.) [1]. При меньших показателях распространенности СД1 социально-экономическое влияние данной патологии не менее велико и представляет собой значительную угрозу за счет развития множественных осложнений, приводящих к ранней инвалидизации и смертности.
В свою очередь первичная хроническая надпочечниковая недостаточность (ХНН) — относительно редкое заболевание с распространенностью в мире приблизительно 100–144 случая на миллион населения [2]. У значительной части больных развитие ХНН аутоиммунного генеза коррелирует с наличием в анамнезе других аутоиммунных заболеваний. В долгосрочном исследовании, включавшем 126 пациентов с ХНН, 73,6% пациентов имели другие аутоиммунные заболевания, среди которых у 30,4% было аутоиммунное заболевание щитовидной железы и 6% — СД1 [3].
Поскольку ХНН встречается редко и ее симптоматика часто неспецифична, диагноз можно легко упустить из виду, и требуется клиническая настороженность в отношении этого заболевания. ХНН определяется неспособностью коры надпочечников произвести достаточное количество глюко- и минералокортикоидов. Дефицит кортизола посредством обратной связи воздействует на гипоталамо-гипофизарную ось и приводит к повышению уровня адренокортикотропного гормона (АКТГ). При минералокортикоидной недостаточности возрастает уровень ренина, синтезирующегося юкстагломерулярными клетками почек. При ХНН часто наблюдаются: потеря веса, ортостатическая гипотензия вследствие обезвоживания, тяга к соленому, гипонатриемия, гиперкалиемия (чаще после манифестации гипонатриемии), изменения в клиническом анализе крови (анемия, эозинофилия, лимфоцитоз) и гипогликемия [4]. Пигментация кожи, наиболее отчетливо заметная на кожных складках и рубцах, разгибательной поверхности локтя, суставах пальцев, губах и слизистой оболочке десен, присутствует у 90% людей с ХНН. Клинические признаки минералокортикоидной недостаточности включают гипотонию, слабость, тягу к соли и электролитные нарушения (гиперкалиемию, гипонатриемию). Минералокортикоидная недостаточность подтверждается выраженным снижением альдостерона и высокой активностью ренина плазмы. При ХНН более выражены признаки минералокортикоидной недостаточности, включая постуральную гипотензию, мышечные судороги, дискомфорт в животе и тягу к соли [5].
В данной статье продемонстрировано успешное лечение препаратами минералокортикоидов у коморбидной пациентки с длительным течением СД1, находящейся на трехкомпонентной иммуносупрессивной терапии в связи с аллотрансплантацией трупной почки (АТТП), перенесшей бактериальную кишечную инфекцию неуточненной этиологии, выступившей в качестве триггера развившейся гипонатриемиии, генезом которой предположено развитие надпочечниковой недостаточности.
ПРЕДСТАВЛЕНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ И ЕГО ОБСУЖДЕНИЕ
Пациентка С., 57 лет, с типичным дебютом СД1 в детском возрасте, с длительностью СД 47 лет, с развившимися за этот период множественными диабетическими осложнениями, в том числе терминальной стадией хронической болезни почек (ХБП), по поводу которой в 2013 г. выполнена успешная АТТП, регулярно наблюдавшаяся в отделении диабетической болезни почек и посттрансплантационной реабилитации, была госпитализацирована 09.2023 г. Помимо классических диабетических жалоб на повышение сахара в крови до 12 ммоль/л, повторяющиеся эпизоды гипогликемии в течение суток, чаще ночью, повышение АД до 180/100 мм рт. ст. на фоне постоянной антигипертензивной терапии, преимущественно в вечернее время суток, пациентка в течение нескольких месяцев отметила достаточно выраженное снижение памяти, внимания, нарушение сна, общую слабость, утомляемость.
При поступлении сразу же были отмечены изменения характера и поведения, а также эмоциональная лабильность, раздражительность и негативизм, нетипичные для данной пациентки.
Пациентка регулярно проходит стационарное лечение. Диагноз СД1 установлен с 1976 г. (в возрасте 10-ти лет). Со слов пациентки, эпизоды гипогликемии — ежедневно, преимущественно в ночное время суток и ранние утренние часы, купирует приемом сока, однако имеются признаки частых хронических гипогликемий (нарушение памяти, неспособность к концентрации внимания, апатия), которые пациентка не ощущает. В анамнезе эпизод тяжелой гипогликемии с потерей сознания около 1,5 года назад с вызовом скорой медицинской помощи — купирован внутривенным введением глюкозы. Динамика гликированного гемоглобина: от 06.2021 г. — 7,4%, от 02.2022 — 8,2%. На момент поступления в стационар 09.2023 г. — 6,5%.
Диабетическая ретинопатия с 1997 г., на момент госпитализации установлена диабетическая пролиферативная ретинопатия. Состояние после панретинальной лазерной коагуляции сетчатки от 2002, 2003 гг.
Диабетическая нефропатия верифицирована в 1991 г. терминальная почечная недостаточность (ТПН) — с 1996 г., переведена на заместительную почечную терапию — гемодиализ с 04.2011 по 2013 г. В 2013 г. в Московском городском научно-исследовательском институте скорой помощи им. Н.В. Склифосовского выполнена АТТП, по поводу которой получает трехкомпонентную иммуносупрессивную терапию: метилпреднизолон 4 мг/сут, циклоспорин 150 мг/сут, микофеноловая кислота 720 мг/сут. На момент госпитализации функция трансплантата в рамках ХБПС3bА2: скорость клубочковой фильтрации по пробе Реберга 43 мл/мин, соотношение альбумин/креатинин 4,3 мг/ммоль.
Ухудшение самочувствия пациентка отмечает в течение 3 месяцев, когда на фоне бактериальной кишечной инфекции неясной этиологии поступила в инфекционную клиническую больницу (ИКБ) №2 с выраженным интоксикационным синдромом, фебрильной лихорадкой, повышением АД до 180/100 мм рт.ст. Получала эмпирическую антибактериальную терапию (цефтриаксон 2 г/сут парентерально), дезинтоксикационную и симптоматическую терапию, после чего сохранялось повышение АД до 160/90 мм рт.ст., нарушение памяти, общая слабость.
Объективно: кожные покровы смуглые, гиперпигментация в области локтей, кожных складок и рубцов. Отмечается пастозность нижней трети голеней и стоп. При пальпации щитовидная железа не увеличена, мягкая, безболезненная, узловых образований не выявлено, клинически эутиреоз. Сердечно-сосудистая система: АД справа 126/84 мм рт.ст., частота пульса 72 уд/мин, аускультация сердца: тоны ясные, шумов нет.
При поступлении пациентки были сформулированы основные клинические проблемы, заключавшиеся в нестабильности показателей гликемии, в частых эпизодах гипогликемии, вне связи с физической нагрузкой, преимущественно в ранние утренние часы на фоне стабильной дозы инсулинотерапии и стабильной функции почек, в повышении АД на фоне постоянной четырехкомпонентной антигипертензивной терапии. При этом гипонатриемия, развившаяся на фоне перенесенной кишечной инфекции и сохранявшаяся в течение последующих 3-х месяцев в отсутствие явных этиологических предпосылок для ее персистенции, явилась признаком, определившим начало диагностического маршрута.
В биохимическом анализе крови, наряду с типичными диабетическими нарушениями (гипергликемия, дислипидемия, гиперурикемия) была выявлена выраженная гипонатриемия 127 ммоль/л (референсный интервал 136,0–145,0 мкмоль/л), сохранявшаяся при двух повторных исследованиях (рис. 1), что является нехарактерным при СД, особенно в сочетании с ХБП и артериальной гипертензией. В анамнезе у пациентки при регулярных госпитализациях нарушений электролитов крови выявлено не было. При прицельном изучении анамнеза и медицинской документации установлено, что дебют электролитных нарушений развился после перенесенной бактериальной кишечной инфекции неуточненной этиологии, потребовавшей госпитализации в ИКБ№2, где была впервые зарегистрирована гипонатриемия, не вызвавшая клинической настороженности (натрий сыворотки 124 ммоль/л). После выписки из инфекционного стационара контроль натрия не проводился.
Натрий — витальный электролит, играет важнейшую роль в регуляции и поддержании баланса жидкости в организме, в том числе объема циркулирующей крови и уровня АД, а также участвует в обеспечении нервной проводимости и мышечной сократимости.
Гипонатриемия — состояние, при котором концентрация ионов натрия в плазме крови снижается менее 136 ммоль/л (в норме 136–142 ммоль/л). Гипонатриемия напрямую коррелирует с повышенным риском смертности. Так, Роттердамское исследование показало, что развитие гипонатриемии приводит к повышению риска смерти на 21%, риска переломов на 35–61%, независимо от первичной нозологии. При этом повышение риска переломов связано с атаксией; установлено, что вероятность падения повышается в 4 раза при уровне натрия менее 130 ммоль/л, а нарушения равновесия могут быть выражены сильнее, чем при алкогольном опьянении [6]. Клинические проявления при гипонатриемии неспецифичны, связаны с отеком клеток и последующим снижением функций головного мозга, что очень часто пропускается в клинической практике. Несмотря на то, что некоторые авторы расценивают гипонатриемию как маркер тяжести основного заболевания, а не самостоятельный фактор риска повышенной смертности, все больше исследований свидетельствуют в пользу того, что гипонатриемия сама по себе дополнительный фактор риска неблагоприятных исходов [4][7][8][9]. Исследование среди госпитализированных пациентов показало, что тяжелая гипонатриемия (менее 125 ммоль/л) сопряжена с трехкратным увеличением смертности по сравнению с группой пациентов, поступивших с нормальным уровнем натрия [16].
Развитие гипонатриемии нехарактерно для пациентов с СД, ХБП и артериальной гипертензией с классической гиперактивацией ренинангиотензинальдостероновой системой (РААС) и ожидаемым повышением уровня альдостерона [10]. Гиперактивация РААС в свою очередь является основой не только для гемодинамических, но и электролитных нарушений при СД. Основной функцией РААС является поддержание системного АД, что достигается путем эффектов ангиотензина II, который регулирует синтез и секрецию альдостерона надпочечниками, баланс жидкости путем влияния на реабсорбцию натрия в дистальных отделах почечных канальцев [11]. Учитывая наличие у пациентки почечного трансплантата, следует исключить гипоренинемический гипоальдостеронизм (ГГ). Для данного синдрома характерен дефицит альдостерона, обусловленный в большинстве случаев снижением ферментативно активного ренина в плазме. Низкий уровень натрия в плазме или низкий почечный кровоток стимулируют преобразование проренина в активный ренин в юкстагломерулярных (ЮГ) клетках почек. Ренин превращает ангиотензиноген в ангиотензин I, который затем превращается в ангиотензин II под действием ангиотензинпревращающего фермента (АПФ), обнаруженного в эндотелиальных клетках капилляров по всему организму. Ангиотензин II вызывает сужение артериол, что приводит к повышению артериального давления, а также стимулирует секрецию альдостерона надпочечниками. Альдостерон стимулирует почечную канальцевую реабсорбцию натрия, одновременно вызывая экскрецию калия с мочой. Следовательно, резистентность к альдостерону или дефицит альдостерона из-за нарушения выработки ренина клетками ЮГ, как это наблюдается при ГГ, приведет к нарушению экскреции калия [16]. Таким образом, основным клиническим проявлением ГГ является гиперкалиемия, которая для пациентки С. была нехарактерна (табл. 1).
Дебют электролитных нарушений развился после перенесенной кишечной инфекции неуточненной этиологии, потребовавшей госпитализации в ИКБ№2.
В развитии гипонатриемии выделяют целый ряд причин, как связанных с почечной патологией, так и внепочечного генеза (рис. 2).
Среди всех факторов нарушения желудочно-кишечного тракта (ЖКТ) являются одними из наиболее частых состояний, вызывающих преходящую кратковременную гипонатриемию. В данном случае у пациентки после купирования инфекционных проявлений сохранялась стойкая гипонатриемия в течение 3-х месяцев при ретроспективной оценке лабораторных показателей после перенесенной ЖКТ-инфекции.
Изначально гипонатриемия была расценена нами как возможное проявление хронической сердечной недостаточности (ХСН), подтвержденной результатами обследования: Pro-BNP (635,4 пг/мл), при ЭХО-КГ фракция выброса (ФВ) 60%. Пациентка консультирована кардиологом, подтвержден диагноз ХСН с сохраненной ФВ (60%), NYHA II. АД контролировалось увеличением дозы антигипертензивной терапии с увеличением дозы блокаторов кальциевых каналов (нифедипин) с 60 до 90 мг/сут. с достижением индивидуального целевого диапазона АД (систолическое АД <130 и >/= 120, диастолическое АД <80 и >/=70 мм рт. ст). Были назначены стандартные мероприятия по коррекции гипонатриемии с увеличением суточного потребления соли до 8–10 г/сут в сочетании с ограничением питьевого режима до 1500 мл в сутки под контролем диуреза, АД и натрия в динамике. Однако после контроля натрия через 6 дней положительная динамика натриемии не была достигнута. Таким образом, клинические и лабораторные показатели пациентки не укладывались в стандартную клиническую картину СД, ХБП и ХСН.
Исключено развитие гипонатриемии вследствие применения диуретиков, так как антидиуретической терапии в анамнезе не было.
«Сольтеряющая почка» — одна из основных почечных причин гипонатриемии, характерным является выраженная натрийурия. Для исключения синдрома «сольтеряющей почки» исследованы показатели натрия в моче, которые были в пределах референсных значений (табл. 2), что позволило отвергнуть данную причину.
С целью определения алгоритма диагностического поиска для верификации генеза гипонатриемии был проведен врачебный консилиум с участием специалистов эндокринологов, кардиолога, нефролога и нейроэндокринолога. Тщательно проанализировав данные анамнеза, а также лабораторные показатели в динамике, отсутствие положительной динамики на фоне предпринятой тактики расширения потребления соли и ограничения жидкостного режима до 1500 мл/сут, был проведен поиск возможных причин гипонатриемии.
В ходе консилиума исключен генез гипонатриемии вследствие декомпенсации ХСН, поскольку отсутствовали другие признаки ухудшения сердечно-сосудистой системы: отсутствие отечного синдрома и даже ранних проявлений гипергидратации по данным биоимпедансометрии, отсутствие одышки, а также высокая толерантность пациентки к физическим нагрузкам (пациентка занимается скандинавской ходьбой, проходит до 5–7 км).
Консилиумом специалистов выдвинуто предположение о возможном развитии надпочечниковой недостаточности (ХНН) как самостоятельного заболевания аутоиммунного генеза у пациентки с СД1, либо опосредованно на фоне получаемой трехкомпонентной иммуносупрессивной терапии (метилпреднизолон 4 мг/сут, циклоспорин 150 мг/сут, микофеноловая кислота 720 мг/сут). Роль триггера для проявления ХНН в данном случае могла сыграть инфекция, существенно повысившая потребность организма в гормонах надпочечников, выполняющих адаптивную роль в условиях любого соматического стрессорного фактора.
По данным литературы, гипонатриемия присутствует более чем у 90% пациентов с ХНН на момент постановки диагноза, в то время как гиперкалиемия, которую чаще рассматривают в качестве классического признака недостаточности функции надпочечников, — встречается лишь у 50% пациентов [5].
Еще одним признаком, укладывающимся в концепцию надпочечниковой недостаточности, было учащение у пациентки гипогликемических эпизодов, проявлявшихся именно в ранние утренние часы, что характерно для этой нозологии вследствие уменьшения гипергликемического влияния кортизола. Кортизол является контринсулярным гормоном, при его недостаточности возникает состояние относительной гиперинсулинемии. При сочетании хронической надпочечниковой недостаточности с СД характерно возникновение частых эпизодов гипогликемий, механизм возникновения которых кроется в снижении уровня глюконеогенеза, что приводит к уменьшению потребности организма в инсулине [3][12]. В отделении была проведена коррекция настроек инсулиновой помпы под контролем непрерывного мониторинга глюкозы, существенно снижена суточная доза инсулина, преимущественно за счет базального в ночное время и ранние утренние часы. Рецидивирующие эпизоды гипогликемий были устранены, достигнута положительная динамика показателей гликемии и стабилизация суточного профиля.
ХНН может являться компонентом аутоиммунного полигландулярного синдрома 2-го типа (АПС 2-го типа), включающем, помимо первичной надпочечниковой недостаточности и СД1, другие аутоиммунные заболевания: первичный гипогонадизм, миастения, целиакия, пернициозная анемия, алопеция, витилиго, серозит. АПС 2-го типа встречается примерно в 1–2 случаях на 100 000 жителей, причем женщины заболевают в 3–4 раза чаще мужчин [13]. В случае АПС 2-го типа дебют надпочечниковой недостаточности характерен в более раннем возрасте — от 20 и не более 40 лет и имеет более яркую клиническую симптоматику. Диагностические трудности лабораторного подтверждения первичной надпочечниковой недостаточности аутоиммунного генеза достаточно затруднены в связи с отсутствием возможности определения антител к 21-гидроксилазе (АТ-21ОН) либо антител к 17-гидроксипрогестерону (17ОНП), являющихся основными диагностическими маркерами аутоиммунной надпочечниковой недостаточности.
В данном случае у пациентки С. состоялся неклассический дебют надпочечниковой недостаточности после длительного течения СД1 в течение 47 лет, на фоне комплекса факторов, выступивших в роли катализатора угасания функций надпочечников. С этой точки зрения, развитие надпочечниковой недостаточности может быть связано с хронической иммуносупрессивной терапией глюкокортикоидами, угнетающими синтез АКТГ. Согласно исследованиям in vivo предполагается, что АКТГ является кратковременным стимулятором выработки альдостерона, однако исследования in vitro показали, что АКТГ может действовать как главный стимулятор секреции альдостерона. Непрерывное внутривенное введение АКТГ приводит к преходящей стимуляция секреции альдостерона, тогда как его пульсирующее введение приводит к его устойчивой стимуляции [14]. Таким образом, угнетающее влияние иммуносупрессивной терапии на АКТГ может стимулировать снижение альдостерона, основной функцией которого является регуляция электролитов, в том числе реабсорбция натрия. Терапия метипредом у данной пациентки в составе иммуносупрессивной терапии по поводу АТТП относительно компенсировала проявления глюкортикоидного звена надпочечниковой недостаточности, в то время как минералокортикоидный компонент проявился «яркой» клинической картиной выраженной гипонатриемии.
Пациентам с клиническими симптомами, похожими на надпочечниковую недостаточность, для уточнения диагноза рекомендуется исследование уровней общего кортизола, АКТГ, альдостерона и ренина в крови утром. По техническим причинам ренин определен не был. При определении кортизола и альдостерона отмечались референсные показатели, приближенные к нижним границам нормы (табл. 3), что у данной пациентки, вероятно, обусловлено восполнением глюкокортикоидного компонента заместительной терапией метилпреднизолоном (4 мг), получаемой пациенткой по поводу АТТП. В данном случае компенсация уровня глюкокортикоидов «стирала» клиническую картину, на фоне чего на первый план вышло развитие электролитных нарушений на фоне дефицита минералокортикоидного компонента надпочечниковой функции.
На основании проведенного консилиума принято коллегиальное решение коррекции гипонатриемии следующими методами: наряду с расширением потребления соли и умеренным ограничением жидкости до 1,5 л/сут назначены минералокортикоиды (флудрокортизон 0,05 мг) под контролем суточного мониторирования АД, оценки показателя натрия в динамике.
При определении натрия сыворотки спустя 7 дней заместительной минералокортикоидной терапии отмечена положительная динамика в виде восполнения натрия сыворотки крови до 136,5 ммоль/л, и с сохранением в пределах референсного интервала при дальнейшем контроле через 1 и 2 мес. Это позволяет говорить об эффективности терапии ex juvantibus и косвенно подтверждает диагноз надпочечниковой недостаточности. Верифицировать диагноз надпочечниковой недостаточности подтверждением низких значений кортизола не представлялось возможным в условиях необходимости пожизненного продолжения иммуносупрессии.
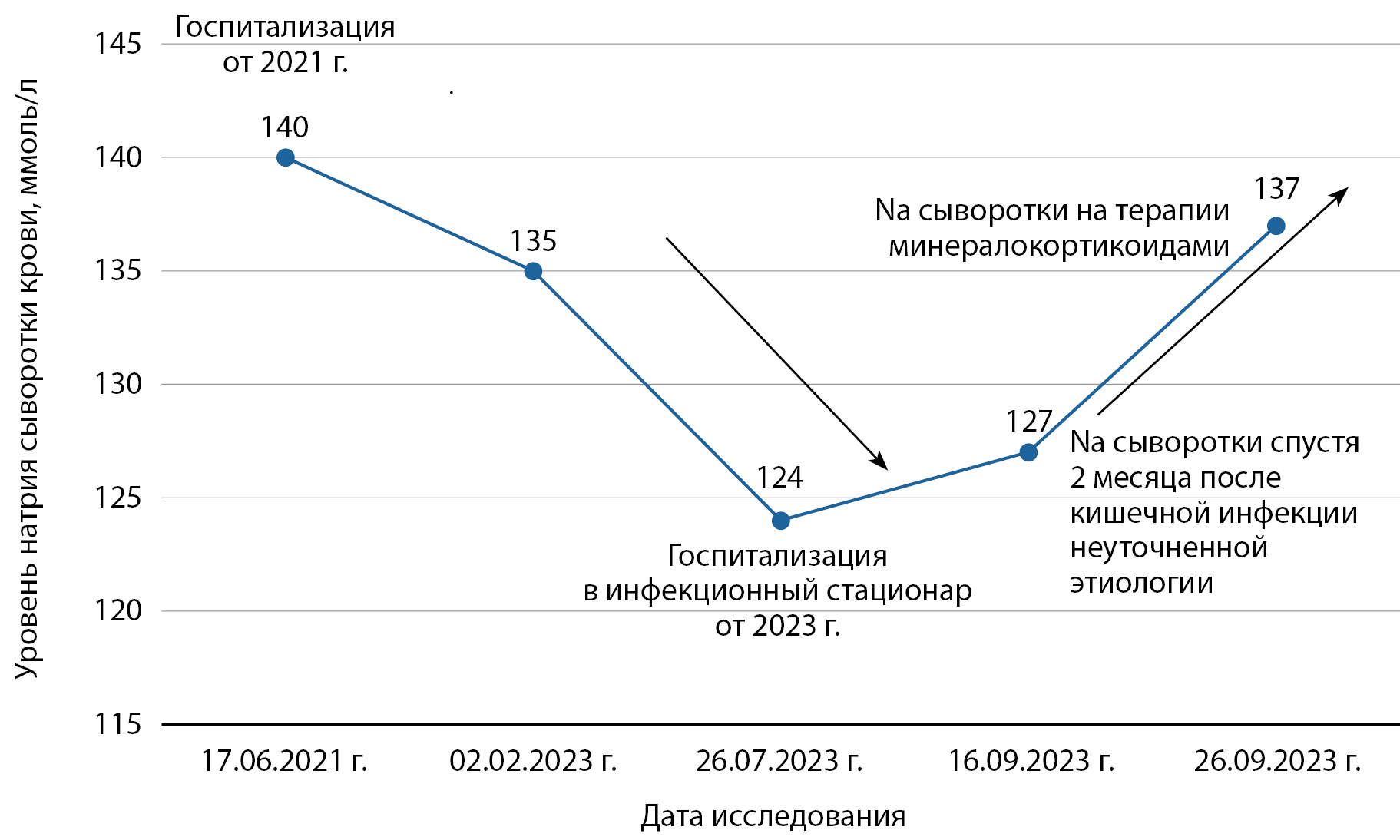
Рисунок 1. Динамика уровня натрия сыворотки.
Таблица 1. Показатели электролитов пациентки при поступлении в стационар в сентябре 2023 г.
|
Показатель |
Результат |
Единица измерения |
Норма |
|
Натрий |
127< |
ммоль/л |
136–145 |
|
Калий |
4,76 |
ммоль/л |
3,5–5,1 |
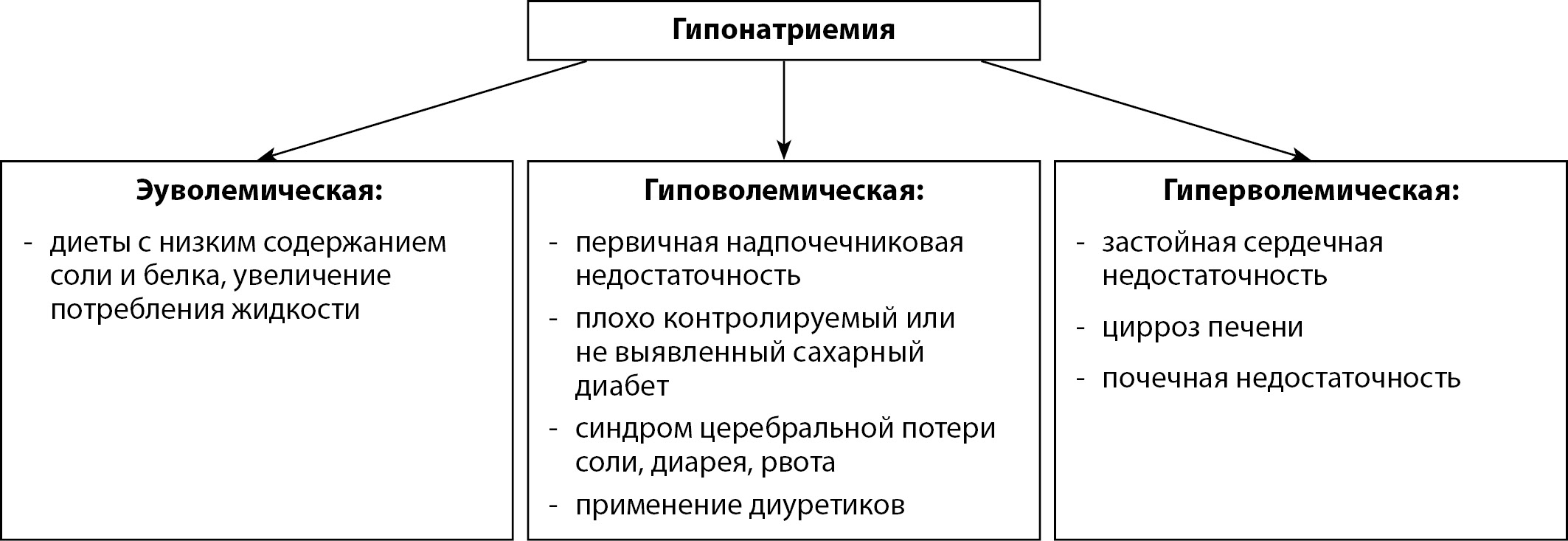
Рисунок 2. Причины гипонатриемии. Адаптировано из [15].
Таблица 2. Показатели электролитов пациентки в период госпитализации в сентябре 2023 г.
|
Показатель |
Результат |
Единица измерения |
Норма |
|
Натрий (раз. моча) |
28,3 |
ммоль/л |
27–287 |
|
Натрий (сут. моча) |
66,6 |
ммоль/сут |
40–220 |
|
Натрий сыворотки крови при поступлении |
127 |
ммоль/л |
136–145 |
|
Натрий сыворотки через 3 дня после инициации заместительной терапии минералокортикоидами |
132 |
ммоль/л |
136–145 |
|
Натрий сыворотки крови через неделю после инициации заместительной терапии минералокортикоидами |
136,5 |
ммоль/л |
136–145 |
Таблица 3. Определение кортизола и альдостерона в крови утром от 21.09.2023 г.
|
Показатель |
Результат |
Единица измерения |
Норма |
|
Кортизол в крови утром |
317,4 |
нмоль/л |
171–536 |
|
Альдостерон |
190 |
пмоль/л |
48,7–653,7 |
ЗАКЛЮЧЕНИЕ
Таким образом, данный клинический случай демонстрирует, что за стойкой гипонатриемией в сочетании с тяжелыми повторяющимися эпизодами гипогликемий и снижением общей потребности в инсулине может стоять надпочечниковая недостаточность, которая, в свою очередь, диктует необходимость мультидисциплинарного подхода и клинической настороженности в отношении скрытой ХНН у пациентов с СД1 и хроническими гипогликемиями и гипонатриемией.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование проведено в рамках выполнения государственного задания Минздрава РФ №123021000038-6.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Хагабанова И.С., Викулова О.К. — все этапы лечения пациентки, консилиум, написание статьи; Шамхалова М.Ш. — консилиум и финальная правка статьи; Пигарова Е.А., Мартынов С.А., Калашников В.Ю. — участие в консилиуме с определением лечебно-диагностической тактики. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. //Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. doi: https://doi.org/10.14341/DM13035
2. Фадеев В.В., Мельниченко Г.А. Заместительная терапия первичной хронической надпочечниковой недостаточности // Проблемы эндокринологии. — 2000. — Т. 46. — №3. — С. 31-45. doi: https://doi.org/10.14341/probl11852
3. Ajaz F, Kudva YC, Erwin PJ. Residual dysphasia after severe hypoglycemia in a patient with immune-mediated primary adrenal insufficiency and type 1 diabetes mellitus: case report and systematic review of the literature. Endocr Pract. 2007;13(4):384-388. doi: https://doi.org/10.4158/EP.13.4.384
4. Chawla A, Sterns RH, Nigwekar SU, et al. Mortality and serum sodium: do patients die from or with hyponatremia? // Clin J Am Soc Nephrol. 2011;6(5):960-965. doi: https://doi.org/10.2215/CJN.10101110
5. Pazderska A, Pearce SH. Adrenal insufficiency — recognition and management. Clin Med (Lond). 2017;17(3):258-262. doi: https://doi.org/10.7861/clinmedicine.17-3-258
6. Renneboog B, Musch W, Vandemergel X, et al. Mild chronic hyponatremia is associated with falls, unsteadiness, and attention deficits. Am J Med. 2006;119(1):71.e1-71.e718. doi: https://doi.org/10.1016/j.amjmed.2005.09.026
7. Whelan B, Bennett K, O’Riordan D, et al. Serum sodium as a risk factor for in-hospital mortality in acute unselected general medical patients. QJM. 2009;102(3):175-182. doi: https://doi.org/10.1093/qjmed/hcn165
8. Clayton JA, Le Jeune IR, Hall IP. Severe hyponatraemia in medical in-patients: aetiology, assessment and outcome. QJM. 2006;99(8):505-511. doi: https://doi.org/10.1093/qjmed/hcl071
9. Vandergheynst F, Sakr Y, Felleiter P, et al. Incidence and prognosis of dysnatraemia in critically ill patients: analysis of a large prevalence study. Eur J Clin Invest. 2013;43(9):933-948. doi: https://doi.org/10.1111/eci.12123
10. Strushkevich N, Gilep AA, Shen L, et al. Structural insights into aldosterone synthase substrate specificity and targeted inhibition. Mol Endocrinol. 2013;27(2):315-324. doi: https://doi.org/10.1210/me.2012-1287
11. Викулова О.К., Зураева З.Т., Никанкина Л.В., Шестакова М.В. Роль ренин-ангиотензиновой системы и ангиотензинпревращающего фермента 2 типа в развитии и течении вирусной инфекции СОVID-19 у пациентов с сахарным диабетом // Сахарный диабет. — 2020. — Т. 23. — №3. — С. 242-249. doi: https://doi.org/10.14341/DM12501
12. Ларина А.А., Трошина Е.А. «Метаболический контроль у пациентов с сахарным диабетом 1 типа в дебюте хронической надпочечниковой недостаточности» // Ожирение и метаболизм. — 2013. — Т. 10. — №2. — С. 38-41. doi: https://doi.org/10.14341/2071-8713-4823
13. El Ghorayeb N, Bourdeau I, Lacroix A. Role of ACTH and Other Hormones in the Regulation of Aldosterone Production in Primary Aldosteronism. Front Endocrinol (Lausanne). 2016;7:72. doi: https://doi.org/10.3389/fendo.2016.00072
14. Gill G, Huda B, Boyd A, et al. Characteristics and mortality of severe hyponatraemia — A hospitalbased study. Clin Endocrinol (Oxf ). 2006;65(2):246-249. doi: https://doi.org/10.1111/j.1365-2265.2006.02583.x
15. Катамадзе Н.Н., Пигарова Е.А., Дзеранова Л.К., и др. Особенности водно-электролитного баланса у лиц старшей возрастной групп // Проблемы эндокринологии. — 2023. — Т. 69. — №6. — С. 28-36. doi: https://doi.org/10.14341/probl13214
16. Chelaghma N, Oyibo SO. Hyporeninemic hypoaldosteronism in a patient with diabetes mellitus: an unforgettable case report. Int Med Case Rep J. 2018;11:69-72. doi: https://doi.org/10.2147/IMCRJ.S158628
Об авторах
И. С. ХагабановаРоссия
Хагабанова Илона Сафраиловна, клинический ординатор
117036, г. Москва, ул. Дмитрия Ульянова, д. 11
О. К. Викулова
Россия
Викулова Ольга Константиновна, д.м.н., доцент
Scopus Author ID: 8697054500
Москва
М. Ш. Шамхалова
Россия
Шамхалова Минара Шамхаловна, д.м.н.
Москва
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н.
Москва
С. А. Мартынов
Россия
Мартынов Сергей Андреевич, к.м.н.
Москва
В. Ю. Калашников
Россия
Калашников Виктор Юрьевич, д.м.н., профессор, член-корреспондент РАН
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Динамика уровня натрия сыворотки. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(219KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Причины гипонатриемии. Адаптировано из [15]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(193KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Хагабанова И.С., Викулова О.К., Шамхалова М.Ш., Пигарова Е.А., Мартынов С.А., Калашников В.Ю. Гипонатриемия как проявление хронической надпочечниковой недостаточности у пациентки с сахарным диабетом 1 типа и трансплантацией почки вследствие терминальной хронической болезни почек. Сахарный диабет. 2024;27(3):295-301. https://doi.org/10.14341/DM13163
For citation:
Khagabanova I.S., Vikulova O.K., Shamkhalova M.S., Pigarova E.A., Martinov S.A., Kalashnikov V.Y. Hyponatremia as acute adrenal insufficiency in patients with type 1 diabetes mellitus and kidney transplantation cause end-stage chronic kidney disease. Diabetes mellitus. 2024;27(3):295-301. (In Russ.) https://doi.org/10.14341/DM13163

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































