Перейти к:
Влияние периферической нервной системы на пролиферацию и миграцию кератиноцитов в околораневой зоне
https://doi.org/10.14341/DM13123
Аннотация
ЦЕЛЬ. Оценить пролиферативную активность и способность к миграции кератиноцитов околораневой зоны на разных стадиях раневого процесса.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включено 25 пациентов с нейропатической формой синдрома диабетической стопы (СДС) и 5 пациентов без сахарного диабета (СД) с пролежнями. Пациентам основной группы проводилось лечение согласно стандартам: обработка раневых дефектов, наложение атравматических повязок, разгрузка пораженной конечности и антибактериальная терапия по необходимости. У всех пациентов проводилась оценка тяжести периферической нейропатии по шкале неврологических расстройств (NDS). В ходе обработки на 0-й, 10-й и 24-й день проводилась биопсия края раны размером до 1 см3 для последующих гистологического и иммуногистохимического исследований. Полученные фрагменты кожи фиксировали, дегидратировали и заливали парафином по стандартной методике. Срезы окрашивали гематоксилином и эозином, для иммуногистохимического окрашивания использовали маркеры Ki-67, α7nAChR.
РЕЗУЛЬТАТЫ. Все пациенты с нейропатической формой СДС имели тяжелую степень периферической нейропатии (NDSm>8). Средняя площадь раневого дефекта до и на 10-й день лечения составила 4 и 2,5 см2 соответственно (p<0,004). Гистологически край нейропатической раны был представлен гиперпролиферативным эпидермисом, митотически активные клетки располагались в дифференцированных супрабазальных слоях утолщенным роговым слоем. Ki-67 экспрессировали все слои эпидермиса, но большая плотность окрашивания определялась в базальном слое. Плотность a7nAChR-позитивных клеток увеличивалась от 0-го к 24-му дню (p=0,031).
ЗАКЛЮЧЕНИЕ. Полученные данные позволяют предположить, что повреждение периферической нервной системы является одним из возможных механизмов нарушения клеточного цикла кератиноцитов: пролиферативной активности и способности к миграции. Идентификация новых сигнальных путей, регулирующих физиологическую репарацию тканей и изучение их нарушений при СД, открывает перспективы разработки оптимальной терапевтической стратегии.
Ключевые слова
Для цитирования:
Артемова Е.В., Джемилова З.Н., Горбачева А.М., Галстян Г.Р., Токмакова А.Ю., Бердалин А.Б., Гаврилова С.А. Влияние периферической нервной системы на пролиферацию и миграцию кератиноцитов в околораневой зоне. Сахарный диабет. 2024;27(2):104-112. https://doi.org/10.14341/DM13123
For citation:
Artemova E.V., Dzhemilova Z.N., Gorbacheva A.M., Galstyan G.R., Tokmakova A.Yu., Berdalin A.B., Gavrilova S.A. Influence of peripheral nerve system on proliferation and migration of keratinocytes on site of the wound edges. Diabetes mellitus. 2024;27(2):104-112. (In Russ.) https://doi.org/10.14341/DM13123
ОБОСНОВАНИЕ
В настоящее время хронические раны являются актуальной проблемой для медицинского сообщества [1][2]. По данным анализа организации амбулаторной медицинской помощи в США, чаще диагностируются раневые дефекты подошвенной поверхностей пальцев, подошвенной поверхности в зоне проекции костей предплюсны и плюсны. Последние характеризуются наиболее тяжелым течением и худшим клиническим прогнозом [2]. Необходимо подчеркнуть, что деформации стоп и нейропатия являются наиболее значимыми факторами развития хронических раневых дефектов мягких тканей нижних конечностей. Кератиноциты являются основным клеточным компонентом эпидермиса, отвечающим за процесс эпителизации после повреждения целостности кожного покрова, успешность которого зависит от способности кератиноцитов менять архитектонику цитоскелета и приобретать способность к адгезии, миграции и пролиферации [3]. Морфологические исследования биоптатов нейропатических ран у пациентов с сахарным диабетом (СД) позволяют считать диабетические язвы стоп «замершими» на фазе пролиферации [1][4]. В настоящее время выяснены далеко не все механизмы нормальной регуляции клеточного цикла кератиноцитов и его нарушений при формировании нейропатических ран [5]. Доказано, что высокие внеклеточные концентрации глюкозы снижают миграционную активность клеток эпидермиса. Ряд исследований на клеточной культуре показали, что ацетилхолин (ACh) регулирует адгезию и миграционную способность клеток путем активации различных классов рецепторов на поверхности кератиноцитов [6]. В частности, активация рецепторов к медиатору парасимпатической нервной системы — ацетилхолину — α7nAChR имеет решающее значение для формирования молекул адгезии и регулирует прочность клеточных контактов. Пациенты с тяжелой нейропатией входят в группу высокого риска развития синдрома диабетической стопы, а раны, как правило, имеют высокий процент рецидива. Изучение нарушений клеточного цикла кератиноцитов в процессе репарации тканей у данной категории пациентов является определяющим в разработке терапевтической стратегии.
ЦЕЛЬ
Оценить пролиферативную активность и способность к миграции кератиноцитов околораневой зоны на разных стадиях раневого процесса.
МАТЕРИАЛЫ И МЕТОДЫ
Набор пациентов основной группы проводился в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России, г. Москва; набор пациентов контрольной группы проводился в клинических больницах г. Москвы и Московской области в период с сентября 2016-го по июль 2017-го гг.
Изучались две популяции пациентов с наличием нейропатических ран: основная группа — с СД (группа А), группа сравнения — без СД (группа Б).
Критерии включения в основную группу:
- подписанное информированное согласие, выполнение рекомендаций по лечению;
- возраст пациентов от 18 до 65 лет;
- СД 1 и 2 типа;
- хронический раневой дефект стопы II ст. по Wagner на фоне нейропатической формы синдрома диабетической стопы.
Критерии невключения:
- пациенты с ишемической и нейроишемической формой синдрома диабетической стопы;
- HbA1c>12%;
- наличие активной раневой инфекции и/или остеомиелита;
- предшествующая хирургическая обработка язвенного дефекта;
- разгрузка нижней конечности до включения в исследование.
Критерии исключения из исследования (для основной группы):
- пропуск запланированного визита;
- невыполнение рекомендаций по лечению раневого дефекта.
Критерии включения в группу сравнения:
- подписанное информированное согласие;
- возраст пациентов от 18 до 65 лет;
- пациенты без СД;
- наличие пролежней крестцовой области у пациентов с повреждением на уровне торако-люмбального отдела позвоночника, с синдромом передней части спинного мозга с полным двигательным параличом, потерей болевой и температурной чувствительности, с сохранением проприоцептивной и вибрационной чувствительности.
Способ формирования выборки из изучаемой популяции
Скрининг пациентов проводился сплошным способом с включением пациентов в основную и контрольные группы согласно критериям включения и невключения.
Дизайн исследования
Проведено многоцентровое обсервационное неослепленное динамическое (для основной группы) / поперечное (для группы сравнения) сравнительное сплошное нерандомизированное исследование. Период наблюдения пациентов основной группы составил 24 дня (осмотр и забор тканей проводился в первый день исследования, на 10-е, 24-е сутки). Дизайн исследования представлен на рис. 1.

Рисунок 1. Дизайн исследования.
Критерии соответствия
Критерии включения, невключения, исключения из исследования указаны выше.
Методы
Для формирования основной группы исследования на этапе скрининга проводился сбор жалоб и анамнеза пациента; забор венозной крови; осмотр нижних конечностей, включающий оценку тяжести полинейропатии, состояния периферического кровотока, оценку характеристик раневого дефекта. С пациентами обсуждался протокол исследования, подписывалось информированное согласие.
Этап скрининга включал:
I — сбор клинико-анамнестических данных, с учетом следующих параметров: возраст; длительность наличия раневого дефекта до этапа включения в исследование; для основной группы дополнительно — тип и длительность течения СД, предшествующая хирургическая обработка раневого дефекта; разгрузка пораженной нижней конечности до включения в исследование; ранее проводимые малые ампутации.
II — осмотр нижних конечностей:
- оценка состояния кожных покровов и ногтей; верификация отеков;
- размер раневого дефекта (0-й, 10-й, 24-й дни обследования) оценивался планиметрическим методом путем очерчивания контуров раны через прозрачную масштабную пленку (Opsite Flexgrid, Smith and Nephew, Великобритания) с дальнейшим подсчетом количества квадратных сантиметров внутри контура;
- локализация раневого дефекта (0-й день обследования);
- глубина поражения раневого дефекта (0-й, 10-й, 24-й дни обследования) оценивалась согласно классификации Wagner [7]. Для оценки поражения костной ткани проводилась ревизия раневого дефекта, при необходимости — рентгенография стопы;
- тяжесть диабетической нейропатии (0-й день обследования) по шкале NDS (Neuropathy Disability Score) с оценкой: тактильной чувствительности с использованием монофиламента массой 10 г (North Coast Medical Inc., США); вибрационной чувствительности при помощи градуированного камертона (128 Гц) (Kircher&Wilhelm, Германия); температурной чувствительности при помощи прибора «Тип-Терм» («Neue Medizintechnik Gmbh», Германия);
- фотографирование и архивирование изображений раны.
III — оценка состояния углеводного обмена — гликированный гемоглобин (методом высокоэффективной жидкостной хроматографии высокого давления на аппарате D-10 (BioRad Laboratories, США) по стандартной методике производителя).
Пациенты группы сравнения были обследованы однократно. Проводился сбор анамнеза, оценка характеристик и фотографирование раневого дефекта, биопсия ткани из зоны раневого дефекта для последующих морфологического, иммуногистохимического исследований.
На этапе включения пациентов в основную группу (0-й день), а также в контрольные периоды визитов (10-й, 24-й день) также проводилась биопсия ткани из зоны раневого дефекта. Для стандартизации забора гистологического материала разработан протокол с проведением маркировки края раны для последующей ориентации при проводке через парафин и приготовления срезов (край раны и околораневая зона с кожей, объемом 1 см³).
Полученный образец ткани продолговатой формы фиксировали 10-процентным нейтральным раствором формалина на фосфатно-солевом буфере в течение 12 часов и после промывки проточной водой подвергали обезвоживанию в нарастающих концентрациях спиртов (50%, 70%, 96%, 100%), затем заменяли спирт на неполярный растворитель (100%: хлороформ — 1:1 и затем хлороформ), а неполярный растворитель на парафин (хлороформ: парафин — 1:1 и затем парафин). После этого образцы заключали в парафин, при этом образцы ориентировали продольной осью к плоскости будущего среза. Образец нарезали на срезы толщиной 5 мкм на микротоме Microm HM 200 (Zeiss, Германия). Затем срезы высушивали, проводили и окрашивали гематоксилин-эозином по стандартной методике. Полученные препараты заключали в клей для срезов BioOptica под покровные стекла. Микроскопию проводили на микроскопе Zeiss Imager A1 Axio при помощи программы для захвата и анализа изображений AxioVision 3,5 (Zeiss, Германия).
Иммуногистохимическое окрашивание на Ki67, a7nAChR — холинорецепторы проводили при помощи кроличьих поликлональных антител фирмы Abcam. Демаскирование антигенов на срезах проводилось нагревом в цитратном буфере (pH 6.0) до 97 °С в течение 30 минут. Для блокировки фонового окрашивания использовалась сыворотка ProteinBlock (Abcam). Первичные антитела наносились на 2 часа при 37 ºС во влажной камере. После промывки в фосфатно-солевом буфере на 1 час наносились вторичные козлиные антитела, конъюгированные с пероксидазой (Abcam, ab191866). Затем наносили субстрат пероксидазы, диаминобензидин. Все фотографии препаратов получали с одинаковыми значениями настроек объектива камеры: яркостью, балансом белого и контрастностью, что обеспечивало унификацию процедуры обсчета. Интенсивность окрашивания оценивалась в программе Image-ProPlus с последующим подсчетом относительной площади окрашенных участков.
Всем обследованным, независимо от включения в исследование, проводилось лечение основного заболевания, его осложнений и сопутствующей патологии, раневого дефекта.
Также проводилось стандартное лечение, включающее хирургическую обработку раневого дефекта путем иссечения участков гиперкератоза; ежедневные перевязки с использованием атравматических повязок, разгрузка нижней конечности при помощи разгрузочного башмака или кресла каталки, или индивидуальной разгрузочной повязки Total Contact Cast.
Статистический анализ
Предварительный расчет размера выборки не проводился. Использовались методы непараметрической статистики. Для оценки динамики заживления ран у людей применяли попарные сравнения с помощью критерия Вилкоксона. Для сравнения плотностей экспрессии различных белков применяли многофакторный дисперсионный анализ, все результаты проверялись попарными сравнениями непараметрическими методами. Все результаты считались значимыми при p<0,05. Статистическую обработку данных проводили в пакете программ Statistica 13.0.
Этическая экспертиза
Локальный этический комитет ФГБУ «Эндокринологический научный центр» Минздрава России на заседании №16 от 12 октября 2016 г. рассмотрел протокол исследования «Нейрогуморальная регуляция репарации тканей при сахарном диабете» и постановил одобрить проведение этической экспертизы гранта РНФ №16-15-10365 «Нейрогуморальная регуляция репарации тканей при сахарном диабете».
РЕЗУЛЬТАТЫ
За время наблюдения нежелательных явлений отмечено не было.
Проведен скрининг 47 пациентов с нейропатическими ранами (табл. 1). Согласно критериям включения/невключения сформирована основная группа пациентов с СД — 25 человек.
Таблица 1. Клиническая характеристика пациентов
|
Параметр |
Группа СД, n=25 |
Группа сравнения, n=5 |
|
Возраст, лет |
39,9 [ 33; 59] |
41,3 [ 30; 62] |
|
Пол (м/ж) |
16/9 |
5/0 |
|
Тип СД 1/2 (%) |
12,5/87,5 |
- |
|
Длительность течения СД, лет |
17,4 [ 13; 20] |
- |
|
Гликированный гемоглобин, % |
9,4 [ 8,3; 10,8] |
|
|
Тяжесть ДПН (шкала NDS, баллы) |
>8 |
- |
|
Характеристика нейропатических раневых дефектов и анамнез малых ампутаций |
||
|
Длительность существования раневого дефекта до включения в исследование, мес. |
6 [ 3; 8] |
8 [ 6; 12] |
|
Локализация раневого дефекта, n |
Фаланги пальцев — 9 Головки плюсневых костей, опилы плюсневых костей при метатарзальной резекции — 13 Предплюсна (остеоартропатия Шарко) — 3 |
Пролежни крестцовой области |
|
Площадь раневого дефекта (0-й день), см² |
4 [ 1,75; 6,0] |
7,4 [ 3,4; 12,4] |
|
Малые ампутации на стопе в анамнезе, n, (%) |
6 (24) |
- |
Примечание: СД — сахарный диабет, ДПН — диабетическая полинейропатия,
шкала NDS — шкала неврологических расстройств.
В группу сравнения вошли пациенты без СД, с травматическим повреждением спинного мозга и наличием пролежней крестцовой области (n=5).
На фоне лечения отмечено уменьшение площади нейропатических раневых дефектов по сравнению со стартом терапии (0-й день — 4 [ 1,75; 6,0], 10-й день — 2,5 [ 1,25; 4,29], p<0,004).
На момент включения пациентов с СД нейропатические раны имели утолщенный роговой слой, митотически активные клетки локализовались во всех слоях эпидермиса, включая слои с дифференцированными клетками, зернистый слой практически отсутствовал, кератиноциты рогового слоя сохраняли ядра (паракератоз) (рис. 2) по сравнению с кожей больных с пролежнями, строение эпидермиса которых не отличалось от здоровой кожи (по литературным данным).
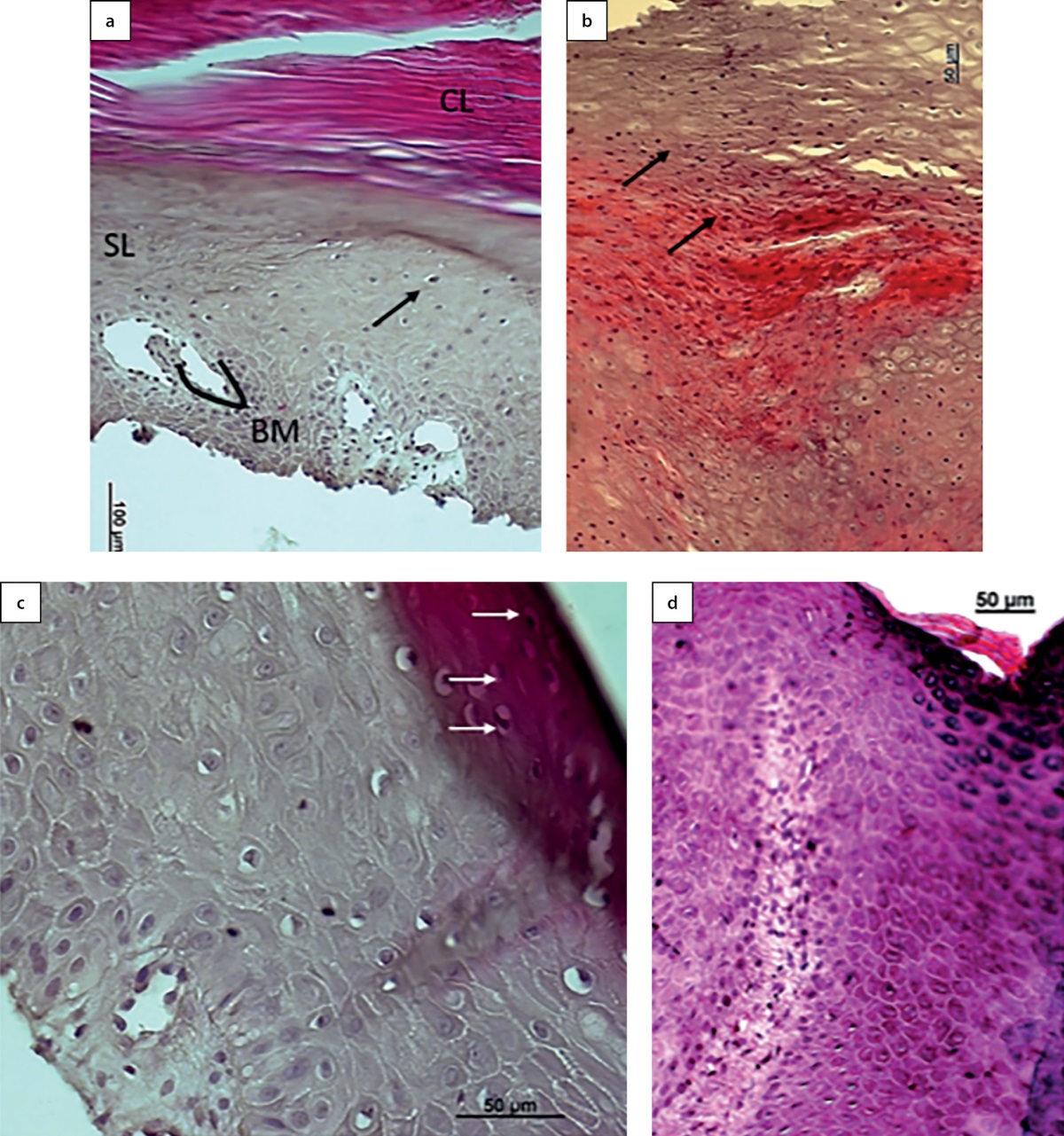
Рисунок 2. Гистологическая картина кожи пациента
с нейропатической раной стопы (а, b, c)
и участки пролежня пояснично-крестцового отдела (d).
Окраска. Стрелками указаны митотически активные клетки.
Все слои эпидермиса экспрессировали маркер пролиферативной активности Ki-67 (рис. 3), более интенсивное окрашивание отмечалось в базальном слое. Интенсивность пролиферации эпидермиса в течение периода наблюдения значимо не менялась (рис. 4, p=0,447 для фактора срока от начала терапии).
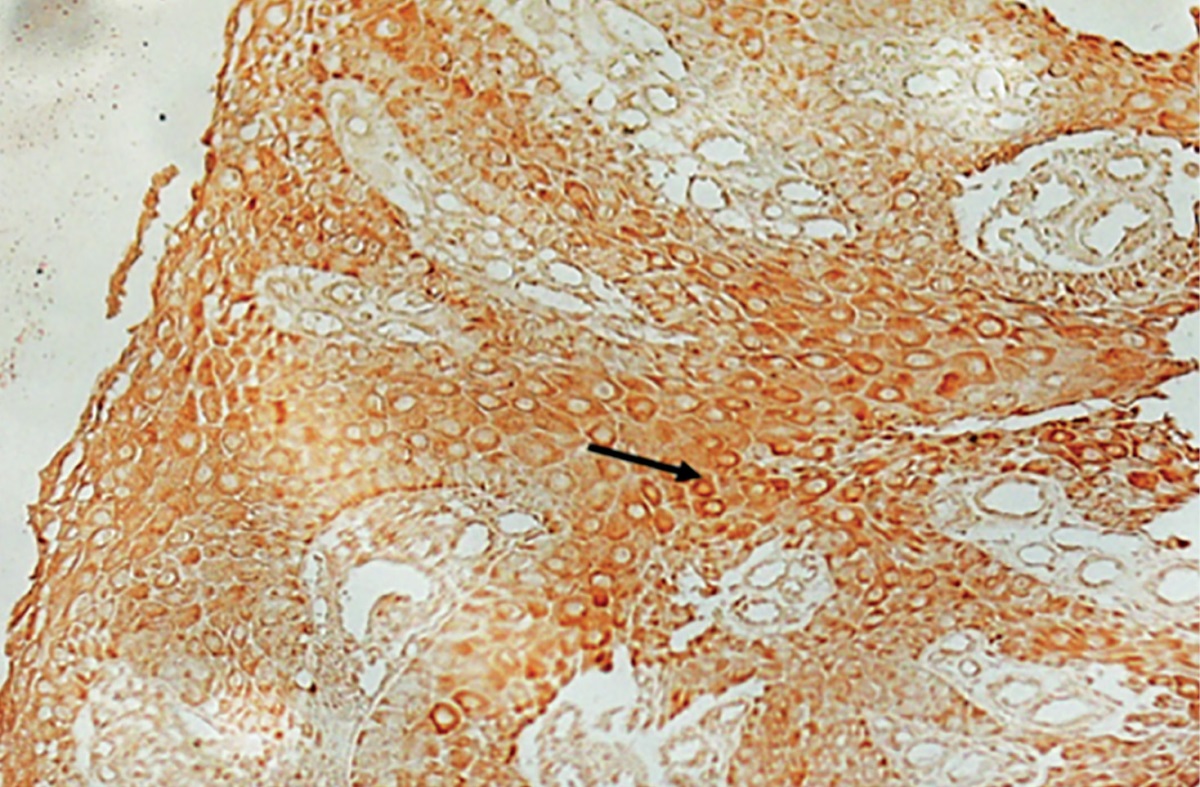
Рисунок 3. Иммуногистохимическое окрашивание на Ki-67 участка кожи,
обращенного в сторону края раны. 24-е сутки от начала терапии.
Коричневое окрашивание — наличие маркера (стрелка).
Базальный слой эпидермиса окрашен сильнее (стрелка). Х200.
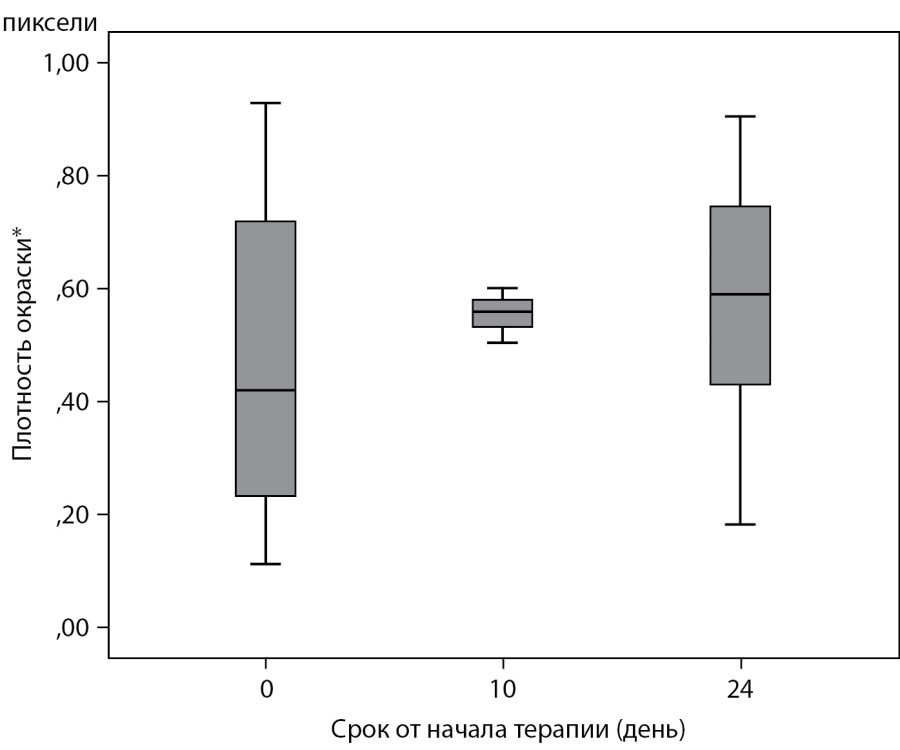
Рисунок 4. Плотность окрашивания образцов кожи на Ki-67, ANOVA, p=0,447.
Примечание. * Средняя доля окрашенных пикселей в пяти полях зрения
по отношению к отрицательному контролю.
Все слои эпидермиса экспрессировали рецепторы к медиатору парасимпатической нервной системы — ацетилхолину — α7nAChR (рис. 5а). По сравнению со стартом терапии к 10-му и 24-му дням отмечалось увеличение плотности экспрессии маркера. По результатам дисперсионного анализа, влияние фактора времени после начала терапии оказывается значимым (рис. 5б, p=0,031). По результатам апостериорных сравнений методом наименьшей значимой разницы, наблюдаемое влияние фактора времени связано с большей плотностью холинорецепторов в эпидермисе на 24-е сутки после начала терапии, относительно 0 точки (p=0,023). Точка 10 дней после начала терапии от остальных временных точек не имела значимых различий. В целом, количество рецепторов в течение наблюдения в коже увеличивалось к 24-му дню.
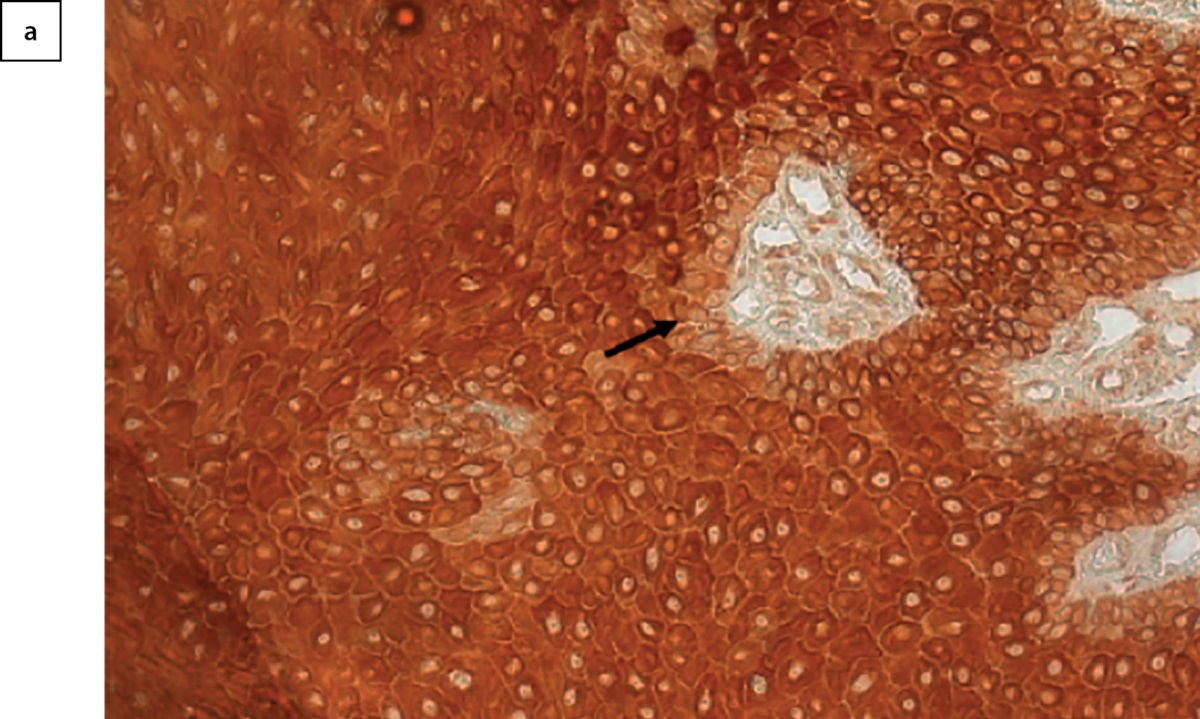
Рисунок 5а. Иммуногистохимическое окрашивание на α7nAChR участка кожи,
обращенного в сторону края раны. Коричневое окрашивание — наличие маркера.
В отличие от окрашивания на Ki-67, окрашивание базального слоя (стрелка) слабее,
чем у остального эпидермиса. Х200.
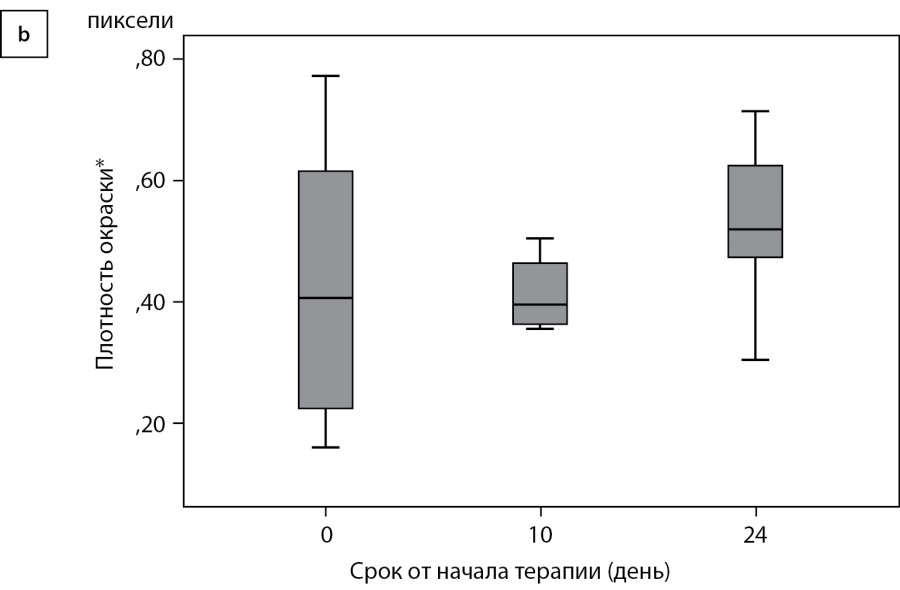
Рисунок 5б. Плотность окрашивания на α7nAChR, ANOVA, p=0,031.
Примечание. * Средняя доля окрашенных пикселей в пяти полях зрения
по отношению к отрицательному контролю.
ОБСУЖДЕНИЕ
По данным литературы, несмотря на соблюдение стандартов лечения, включающих разгрузку пораженной конечности, хирургическую обработку раневого дефекта, закрытие раны современными перевязочными средствами [1][7], нейропатические раны имеют низкие темпы заживления. Зачастую можно отметить замедление эпителизации наряду с избыточным ростом грануляционной ткани [3][4]. Отличительной особенностью нейропатических ран является гипер- и паракератоз, что, по-видимому, свидетельствует о нарушении нормального процесса ороговения и наличии патологических изменений клеточного цикла, что легло в основу выполненного исследования. Персистенция раневых дефектов в итоге приводит к углублению язвы, вовлечению в процесс повреждения костных структур и потере части стопы или ампутации конечности.
При развитии тяжелой нейропатии происходит повреждение периферических нервных окончаний, снижается плотность интраэпидермальных нервных волокон, формируется аксонопатия и демиелинизация крупных нервных стволов. Ранее было показано, что интраэпидермальные немиелинизированные С-волокна экспрессируют как mAChR, так и nAChR-рецепторы на аксональной мембране. Таким образом, в результате повреждения эфферентного звена периферической нервной системы при СД происходит ослабление нейрогуморального влияния на периферические ткани. По данным литературы [8], различные подтипы nAChR-рецепторов избирательно представлены в различных слоях эпидермиса. Клетки рогового слоя экспрессируют преимущественно a7nAChR, а кератиноциты базального слоя — a3b2 или nAChRa3b4nAChR. Все слои — a9nAChR. Активация каждого подтипа рецепторов nAChR, по всей видимости, связана с различными каскадами реакций, запускающих либо апоптоз, либо пролиферацию, миграцию и дифференцировку. Атипичная экспрессия специфических подтипов nAChR во всем эпидермисе коррелирует с наличием таких кожных заболеваний, как псориаз, атопический дерматит и т.д. Ряд исследований показывает, что активация α7nAchR на кератиноцитах приводит к синтезу внеклеточного матрикса эпидермиса и активирует транскрипцию многих генов, отвечающих за дифференцировку. По результатам проведенного иммуногистохимического анализа, кожа околораневой зоны в исследуемой группе экспрессировала a7nAChR во всех слоях. Стоит отметить более низкую интенсивность окрашивания клеток базального слоя, интенсивность окрашивания на данный маркер не менялась на фоне течения раневого процесса. Таким образом, все слои эпидермиса края раны активно пролиферировали на условно разделенных стадиях раневого процесса (0-е, 10-е, 24-е сутки), что приводило к патологическому утолщению эпидермиса, в то время как в ходе физиологической репарации клетки в супрабазальных слоях должны терять способность к митозу, активно дифференцироваться и подвергаться корнификации.
Клиническая значимость результатов
Полученные данные могут послужить основой для разработки местной терапии раневых дефектов, а именно локальной аппликации или введения агонистов рецепторов a7nAChR для усиления миграции кератиноцитов.
Ограничения исследования
Немногочисленная выборка пациентов группы сравнения, забор биопсийного материала которой проводился из ран иной локализации. Мощность выборки предварительно не оценивалась.
Направления дальнейших исследований
Продолжением исследования будет являться оценка прочности межклеточных контактов, концентрации нейромедиаторов в месте раневого дефекта, проведение доклинической части на лабораторных животных.
ЗАКЛЮЧЕНИЕ
Нарушение финального этапа заживления раны — эпителизации — является одной из причин хронического течения раневого процесса у пациентов с нейропатической формой синдрома диабетической стопы. Из-за потери кератиноцитами способности к миграции раны приобретают хронический характер с высоким процентом микробной колонизации, формируются бактериальные биопленки, нарушается кислотно-щелочная среда раны. В дополнение к ухудшению миграции кератиноциты не полностью дифференцируются, что выражается в присутствии ядер в роговом слое, то есть нарушается процесс корнификации, что обуславливает меньшую прочность кожи. Формирование полноценного рогового слоя является неотъемлемым механизмом для восстановления барьерной функции кожного покрова.
В настоящее время исследователи уделяют особое внимание нервным влияниям на различные механизмы ранозаживления: на пролиферацию и миграцию кератиноцитов, ангиогенез, формирование соединительнотканного рубца. Было обнаружено множество разнонаправленных эффектов от воздействия на различные подтипы адрено- и холинорецепторов, NMDA-рецепторов и др. [10]. Наряду с поиском патогенетических механизмов повреждения нервного волокна при СД и совершенствования методов инструментальной диагностики нейропатии на ранней стадии необходимо исследование патологических особенностей формирования нейропатических ран. Также представляется перспективным поиск сигнальных путей, блокирующих излишнюю пролиферацию клеток эпидермиса, что образует патологически утолщенный эпидермис с низкой миграционной способностью.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено за счет средств гранта РНФ №16-15-10365 «Нейрогуморальная регуляция репарации тканей при сахарном диабете».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Артемова Е.В. — разработка дизайна исследования; отбор пациентов, соответствующих критериям включения в основную и контрольную группы; проведение забора гистологического материала, обследование и лечение пациентов основной группы; поиск и анализ информации в международных базах данных, написание текста публикации. Джемилова З.Н. — разработка дизайна исследования; отбор пациентов, соответствующих критериям включения в основную и контрольную группы; проведение забора гистологического материала, обследование и лечение пациентов основной группы; поиск и анализ информации в международных базах данных, написание текста публикации. Горбачева А.М. — проведение гистологического исследования образцов тканей; статистическая обработка; написание текста публикации. Бердалин А.Б. — проведение гистологического и иммуногистохимического исследования образцов тканей; статистическая обработка и представление результатов исследования. Токмакова А.Ю. — разработка дизайна исследования; отбор пациентов, соответствующих критериям включения в основную и контрольную группы; редактирование рукописи. Галстян Г.Р. — написание статьи и внесение в рукопись существенной правки с целью повышения научной ценности статьи. Гаврилова С.А. — написание статьи и внесение в рукопись существенной правки с целью повышения научной ценности текста.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Токмакова А.Ю., Страхова Г.Ю., Арбузова М.И. Особенности хронических ран у больных сахарным диабетом и пути их коррекции // Эндокринная хирургия. — 2007. — №1. — C. 38-42. doi: https://doi.org/10.14341/2306-3513-2007-1-38-42
2. Boulton AJ, Vileikyte L, Ragnarson-Tennvall G, Apelqvist J. The global burden of diabetic foot disease. Lancet. 2005;366(9498):1719-1724. doi: https://doi.org/10.1016/S0140-6736(05)67698-2
3. Артемова Е.В., и др. Механизмы нейрогуморальной регуляции клеточного цикла кератиноцитов при сахарном диабете // Сахарный диабет. — 2016. — Т. 19. — №5. — C. 366-374. doi: https://doi.org/10.14341/DM8131
4. Beer HD, Gassmann MG, Munz B, et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. J Investig Dermatology Symp Proc. 2000;5(1):34-39. doi: https://doi.org/10.1046/j.1087-0024.2000.00009
5. Demidova-Rice TN, Hamblin MR, Herman IM. Acute and impaired wound healing: Pathophysiology and current methods for drug delivery, part 1: Normal and chronic wounds: Biology, causes, and approaches to care. Adv Ski Wound Care. 2012;25(7):304-314. doi: https://doi.org/10.1097/01.ASW.0000416006.55218.d0
6. Grando SA, Kist DA, Qi M, Dahl M V. Human Keratinocytes Synthesize, Secrete, and Degrade Acetylcholine. J Invest Dermatol. 1993;101(1):32-36. doi: https://doi.org/10.1111/1523-1747.ep12358588
7. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. — 11-й вып. — М.: 2023. doi: https://doi.org/10.14341/DM13042
8. Kindt F, Wiegand S, Niemeier V, et al. Reduced expression of nicotinic α subunits 3, 7, 9 and 10 in lesional and nonlesional atopic dermatitis skin but enhanced expression of α subunits 3 and 5 in mast cells. Br J Dermatol. 2008;159(4):847-857. doi: https://doi.org/10.1111/j.1365-2133.2008.08774.x
9. Sivamani RK, Lam ST, Isseroff RR. Beta Adrenergic Receptors in Keratinocytes. Dermatol Clin. 2007;25(4):643-653. doi: https://doi.org/10.1016/j.det.2007.06.012
10. Ramaekers J, Lamers C, Verhey F, et al. A comparative study of the effects of carbamazepine and the NMDA receptor antagonist remacemide on road tracking and car-following performance in actual traffic. Psychopharmacology (Berl). 2002;159(2):203-210. doi: https://doi.org/10.1007/s002130100898
Об авторах
Е. В. АртемоваРоссия
Артемова Екатерина Викторовна.
117292, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
З. Н. Джемилова
Россия
Джемилова Зера Нусредовна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. М. Горбачева
Россия
Горбачева Анна Максимовна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Г. Р. Галстян
Россия
Галстян Гагик Радикович - д.м.н., профессор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Ю. Токмакова
Россия
Токмакова Алла Юрьевна - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Б. Бердалин
Россия
Бердалин Александр Берикович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. А. Гаврилова
Россия
Гаврилова Светлана Анатольевна - к.б.н., доцент.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Figure 1. Study design. | |
| Тема | ||
| Тип | Прочее | |
Посмотреть
(492KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Гистологическая картина кожи пациента с нейропатической раной стопы (а, b, c) и участки пролежня пояснично-крестцового отдела (d). Окраска. Стрелками указаны митотически активные клетки. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(827KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Иммуногистохимическое окрашивание на Ki-67 участка кожи, обращенного в сторону края раны. 24-е сутки от начала терапии. Коричневое окрашивание — наличие маркера (стрелка). Базальный слой эпидермиса окрашен сильнее (стрелка). Х200. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(435KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Плотность окрашивания образцов кожи на Ki-67, ANOVA, p=0,447. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(95KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5а. Иммуногистохимическое окрашивание на α7nAChR участка кожи, обращенного в сторону края раны. Коричневое окрашивание — наличие маркера. В отличие от окрашивания на Ki-67, окрашивание базального слоя (стрелка) слабее, чем у остального эпидермиса. Х200. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(347KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 5б. Плотность окрашивания на α7nAChR, ANOVA, p=0,031. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(89KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Артемова Е.В., Джемилова З.Н., Горбачева А.М., Галстян Г.Р., Токмакова А.Ю., Бердалин А.Б., Гаврилова С.А. Влияние периферической нервной системы на пролиферацию и миграцию кератиноцитов в околораневой зоне. Сахарный диабет. 2024;27(2):104-112. https://doi.org/10.14341/DM13123
For citation:
Artemova E.V., Dzhemilova Z.N., Gorbacheva A.M., Galstyan G.R., Tokmakova A.Yu., Berdalin A.B., Gavrilova S.A. Influence of peripheral nerve system on proliferation and migration of keratinocytes on site of the wound edges. Diabetes mellitus. 2024;27(2):104-112. (In Russ.) https://doi.org/10.14341/DM13123

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































