Перейти к:
Клиническая характеристика пациенток с различными подтипами гестационного сахарного диабета: результаты исследований
https://doi.org/10.14341/DM13105
Аннотация
АКТУАЛЬНОСТЬ. Гестационный сахарный диабет (ГСД) — одно из наиболее часто встречающихся заболеваний во время беременности, распространенность которого будет увеличиваться. На сегодняшний день имеются данные, показывающие, что не все беременные с ГСД имеют одинаковые риски развития акушерских и перинатальных осложнений. Выделение пациенток с повышенным риском развития осложнений может оказаться необходимым с учетом увеличения распространенности ГСД. Потребность в более детальном изучении подтипов ГСД, разработки методов диагностики подтипов для определения пациенток с высоким риском осложнений легла в основу исследования.
ЦЕЛЬ ИССЛЕДОВАНИЯ. Определение анамнестических, фенотипических и биохимических характеристик подтипов ГСД для дальнейшей разработки методов диагностики и лечения.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое наблюдательное проспективное исследование выполнено на базе кафедры внутренних болезней №3 ФГБОУ ВО Ростовского государственного медицинского университета Минздрава Российской Федерации в период с апреля 2021-го по август 2022 гг. В исследование включены 130 беременных женщин. Участницам проводился пероральный глюкозотолерантный тест с 75 г глюкозы с оценкой уровня глюкозы венозной плазмы и инсулина натощак, через 60 и 120 минут проводился забор крови натощак для определения уровней общего холестерина, триглицеридов, липопротеинов высокой плотности, липопротеинов низкой плотности, аполипопротеина А, аполипопротеина В, адипонектина, лептина и оментина, гликированного гемоглобина, С-реактивного белка. Все участницы исследования прошли сбор анамнеза и физикальный осмотр с оценкой индекса массы тела (ИМТ), артериального давления, признаков acanthosis nigricans, анкетирование. При обнаружении ГСД проводились расчеты индекса Matsuda: при получении значения >50-го процентиля в сравнении со значениями беременных без нарушений углеводного обмена мы классифицировали пациентку как имеющую ГСД с преобладающей дисфункцией β-клеток. Если значение индекса составляло <50-го процентиля, мы относили пациентку в группу ГСД с преобладающей инсулинорезистентностью.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. Беременные с выраженной инсулинорезистентностью были старше, имели выше ИМТ до наступления беременности, большую прибавку веса с момента зачатия и до конца второго триместра, чаще имели признаки acanthosis nigricans в сравнении с пациентками с ГСД и дисфункцией β-клеток. Также при сравнении пациенток с различными подтипами ГСД были выявлены многочисленные биохимические различия (по уровням триглицеридов, аполипоротеинов А и В, С-реактивного белка, гликированного гемоглобина и адипонектина). Помимо этого, выявлены особенности питания и физической активности.
ЗАКЛЮЧЕНИЕ. Мы продемонстрировали выраженные анамнестическую, фенотипическую и биохимическую неоднородность у пациенток с различными подтипами ГСД, что может стать основной для дальнейшей разработки способа верификации подтипов ГСД.
Ключевые слова
Для цитирования:
Волкова Н.И., Давиденко И.Ю., Дегтярева Ю.С., Сорокина Ю.А., Авруцкая В.В. Клиническая характеристика пациенток с различными подтипами гестационного сахарного диабета: результаты исследований. Сахарный диабет. 2024;27(4):336-346. https://doi.org/10.14341/DM13105
For citation:
Volkova N.I., Davidenko I.Y., Degtiareva Y.S., Sorokina Y.A., Avrutskaya V.V. Clinical characteristics of patients with different subtypes of gestational diabetes mellitus: research results. Diabetes mellitus. 2024;27(4):336-346. (In Russ.) https://doi.org/10.14341/DM13105
Обоснование
Гестационный сахарный диабет (ГСД) — одно из наиболее часто встречающихся осложнений, возникающих во время беременности. В 2021 г. примерно каждые 6-е роды происходили у женщины на фоне гипергликемии, в подавляющем большинстве — вследствие ГСД. Согласно прогнозам, число таких пациенток будет драматически увеличиваться во всем мире, как и число больных другими типами сахарного диабета (СД) [1].
Поскольку ГСД протекает преимущественно бессимптомно и связан с риском множества неблагоприятных акушерских и перинатальных исходов [2][3], у всех беременных проводится скрининг на ГСД, который заключается в определении глюкозы венозной плазмы натощак (ГПН) при первом визите к врачу и, в случае значения менее 5,1 ммоль/л, проведении перорального глюкозотолерантного теста (ПГТТ) с 75 г глюкозы и определением ГПН на 60-й и 120-й минутах теста [4].
На сегодняшний день хорошо известны осложнения неконтролируемой гипергликемии во время беременности, среди которых — преэклампсия, преждевременные роды, ускоренный рост плода и макросомия, кесарево сечение, родовые травмы, дистоция плечиков плода, неонатальная гипогликемия, гипербилирубинемия, респираторный дистресс-синдром новорожденных и необходимость в госпитализации в отделение интенсивной терапии новорожденных [2][3]. Помимо краткосрочных исходов, известно об отдаленных рисках. Так, женщины, перенесшие ГСД, имеют повышенные риски развития сахарного диабета 2 типа (СД2) в будущем. Дети, подвергшиеся гипергликемии внутриутробно, склонны к избыточной массе тела, ожирению и развитию нарушений углеводного обмена [3].
Гипергликемия, развивающаяся во время беременности и проходящая после родов, известна уже более 50 лет, но до сих пор факторы риска ГСД и патогенез остаются активно изучаемыми вопросами ввиду своего многообразия [5][6].
Согласно имеющимся данным, не все беременные с ГСД имеют одинаковые риски развития краткосрочных осложнений [7]. Первые упоминания о гетерогенности ГСД появились примерно 30 лет назад, когда были выделены две группы пациенток на основании их веса. Cheney C. et al. продемонстрировали, что женщины с ИМТ >27 кг/м2 рожали более крупных детей, у которых чаще развивалась гипогликемия в сравнении с женщинами с более низким ИМТ [8]. За последние несколько лет появились исследования, более подробно изучающие неоднородность таких пациенток на основании патогенетических звеньев, лежащих в основе развития гипергликемии [9], которая определялась с применением расчетных индексов [12]. Благодаря уже проведенным ранее исследованиям удалось продемонстрировать, что существует несколько подтипов ГСД: подтип с выраженной инсулинорезистентностью (ИР), подтип с дисфункцией β-клеток поджелудочной железы и, по данным некоторых авторов, смешанный подтип, при котором выражены оба патогенетических механизма [10][11][13–15]. Согласно данным, патогенетическая неоднородность сопровождается фенотипическими, биохимическими различиями, а также влияет на риски краткосрочных осложнений [9]. Так, по результатам исследования, проведенного в 2019 г., беременные с ГСД и выраженной ИР имели больший риск развития неблагоприятных исходов беременности. Относительно долгосрочных осложнений, а именно развития СД2 в ближайшем будущем, риски у пациенток с различными подтипами схожие [16].
Предотвращение быстрых темпов роста плода и развития других осложнений беременности является основной терапевтической целью при лечении гипергликемии во время беременности. На сегодняшний день терапевтический подход к пациенткам с ГСД универсален и осуществляется методом подбора терапии: диетотерапия, увеличение физической активности и самоконтроль глюкозы (не менее четырех измерений в сутки), которые в большинстве случаев достаточны для достижения и поддержания уровня глюкозы в целевом диапазоне. У 30% пациенток с ГСД есть потребность в дополнительном медикаментозном лечении [17]. Однако, учитывая данные, указывающие на наличие явной неоднородности пациенток с ГСД, вероятно, есть возможность для оказания персонализированной медицинской помощи на основании подтипа ГСД, а не только методом подбора. Кроме того, выделение пациенток с ГСД и повышенным риском развития осложнений может оказаться необходимым с учетом неуклонного роста количества таких пациенток во всем мире. Потребность в более детальном изучении подтипов ГСД, определении методов диагностики пациенток с высоким риском осложнений легла в основу текущего исследования.
Цель
Целью нашего исследования было определение анамнестических, фенотипических и биохимических характеристик различных подтипов ГСД с возможностью дальнейшей разработки методов их диагностики и своевременного лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн, место и время проведения исследования
Описанное одноцентровое наблюдательное проспективное исследование было выполнено на базе кафедры внутренних болезней №3 ФГБОУ ВО Ростовского государственного медицинского университета Минздрава Российской Федерации в период с апреля 2021-го по август 2022 гг.
В исследование были включены 130 беременных женщин, прошедших обследование на ГСД (ГПН или ПГТТ с 75 г глюкозы при ГПН менее 5,1 ммоль/л ранее), давших согласие на участие в исследовании и заполнивших анкеты.
Критерии соответствия
Критерии включения: беременные совершеннолетние женщины, давшие добровольное письменное согласие на участие в данном исследовании.
Критерии исключения: наличие прегестационного СД и манифестного СД, наличие других хронических некомпенсированных заболеваний, прием глюкокортикоидов. Участие в проспективном исследовании прекращалось по желанию пациентки, при невозможности очного наблюдения (в случае смены места жительства), прерывании беременности.
Описание медицинского вмешательства
Беременным женщинам, давшим согласие на участие в данном исследовании, на сроке 24–28 недель проводился ПГТТ с 75 г глюкозы по стандартной методике, описанной в «Алгоритмах специализированной медицинской помощи больным сахарным диабетом» [4].
Помимо уровня глюкозы, в рамках теста оценивались уровни инсулина (натощак, через 60 минут и 120 минут после выпитого раствора глюкозы), а также проводился забор крови натощак для определения уровней общего холестерина (ОХС), триглицеридов (ТГ), липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП), аполипопротеина А, аполипопротеина В, адипонектина, лептина и оментина, гликированного гемоглобина (HbA1c), С-реактивного белка (СРБ).
Определение всех изучаемых лабораторных показателей проводилось в Центральной научно-исследовательской лаборатории Ростовского государственного медицинского университета с помощью Wallac 1420 Multilaber Counter (Victor 2) — ИФА-анализатора. Определение глюкозы, общего холестерина, ТГ, ЛПНП, ЛПВП проводилось с использованием реагентов «Ольвекс Диагностикум», Россия. Для исследования аполипротеинов-А, B использовались реагенты фирмы «HUMAN», Германия. Определение оментина — с использованием реагентов «RayBiotech», США, лептина — «Оргентек Диагностика ГмбХ», Германия. Для исследования СРБ, инсулина и HbA1c были использованы реагенты отечественного производства фирмы «Вектор-Бест».
Все участницы исследования были осмотрены эндокринологом, прошли сбор анамнеза и физикальный осмотр с оценкой ИМТ, артериального давления (АД), признаков acanthosis nigricans, а также анкетирование. Специально разработанная для исследования анкета включала вопросы по репродуктивному анамнезу, наследственности, особенностям настоящей беременности (оценивались прегравидарная подготовка, факт и длительность приема лекарственных препаратов и биологически активных добавок). Особое внимание в рамках анкетирования уделялось характеристикам образа жизни: уровню физической активности до и после наступления беременности (с помощью вопросов, адаптированных из International Physical Activity Questionnaire), а также питанию (оценивались частота и количество употребления овощей, фруктов, молочных продуктов, мяса, продуктов из переработанного мяса, рыбы и морепродуктов, кондитерских изделий, цельнозерновых продуктов).
Методы
На основании результатов ПГТТ были выделены 2 основные группы наблюдения: пациентки с ГСД и участницы без выявленных нарушений углеводного обмена. Диагноз «ГСД» устанавливался по критериям [4]. При обнаружении уровней глюкозы, соответствующих манифестному диабету (глюкоза венозной плазмы натощак 7,0 ммоль/л и выше или через 2 часа после выпитого раствора глюкозы 11,1 ммоль/л и более), беременные направлялись на повторное определение глюкозы крови натощак и уровня HbA1c с целью исключения явного СД.
Пациентки с ГСД были классифицированы на две разные группы с помощью индекса Matsuda. Индекс Matsuda был выбран благодаря тому, что результаты соответствуют гиперинсулинемическому эугликемическиму клэмпу, который является наиболее точным методом определения ИР, но его применение в клинической практике невозможно по ряду причин [12].
Расчет индекса Matsuda проводился на основании ГПН, уровня инсулина натощак, а также средних значений уровня глюкозы и инсулина в ходе ПГТТ. При получении значения индекса Matsuda >50-го процентиля в сравнении с значениями беременных без нарушений углеводного обмена мы классифицировали пациентку как имеющую ГСД с преобладающей дисфункцией β-клеток. Если значение индекса Matsuda составляло <50-го процентиля, мы относили пациентку в группу ГСД с преобладающей ИР. Решение принять за точку отсечения 50-й процентиль было принято, поскольку он позволяет выделить два подтипа, исключая смешанные варианты и «серые зоны», которые были описаны в других исследованиях, где использовался 25-й процентиль.
Все пациентки с выявленным ГСД проходили дальнейшее лечение и наблюдение у эндокринологов и акушеров-гинекологов клиники ФГБОУ ВО РостГМУ.
Макросомия определялась как рождение ребенка весом более 4000 г при доношенной беременности или более 90-го процентиля по таблицам роста плода для гестационного срока (в соответствии с клиническими рекомендациями «Гестационный сахарный диабет», проект 2020 г.).
Статистический анализ
Проверка количественных данных на подчиненность нормальному закону распределения проверялась с помощью теста Шапиро-Уилка, описательные статистики представлены в виде медианы (интерквартильного размаха). Сравнение количественных показателей в группах проведены при помощи теста Краскела-Уоллиса (попарные апостериорные сравнения — с помощью метода Неменьи), частот — с помощью точного теста Фишера с поправкой на множественные сравнения по Холму. Расчеты выполнены с помощью языка программирования R для статистического анализа данных (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria).
Этическая экспертиза
Исследование одобрено локальным независимым этическим комитетом ФГБОУ ВО РостГМУ Минздрава России (Протокол №5/21 от 11 марта 2021 г.).
Результаты
Объекты (участники) исследования
В исследование было включено 130 пациенток. Медиана возраста включенных в исследование женщин составила 30,2 года (27; 33), у 88 пациенток был выявлен ГСД. Все пациентки с ГСД были распределены в группы в зависимости от преобладающего патогенетического фактора на основании индекса Matsuda: в группу I (ГСД и нарушение функции β-клеток поджелудочной железы) вошли 43 пациентки, в группу II (ГСД и выраженная ИР) вошли 45 пациенток. У 42 пациенток, по результатам ПГТТ с 75 г глюкозы, не было выявлено нарушений углеводного обмена на момент обследования, следовательно, они составили группу контроля (группа III).
Объективные данные, анамнез
Беременные из группы I были значимо моложе пациенток из группы II и практически не отличались по возрасту от участниц из группы контроля (группа III). Выявлены и другие интересные особенности, подробнее в табл. 1.
Не было выявлено различий по уровням АД, наследственности по СД. При анализе репродуктивного анамнеза различия обнаружены по признаку регулярности менструального цикла (пациентки из группы контроля с нормальной толерантностью к глюкозе реже имели регулярный менструальный цикл, чем беременные с ГСД из I и II групп наблюдения [ 71% против 96%, p=0,009 и 71% против 93%, p=0,02 соответственно). Полученные данные следует интерпретировать с осторожностью, поскольку они собраны путем анкетирования, в ходе которого пациентки также сообщали о наличии у них хронических заболеваний: все пациентки до наступления беременности не имели хронических заболеваний, в том числе гинекологических. При этом частота нарушений менструального цикла не отличалась при сравнении беременных с разными подтипами ГСД. По остальным признакам (возраст наступления менархе, длительность менструального цикла, количество беременностей и родов в анамнезе, вес предыдущих детей при рождении) различий выявлено не было. При анализе предыдущих родов было выявлено, что у беременных с ГСД и ИР (II группа) были более крупные дети при первых родах на сроке 39–40 недель, чем у женщин с нормальной толерантностью к глюкозе (3500 г против 3100 г, p=0,05). Различий с группой I по этому признаку выявлено не было. При этом частота ГСД в анамнезе у пациенток из разных групп не различалась.
Подробная характеристика пациенток из разных групп наблюдения представлена в табл. 1.
Медикаментозная терапия
При оценке особенностей текущей беременности было выявлено, что пациентки, у которых в последующем были выявлены нарушения углеводного обмена, чаще проводили прегравидарную подготовку (консультация акушера-гинеколога, прием фолиевой кислоты, калия йодида и др). Достоверно чаще беременные из группы I в сравнении с группой II получали фолиевую кислоту, разница по этому признаку выявлена и при сравнении с группой контроля, однако она не оказалась достаточно выраженной. При анализе частоты приема других лекарственных препаратов на этапе планирования и во время беременности различий выявлено не было (табл. 2).
Особенности течения I триместра беременности
При оценке выраженности тошноты, слабости и утомляемости, изменения пищевых предпочтений, а также анемии в первом триместре беременности различий между подтипами ГСД выявлено не было (табл. 3). Пациентки с ГСД и ИР (II группа) реже, чем беременные из других групп наблюдения, отмечали изменение пищевых привычек в начале беременности. Подробнее особенности питания обсуждаются в разделе «Образ жизни: питание».
Образ жизни: физическая активность
По данным проведенного анкетирования, пациентки из группы II (с преобладающей ИР) чаще характеризовали свой уровень физической активности до наступления беременности как низкий (преимущественно сидячий образ жизни) в сравнении с пациентками из группы ГСД I (p<0,001). В то же время у пациенток из группы ГСД I был более высокий уровень физической активности до наступления беременности по сравнению с контрольной группой (p=0,02). Уровень физической активности расценивался как достаточный при регулярных нагрузках средней интенсивности не менее 150 минут в неделю, высокой интенсивности — не менее 75 минут в неделю) (табл. 4).
Образ жизни: питание
Особое значение в рамках исследования было уделено питанию пациенток из групп наблюдения. Анкетирование проводилось до верификации диагноза ГСД и консультирования по питанию.
Согласно полученным результатам, было установлено, что беременные из группы ГСД II значительно больше употребляли фруктов и ягод в сравнении с группой контроля (p=0,03). При этом разницы между беременными с разными подтипами выявлено не было.
При оценке потребления овощей обнаружено, что беременные с ГСД, независимо от подтипа, характеризовались более частым потреблением при сравнении с группой контроля (p=0,02). Выявлены и другие значимые различия (рис. 1) в особенностях питания у пациенток из разных подгрупп. Подробнее — в табл. 5.
Биохимические различия
При исследовании биохимических показателей был выявлен ряд различий между подгруппами наблюдения (табл. 6). У пациенток с ГСД и ИР (группа II) были значительно более высокие уровни ТГ в сравнении с беременными из группы I и пациентками без выявленных нарушений углеводного обмена (3,2 ммоль/л против 2,55 ммоль/л (p=0,01) и против 2,15 ммоль/л (р<0,001) соответственно). Аполипопротеин-А был значительно выше у пациенток с ГСД при сравнении с группой контроля (в обоих случаях р<0,001), но не различался среди подгрупп с ГСД. Аполипопротеин-B был наивысшим у пациенток с ГСД и ИР при сравнении с группой ГСД и дисфункцией β-клеток и группой контроля. Уровни общего холестерина, ЛПНП и ЛПВП статистически значимо не различались.
СРБ был значимо выше у беременных с ГСД и ИР (группа II) в сравнении с остальными группами наблюдения и не отличался у беременных с ГСД из группы I и группы контроля на момент включения в исследование. Уровни HbA1c были значительно выше у пациенток с ГСД по сравнению с беременными из группы контроля, но не различались среди подгрупп ГСД.
Среди всех исследуемых гормонов значимые различия получены при оценке уровней адипонектина, который был наивысшим у пациенток с нормальной толерантностью к углеводам (группа контроля), а самые низкие значения были выявлены у пациенток с ГСД и ИР. При этом различий между группами ГСД I и контроля обнаружено не было (рис. 2).
Таблица 1. Объективные данные и исследуемые данные репродуктивного и семейного анамнеза пациенток с различными подтипами гестационного сахарного диабета и группой контроля
Показатель | Беременные | Р | ||||
Группа I (n=45) | Группа II (n=43) | Группа III (n=42) | рI–II | рI–III | рII–III | |
Объективные данные | ||||||
Возраст, лет | 29 | 32 | 29,5 | 0,02 | 0,96 | 0,009 |
Вес пациенток при рождении, г | 3300 | 3200 | 3125 | 0,34 | 0,02 | 0,39 |
Вес до беременности, кг | 57 | 80 | 60 | <0,001 | 0,68 | <0,001 |
Рост, см | 1,64 | 1,67 | 1,66 | 0,01 | 0,15 | 0,59 |
ИМТ до беременности, кг/м2 | 21,1 | 28,3 | 21 | <0,001 | 0,95 | <0,001 |
Вес текущий, кг | 59,8 | 84 | 62 | <0,001 | 0,49 | <0,001 |
Систолическое АД, мм рт.ст. | 110 | 110 | 110 | 0,91 | 0,61 | 0,85 |
Диастолическое АД, мм рт.ст. | 70 | 70 | 70 | 0,19 | 0,83 | 0,06 |
Признаки acanthosis nigricans, n (%) | 0 (0) | 6 (14) | 1 (2) | 0,03 | 0,48 | 0,22 |
Репродуктивный анамнез | ||||||
Возраст наступления менархе, лет | 13 | 13 | 13 | 0,97 | 0,81 | 0,67 |
Регулярный МЦ, n (%) | 43 (96) | 40 (93) | 30 (71) | 0,67 | 0,009 | 0,02 |
Длительность МЦ (дни) | 28 | 28 | 28 | 0,99 | 0,92 | 0,95 |
ГСД в анамнезе, n (%) | 32 (71) | 32 (74) | 22 (52) | 1,00 | 1,00 | 1,00 |
Кол-во беременностей до текущей, n | 1 | 2 | 1 | 0,67 | 0,98 | 0,55 |
Вес при рождении 1-го ребенка, г | 3300 | 3500 | 3100 | 0,36 | 0,47 | 0,047 |
Вес при рождении 2-го ребенка, г | 3300 | 3600 | 3525 | 0,14 | 0,14 | 1,00 |
Общий набор веса в предыдущую беременность, кг | 14 | 15 | 12,5 | 0,93 | 0,32 | 0,17 |
Семейный анамнез | ||||||
Отягощенный наследственный анамнез по СД, n (%) | 35 (78) | 25 (58) | 26 (62) | 0,22 | 0,28 | 0,12 |
Примечание. рI–II — уровень значимости при сравнении показателей групп I и II; рI–III — уровень значимости при сравнении показателей групп I и III; рII–III — уровень значимости при сравнении показателей групп II и III.
МЦ — менструальный цикл; ИМТ — индекс массы тела; ГСД — гестационный сахарный диабет; АД — артериальное давление; СД — сахарный диабет.
Таблица 2. Фармакологический анамнез пациенток с различными подтипами гестационного сахарного диабета и группой контроля
Показатель | Беременные | Р | ||||
Группа I (n=45) | Группа II (n=43) | Группа III (n=42) | рI–II | рI–III | рII–III | |
Характеристика текущей беременности | ||||||
Проведение прегравидарной подготовки, n (%) | 21 (47) | 14 (33) | 8 (9) | 0,22 | 0,03 | 0,03 |
Прием в настоящее время (или ранее во время текущей беременности) витаминов, БАДов, лекарственных препаратов, n (%) | 44 (98) | 41 (95) | 38 (90) | 0,87 | 0,58 | 0,87 |
Поливитамины, n (%) | 32 (71) | 34 (79) | 32 (76) | 1,00 | 1,00 | 1,00 |
Фолиевая кислота, n (%) | 25 (56) | 7 (16) | 13 (31) | <0,001 | 0,048 | 0,13 |
Прогестерон, n (%) | 13 (29) | 14 (33) | 9 (21) | 0,99 | 0,99 | 0,99 |
Препараты железа, n (%) | 4 (9) | 0 | 0 | 0,23 | 0,23 | |
Колекальциферол, n (%) | 11 (24) | 7 (16) | 6 (14) | 0,86 | 0,86 | 1,00 |
Калия йодид, n (%) | 8 (18) | 6 (14) | 2 (5) | 0,77 | 0,27 | 0,53 |
Ацетилсалициловая кислота, n (%) | 3 (7) | 4 (9) | 9 (21) | 0,71 | 0,19 | 0,28 |
Примечание. рI–II — уровень значимости при сравнении показателей групп I и II; рI–III — уровень значимости при сравнении показателей групп I и III; рII–III — уровень значимости при сравнении показателей групп II и III.
БАД — биологически активная добавка.
Таблица 3. Особенности течения первого триместра у пациенток с различными подтипами гестационного сахарного диабета и группой контроля
Показатель | Беременные | Р | ||||
Группа I (n=45) | Группа II (n=43) | Группа III (n=42) | рI – II | рI–III | рII–III | |
Характеристика текущей беременности | ||||||
Тошнота, n (%) | 30 (67) | 25 (58) | 31 (74) | 0,98 | 0,98 | 0,51 |
Выраженная слабость, утомляемость, n (%) | 20 (44) | 23 (53) | 27 (64) | 0,76 | 0,26 | 0,76 |
Изменение пищевых предпочтений, n (%) | 14 (31) | 6 (14) | 16 (38) | 0,15 | 0,51 | 0,04 |
Анемия, n (%) | 3 (7) | 2 (5) | 1 (2) | 1,00 | 1,00 | 1,00 |
Примечание. рI–II — уровень значимости при сравнении показателей групп I и II; рI–III — уровень значимости при сравнении показателей групп I и III; рII–III — уровень значимости при сравнении показателей групп II и III.
Таблица 4. Особенности физической активности у пациенток с различными подтипами гестационного сахарного диабета и группой контроля
Показатель | Беременные | Р | ||||
Группа I (n=45) | Группа II (n=43) | Группа III (n=42) | рI–II | рI–III | рII–III | |
Низкая ФА до текущей беременности, n (%) | 19 (42) | 27 (63) | 20 (47) | 0,001 | 0,02 | 0,12 |
Низкая ФА во время текущей беременности, n (%) | 6 (13) | 14 (33) | 12 (29) | 0,20 | 0,35 | 0,35 |
Примечание. рI–II — уровень значимости при сравнении показателей групп I и II; рI–III — уровень значимости при сравнении показателей групп I и III; рII–III — уровень значимости при сравнении показателей групп II и III.
ФА — физическая активность.
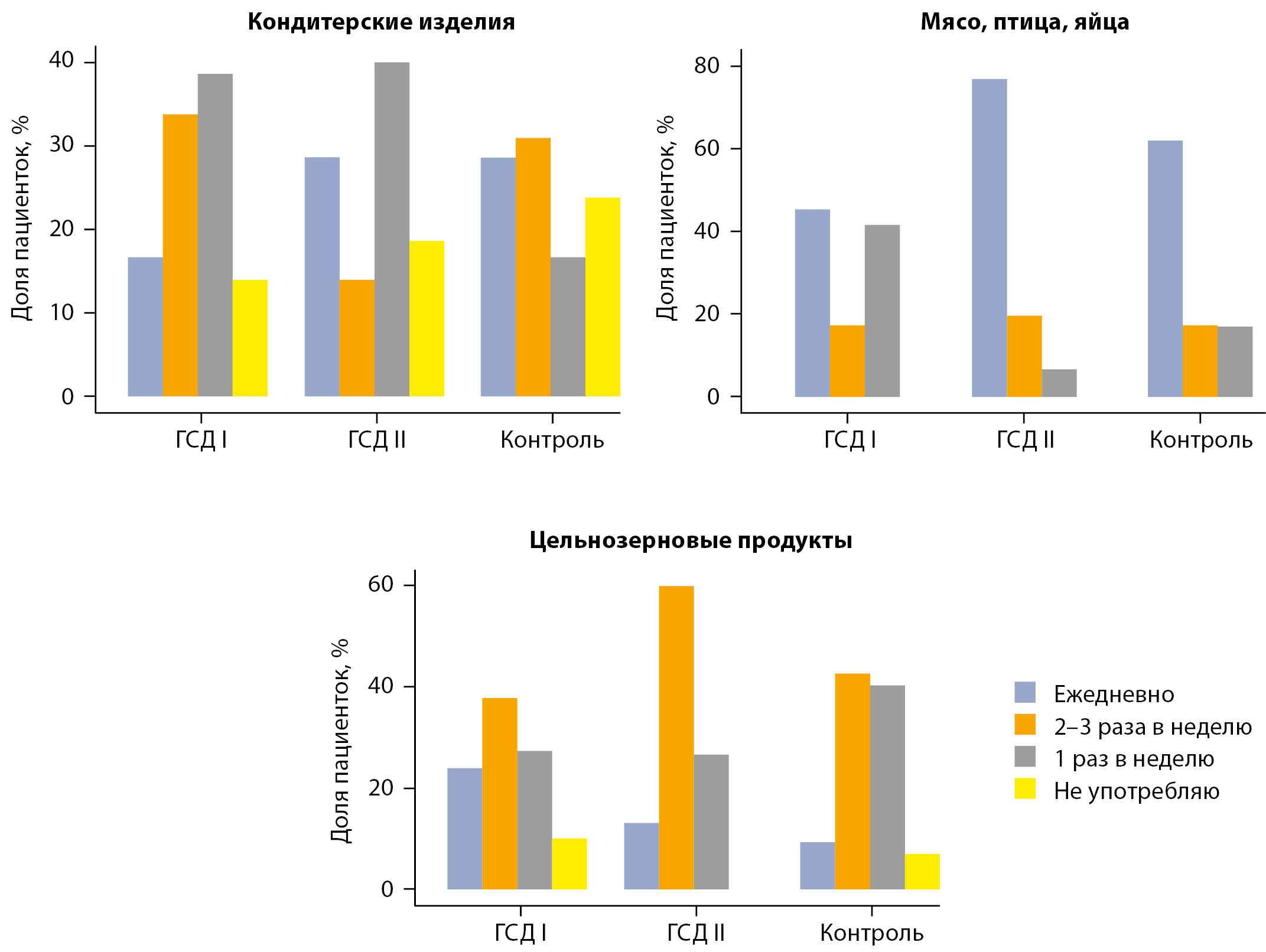
Рисунок 1. Частота употребления различных продуктов среди пациенток из разных групп.
Примечание. ГСД — гестационный сахарный диабет.
Таблица 5. Особенности питания у пациенток с различными подтипами гестационного сахарного диабета и группой контроля
Показатель | Беременные | Р | ||||
Группа I (n=45) | Группа II (n=43) | Группа III (n=42) | рI–II | рI–III | рII–III | |
Фрукты и ягоды — 2 и более порции в день, n (%) | 28 (62) | 29 (67) | 22 (52) | 0,52 | 0,05 | 0,03 |
Овощи — 2 и более порции в день, n (%) | 27 (60) | 32 (74) | 21 (50) | 0,22 | 0,02 | 0,02 |
Молочные продукты — 2–3 чашки в день, n (%) | 8 (18) | 12 (28) | 12 (29) | 0,05 | 0,07 | 0,07 |
Мясо/птица/яйца, n (%) | 12 (27) | 33 (77) | 26 (62) | 0,001 | 0,001 | 0,007 |
Продукты из переработанного мяса, n (%) | 0 (0) | 2 (5) | 2 (5) | 0,75 | 0,75 | 0,75 |
Кондитерские изделия, n (%) | 4 (9) | 14 (33) | 12 (29) | 0,04 | 0,05 | 0,07 |
Рыба и морепродукты, n (%) | 2 (4) | 4 (9) | 1 (2) | 1,00 | 1,00 | 1,00 |
Цельнозерновые продукты, n (%) | 12 (27) | 6 (14) | 4 (10) | 0,03 | 0,22 | 0,22 |
Примечание. рI–II — уровень значимости при сравнении показателей групп I и II; рI–III — уровень значимости при сравнении показателей групп I и III; рII–III — уровень значимости при сравнении показателей групп II и III.
Таблица 6. Биохимические различия у пациенток с подтипами гестационного сахарного диабета и группой контроля
Показатель | ГСД I | ГСД II | Контроль | рI – II | рI–III | рII–III |
ТГ, ммоль/л | 2,55 | 3,2 | 2,15 | 0,01 | 0,59 | 0,001 |
ОХС, ммоль/л | 6,04 | 6,66 | 6,53 | 0,19 | 0,39 | 0,86 |
ЛПНП, ммоль/л | 3,58 | 4,59 | 4,56 | 0,07 | 0,16 | 0,87 |
ЛПВП, ммоль/л | 1,63 | 1,58 | 1,66 | 0,79 | 0,88 | 0,98 |
Апо-А, мг/дл | 220 | 255 | 170 | 0,23 | <0,001 | <0,001 |
Апо-В, мг/дл | 100 | 120 | 97,5 | 0,02 | 0,99 | 0,02 |
СРБ, мг/л | 8,26 | 14,7 | 8,56 | <0,001 | 0,93 | <0,001 |
HbA1c, % | 5,05 | 5,25 | 4,35 | 0,54 | <0,001 | <0,001 |
Адипонектин, нг/мл | 14,8 | 8,16 | 17,1 | <0,001 | 0,79 | 0,004 |
Лептин, нг/мл | 30,6 | 42,5 | 38,2 | 0,05 | 0,89 | 0,17 |
Оментин, нг/мл | 110 | 107 | 108 | 0,57 | 0,91 | 0,81 |
Примечание. рI–II — уровень значимости при сравнении показателей групп ГСД I и ГСД II; рI–III — уровень значимости при сравнении показателей групп ГСД I и контроль; рII–III — уровень значимости при сравнении показателей групп ГСД II и контроль.
ГСД — гестационный сахарный диабет; ТГ — триглицериды; ОХС — общий холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; Апо-А — аполипопротеин А; Апо-В — аполипопротеин В; СРБ — С-реактивный белок; HbA1c — гликированный гемоглобин.
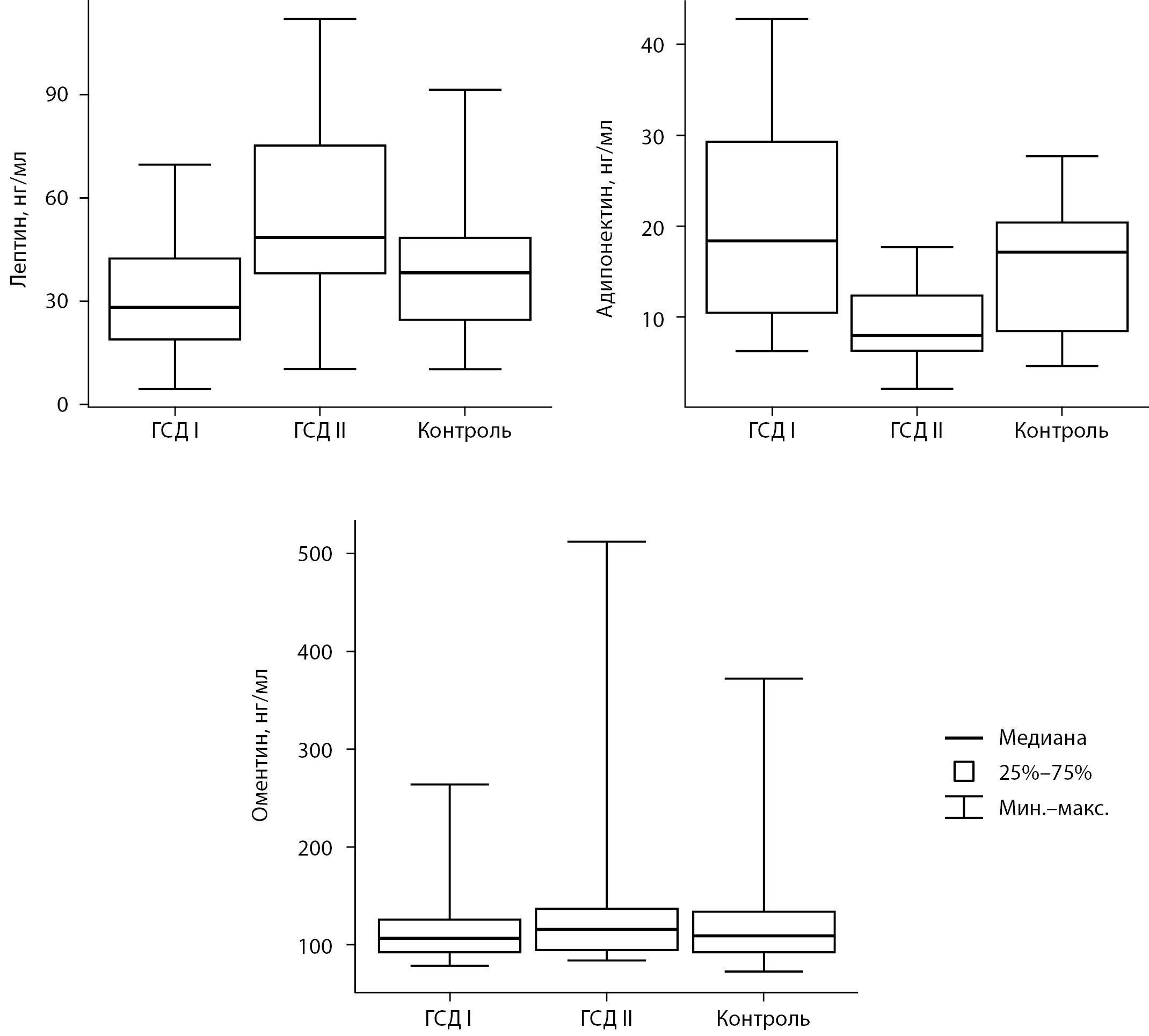
Рисунок 2. Гормоны: лептин, адипонектин, оментин у пациенток с различными подтипами гестационного сахарного диабета.
Примечание: ГСД — гестационный сахарный диабет.
ОБСУЖДЕНИЕ
На основании расчета индекса Matsuda удалось выявить разные подтипы ГСД. Расчет индекса Matsuda проводился на основании данных, полученных в ходе ПГТТ. При получении значения индекса Matsuda >50-го процентиля в сравнении со значениями беременных без нарушений углеводного обмена мы классифицировали пациентку как имеющую ГСД с преобладающей дисфункцией β-клеток. Если значение индекса Matsuda составляло <50-го процентиля, мы относили пациентку в группу ГСД с преобладающей ИР. Ряд исследователей (Powe, 2016 г., Liu, 2018 г.) в своих работах использовали меньшее значение процентиля — 25, что в последующем подвергалось критике. Решение принять за точку отсечения 50-й процентиль принято потому, что он позволяет выделить два подтипа без смешанных вариантов и так называемых серых зон, описанных в других исследованиях [10].
Полученные данные продемонстрировали, что беременные с различными подтипами ГСД имели ряд анамнестических, фенотипических, биохимический различий. В первую очередь отличались возраст и антропометрические данные. В частности, беременные с выраженной ИР были старше, имели больший рост и вес до наступления беременности, большую прибавку веса с момента зачатия и до конца второго триместра, чаще имели признаки acanthosis nigricans в сравнении с пациентками с ГСД и дисфункцией β-клеток. Полученные данные соответствуют ранее проведенному исследованию [10]. В исследовании Benhalima K. и соавт., 2019 г., также были выявлены различия по уровню АД у пациенток с различными подтипами, а также наследственности по СД, которые не были обнаружены в нашем исследовании, что может быть связано с меньшим количеством включенных в исследование пациенток, а также с более молодым возрастом участниц.
При анализе анамнеза предыдущих родов было выявлено, что пациентки с ГСД и ИР имели более крупных первенцев при рождении, вес которых не соответствовал макросомии, в сравнении с пациентками из группы контроля и пациентками с ГСД и дисфункцией β-клеток (однако статистически значимых различий при сравнении пациенток из первых двух групп наблюдения с ГСД выявлено не было). Вместе с этим данные по весу вторых детей, общей прибавки веса за период каждой предыдущей беременности и наличию ГСД в анамнезе не отличались между всеми группами наблюдения. Эти данные могут быть объяснены в первую очередь тем, что вес пациенток с ГСД и ИР был значимо больше, в сравнении с пациентками из других групп, а избыточная масса тела и ожирение являются факторами, способствующими рождению более крупных детей [18].
Достоверно чаще беременные из группы I указывали факт приема фолиевой кислоты во время текущей на момент исследования беременности в сравнении с пациентками из двух других групп наблюдения. Однако интерпретировать эти данные следует с осторожностью, поскольку прием комбинированных витаминных препаратов (поливитаминов) не различался между всеми группами наблюдения, а большинство назначаемых во время беременности препаратов содержат фолиевую кислоту, о чем пациентки могут не быть осведомлены. В то же время данные о взаимосвязи фолиевой кислоты и ГСД противоречивы [19], а прием фолиевой кислоты показан для профилактики развития дефектов нервной трубки плода [20].
Беременные с ГСД и ИР из группы II реже отмечали изменение пищевых привычек в начале беременности, что, вероятно, нашло отражение в динамике веса (имели большую прибавку веса на момент обследования) при сравнении с пациентками из других групп.
Влияние факторов образа жизни, а именно питания и физической активности на ГСД активно изучаются отечественными и зарубежными исследователями. В нашем исследовании беременные с ГСД и ИР достоверно чаще имели низкую физическую активность при сравнении с другими группами, в то время как пациентки с ГСД и дисфункцией β-клеток наоборот имели более высокую физическую активность по сравнению с контрольной группой.
Беременные с ГСД и ИР больше употребляли овощей, фруктов и ягод в сравнении с пациентками из группы контроля и достоверно больше употребляли овощей, чем беременные с ГСД из группы I.
В нашем исследовании не было разделения по типу потребляемых овощей, поэтому нельзя исключить, что потребление овощей у беременных с ГСД и ИР выше за счет представителей, характеризующихся высоким гликемическим индексом, в частности крахмалистых корнеплодов, прошедших термическую обработку (картофель, свекла, морковь, батат). Отмечены и другие различия: в частности беременные с ГСД и ИР потребляли больше мяса, птицы и яиц, чаще употребляли кондитерские изделия и реже — цельнозерновые продукты в сравнении с беременными с ГСД и дисфункций β-клеток.
Физическая активность и питание — признанные и модифицируемые факторы риска ожирения и избыточной массы тела, ГСД [5] и, возможно, имеют значение для развития определенных подтипов ГСД. Так, согласно нашему исследованию, беременные с ГСД и ИР чаще имели низкий уровень физической активности и чаще потребляли продукты, богатые насыщенными жирами (яйца, птицу, мясо), трансжирами (кондитерские изделия).
По результатам исследования J. Layton, беременные с ГСД и преобладающей ИР имели наихудший липидный профиль [15], что согласуется с результатами нашего исследования, однако статически значимые различия получены по уровню триацилглицеридов.
У всех беременных с ГСД были обнаружены высокие уровни аполипопротеинов А и В, при этом уровень апо-В статистически значимо различался у пациенток с разными подтипами ГСД. При анализе потенциально значимых для патогенеза гормонов было выявлено, что беременные с ГСД и ИР имели самые низкий уровень адипонектина в сравнении с беременными с ГСД без выраженной ИР, что также подтверждается данными другого исследования [10].
Ограничения исследования
Данное исследование имеет несколько ограничений.
В клинику, на базе которой проходило обследование пациенток, направляются беременные из Ростовской области, часто имеющие факторы риска развития ГСД или отягощенный акушерский анамнез, в связи с чем распространенность ГСД выше популяционной.
Кроме того, данные анамнеза, особенности физической активности и питания оценивались по результатам анкетирования, в связи с чем нельзя исключить некоторую неточность, связанную с субъективным восприятием некоторых аспектов образа жизни участниц исследования.
Заключение
Мы продемонстрировали клиническую неоднородность у пациенток с различными подтипами ГСД. Такие признаки, как возраст, ИМТ, acanthosis nigricans, различались у пациенток с подтипами ГСД. Выявлены различия при анализе фармакологического анамнеза, а именно в частоте приема фолиевой кислоты. При анализе других данных анамнеза не было выявлено различий между подгруппами с ГСД.
Достоверные различия получены при оценке уровня физической активности и особенностей питания (в частности, различалась частота употребления продуктов, богатых насыщенными жирами: мясо, яйца, птица; кондитерских изделий и цельнозерновых продуктов).
Множественные биохимические различия получены при анализе данных пациенток из разных подгрупп, а именно по уровням ТГ, апо-В, СРБ, адипонектина.
Полученные данные могут стать основой разработки критериев для дифференциальной диагностики подтипов ГСД.
Необходимо продолжать изучение гетерогенности ГСД для улучшения акушерских и перинатальных прогнозов у таких пациенток и их потомства, особенно с учетом прогнозируемого роста числа таких больных.
Дополнительная информация
Источники финансирования. Работа выполнена в рамках государственного задания Министерства здравоохранения Российской Федерации (тема №21052700088-0 от 27.05.2021 г.).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Участие авторов. Все авторы внесли значимый вклад в написание и подготовку статьи, одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Волкова Н.И. — организация исследования, анализ результатов; Давиденко И.Ю. — дизайн исследования, консультирование пациентов, статистическая обработка и анализ результатов, написание рукописи; Дегтярева Ю.С. — сбор данных, консультирование пациентов, написание текста; Авруцкая В.В. — сбор данных, консультирование пациентов; Сорокина Ю.А. — сбор данных, анализ данных и интерпретация результатов.
Список литературы
1. Magliano DJ, Boyko EJ. IDF Diabetes Atlas 10th edition scientific committee. IDF DIABETES ATLAS [Internet]. 10th edition. Brussels: International Diabetes Federation; 2021. Chapter 3, Global picture. Available from: https://www.ncbi.nlm.nih.gov/books/NBK581940
2. Lowe WL Jr, Scholtens DM, Kuang A, et al. Hyperglycemia and Adverse Pregnancy Outcome Follow-up Study (HAPO FUS): Maternal Gestational Diabetes Mellitus and Childhood Glucose Metabolism. Diabetes Care. 2019;42(3):372-380. doi: https://doi.org/10.2337/dc18-1646
3. Committee on Practice Bulletins — Obstetrics ACOG practice bulletin no. 190: gestational diabetes mellitus. Obstet Gynecol. 2018;131:e49–e64. doi: https://doi.org/10.1097/AOG.0000000000002501
4. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 10-й вып. // Сахарный диабет. — 2021. — Т. 24. — №1S. — С. 1-148. doi: https://doi.org/10.14341/DM12802
5. Попова П.В., Ткачук А.С., Болотько Я.А., и др. Параметры образа жизни и риск гестационного сахарного диабета: что можно изменить? // Сахарный диабет. — 2017. — Т. 20. — №1. — С. 85-92. doi: https://doi.org/10.14341/DM8226
6. Демидова Т.Ю., Ушанова Ф.О. Патофизиологические аспекты развития гестационного сахарного диабета // РМЖ. Медицинское обозрение. — 2019. — Т. 3. — №10(II). — С. 86-91.
7. Powe CE, Hivert MF, Udler MS. Defining Heterogeneity Among Women With Gestational Diabetes Mellitus. Diabetes. 2020;69(10):2064-2074. doi: https://doi.org/10.2337/dbi20-0004
8. Cheney C, Shragg P, Hollingsworth D. Demonstration of heterogeneity in gestational diabetes by a 400-kcal breakfast meal tolerance test. Obstet Gynecol. 1985;65:17–23
9. Волкова Н.И., Давиденко И.Ю., Дегтярева Ю.С. Гестационный сахарный диабет // Акушерство и гинекология. — 2021. — №9. — С. 174-179. doi:https://.doi.org/10.18565/aig.2021.9.174-179
10. Benhalima K, Van Crombrugge P, Moyson C, et al. Characteristics and pregnancy outcomes across gestational diabetes mellitus subtypes based on insulin resistance. Diabetologia. 2019;62(11):2118-2128. doi: https://doi.org/10.1007/s00125-019-4961-7
11. Powe CE, Allard C, Battista MC, Doyon M, et al. Heterogeneous Contribution of Insulin Sensitivity and Secretion Defects to Gestational Diabetes Mellitus. Diabetes Care. 2016;39(6):1052-5. doi: https://doi.org/10.2337/dc15-2672
12. Волкова Н.И., Давиденко И.Ю., Сорокина Ю.А., и др. Методы оценки инсулинорезистентности при гестационном сахарном диабете // Медицинский вестник Юга России. — 2022. — Т. 13. — №1. — С. 5-12. doi: https://doi.org/10.21886/2219-8075-2022-13-1-5-12
13. Liu Y, Hou W, Meng X, et al. Heterogeneity of insulin resistance and beta cell dysfunction in gestational diabetes mellitus: a prospective cohort study of perinatal outcomes. J Transl Med. 2018;16:289. doi: https://doi.org/10.1186/s12967-018-1666-5
14. Feghali M, Atlass J, Ribar E, et al. 82:Subtypes of gestational diabetes mellitus based on mechanisms of hyperglycemia. American Journal of Obstetrics and Gynecology. 2019;220(1S):S66. doi: https://doi.org/10.1016/j.ajog.2018.11.091
15. Layton J, Powe C, Allard C, Battista M, et al. Maternal lipid profile differs by gestational diabetes physiologic subtype. Metabolism. 2019;91:39-42. doi: https://doi.org/10.1016/j.metabol.2018.11.008
16. Retnakaran R, Ye C, Hanley AJ, et al. Subtypes of gestational diabetes and future risk of pre-diabetes or diabetes. E Clinical Medicine. 2021;40:101087. doi: https://doi.org/10.1016/j.eclinm.2021.101087
17. Liu L, Ma Y, Wang N, Lin W, Liu Y, Wen D. Maternal body mass index and risk of neonatal adverse outcomes in China: a systematic review and meta-analysis. BMC Pregnancy Childbirth. 2019;19(1):105. doi: https://doi.org/10.1186/s12884-019-2249-z
18. Society of Maternal-Fetal Medicine (SMFM) Publications Committee. Electronic address: pubs@smfm.org. SMFM Statement: Pharmacological treatment of gestational diabetes. Am J Obstet Gynecol. 2018;218(5):B2-B4. doi: https://doi.org/10.1016/j.ajog.2018.01.041
19. Pazzagli L, Segovia Chacón S, Karampelias C, et al. Association between folic acid use during pregnancy and gestational diabetes mellitus: Two population-based Nordic cohort studies. PLoS One. 2022;17(8):e0272046. doi: https://doi.org/10.1371/journal.pone.0272046
20. Viswanathan M, Treiman KA, Doto JK, et al. Folic Acid Supplementation: An Evidence Review for the U.S. Preventive Services Task Force [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2017 Jan. (Evidence Synthesis, No. 145.) Table 2, Current Guidelines for Folic Acid Supplementation. Available from: https://www.ncbi.nlm.nih.gov/books/NBK410115/table/ch1.t2/
Об авторах
Н. И. ВолковаРоссия
Волкова Наталья Ивановна - д.м.н., профессор.
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. Ю. Давиденко
Россия
Давиденко Илья Юрьевич - к.м.н., доцент.
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Ю. С. Дегтярева
Россия
Дегтярева Юлия Сергеевна - н.с.
344022, Ростов-на-Дону, пер. Нахичеванский, 29
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Ю. А. Сорокина
Россия
Сорокина Юлия Алексеевна - к.м.н., ассистент.
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
В. В. Авруцкая
Россия
Авруцкая Валерия Викторовна - д.м.н., доцент, профессор.
Ростов-на-Дону
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Дополнительные файлы
|
|
1. Рисунок 1. Частота употребления различных продуктов среди пациенток из разных групп. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(254KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Гормоны: лептин, адипонектин, оментин у пациенток с различными подтипами гестационного сахарного диабета. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(232KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Волкова Н.И., Давиденко И.Ю., Дегтярева Ю.С., Сорокина Ю.А., Авруцкая В.В. Клиническая характеристика пациенток с различными подтипами гестационного сахарного диабета: результаты исследований. Сахарный диабет. 2024;27(4):336-346. https://doi.org/10.14341/DM13105
For citation:
Volkova N.I., Davidenko I.Y., Degtiareva Y.S., Sorokina Y.A., Avrutskaya V.V. Clinical characteristics of patients with different subtypes of gestational diabetes mellitus: research results. Diabetes mellitus. 2024;27(4):336-346. (In Russ.) https://doi.org/10.14341/DM13105

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































