Перейти к:
Эндотелиальная дисфункция у лиц с ожирением при наличии и отсутствии сахарного диабета 2 типа: оценка специфических маркеров
https://doi.org/10.14341/DM13088
Аннотация
ОБОСНОВАНИЕ. Одной из важнейших функций эндотелия является поддержание гомеостаза организма человека. На сегодняшний день сформулирована концепция, согласно которой, эндотелиальная дисфункция является центральным звеном в патогенезе сердечно-сосудистых заболеваний (ССЗ). Наличие сахарного диабета (СД) значимо увеличивает риски ССЗ. Часто СД 2 типа (СД2) наблюдается при избыточной массе тела, однако существует популяция лиц с ожирением, у которых в течение длительного времени не развивается СД2.
ЦЕЛЬ. Сравнить уровень маркеров эндотелиальной дисфункции в двух группах лиц c ожирением (без СД2 и с СД2), а также оценить влияние приема антидиабетических кардиопротективных препаратов (агонистов рецепторов глюкагоноподобного пептида 1 (арГПП-1) и ингибиторов натрий-глюкозного транспортера 2 (иНГЛТ-2)) на данные маркеры.
МАТЕРИАЛЫ И МЕТОДЫ. В данное исследование были включены 2 группы пациентов с ожирением, одна из которых не имела нарушений углеводного обмена, вторая страдала СД2. Оценивались маркеры эндотелиальной дисфункции: фактор фон Виллебранда, сосудистый эндотелиальный фактор роста А, растворимый Е-селектин (sE-selectin), растворимая молекула межклеточной адгезии-1.
РЕЗУЛЬТАТЫ. Получено значимое повышение уровня sЕ-Selectin в группе пациентов с ожирением и СД2 по сравнению с лицами без нарушений углеводного обмена (46,65 [36,23; 66,66] vs 33,05 [22,1; 53,31] нг/мл). Различий по уровням маркеров эндотелиальной дисфункции в подгруппах пациентов с СД2 с уровнем гликированного гемоглобина <8% и >8% обнаружено не было. Также не отмечено влияние назначения кардиопротективных препаратов (иНГЛТ-2 и/или арГПП-1) на исследуемые показатели функции эндотелия у лиц с СД2, по результатам значимых корреляций маркеров эндотелиальной дисфункции не получено.
ЗАКЛЮЧЕНИЕ. Мы предполагаем, что повышение уровня sE-selectin может являться ранним маркером эндотелиальной дисфункции у лиц с ожирением и СД2.
Ключевые слова
Для цитирования:
Покровская Е.В., Шестакова Е.А., Шестакова М.В. Эндотелиальная дисфункция у лиц с ожирением при наличии и отсутствии сахарного диабета 2 типа: оценка специфических маркеров. Сахарный диабет. 2023;26(5):439-445. https://doi.org/10.14341/DM13088
For citation:
Pokrovskaya E.V., Shestakova E.A., Shestakova M.V. Endothelial dysfunction in patients with obesity and type 2 diabetes mellitus or normoglycemia: assessment of specific markers. Diabetes mellitus. 2023;26(5):439-445. (In Russ.) https://doi.org/10.14341/DM13088
ОБОСНОВАНИЕ
За последние 50 лет во всем мире произошло значительное увеличение распространенности ожирения, которое является основным фактором риска развития ряда неинфекционных заболеваний, в первую очередь сахарного диабета 2 типа (СД2). Патогенез СД2 и ожирения сходен, они имеют общие пути развития инсулинорезистентности, окислительного стресса, а также протромботических и провоспалительных паттернов [1][2]. Оба состояния тесно связаны с возникновением сердечно-сосудистых заболеваний (ССЗ) и атеросклероза, которые являются основной причиной высокого риска ранней смерти у этих пациентов [3][4]. В то же время данные клинических исследований показали, что у части пациентов (10–30%) даже длительное наличие ожирения, в том числе морбидного, не сопровождается развитием СД2, что привело к концепции метаболически здорового ожирения (МЗО). Согласно данной концепции, группа людей с МЗО не имеет явных кардиометаболических нарушений [5][6]. Точные механизмы, ответственные за сохранение метаболического здоровья у людей с MЗO, неизвестны. Выраженность эндотелиальной дисфункции может являться дифференцирующим фактором между состояниями МЗО и ожирением с СД2 [7–9].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью настоящего исследования являлись сравнение уровней маркеров эндотелиальной дисфункции в двух группах лиц (без СД2 и с СД2), а также оценка влияния приема антидиабетических кардиопротективных препаратов (ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) и агонистов рецепторов глюкагоноподобного пептида-1 типа (арГПП-1)) на данные маркеры.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Время исследования. 01.08.2022–30.10.2023 гг.
Изучаемые группы (одна или несколько)
Изучались 2 группы больных:
- С ожирением и СД2.
- С ожирением без СД2 и других нарушений углеводного обмена.
Группа «1»
Критерии включения.
- ИМТ ≥30 кг/м².
- Наличие диагноза СД2.
- Возраст ≥35 лет.
- Подписанное информированное согласие.
Группа «2»
Критерии включения.
- ИМТ ≥30 кг/м².
- Отсутствие нарушений углеводного обмена.
- Возраст ≥35 лет.
- Подписанное информированное согласие.
Критерии исключения.
- СД 1 типа.
- Уровень гемоглобина менее 70 г/л.
- Расчетная скорость клубочковой фильтрации менее 45 мл/мин/1,73 м².
- Острое нарушение мозгового кровообращения, инфаркт миокарда в течение последних 6 мес.
- Онкологические заболевания.
- Беременность или период лактации.
- Отсутствие возможности у пациента осуществлять запланированные визиты для проведения исследований.
Дизайн исследования
Одномоментное когортное одноцентровое исследование.
Методы
Все пациенты были зарегистрированы в электронной базе данных учреждения и имели амбулаторную или стационарную карту, а также подписали добровольное информированное согласие на взятие образцов крови.
Всем пациентам было проведено общеклиническое и лабораторное обследование. Общеклиническое обследование включало измерение роста, массы тела, расчет ИМТ по формуле отношения массы тела в килограммах к квадратному значению роста, выраженному в метрах (кг/м²).
Лабораторное обследование включало следующее.
- Определение уровня гликированного гемоглобина (HbA1c). Определение HbA1cпроводилось методом высокоэффективной жидкостной хроматографии HPLC (High performance liquid chromatography) на анализаторе BioRad (D-10) с использованием стандартных наборов BioRadD-10.
- Биохимический анализ крови — липидный спектр (общий холестерин, липопротеиды низкой плотности (ЛПНП), триглицериды), глюкоза плазмы — выполнен на аппарате ARCHITECT 8000 с использованием коммерческих наборов фирмы Abbott.
- Определение маркеров эндотелиальной дисфункции проводилось в сыворотке крови с использованием ручных наборов ИФА SIGMA (США): VWF (Human von Willebrand Factor, фактор фон Виллебранда), чувствительность 0,4 нг/мл; VEGF-A (Vascular endothelial growth factor А, сосудистый эндотелиальный фактор роста А), чувствительность 10 пг/мл; sЕ-Selectin (Soluble form Е-Selectin, растворимый Е-селектин), чувствительность 30 пг/мл; sICAM1 (Soluble intercellular adhesion molecule-1, растворимая молекула межклеточной адгезии-1), чувствительность 150 пг/мл.
Дополнительный анализ маркеров эндотелиальной дисфункции среди лиц с СД2
В рамках исследования пациенты с СД2 были разделены на подгруппы:
- с уровнем HbA1c ≤8% и >8%;
- получающие кардиопротективную терапию (препараты из групп иНГЛТ-2 и/или арГПП-1) и любые другие антидиабетические препараты.
Статистический анализ
Статистическую обработку данных выполняли в программе Statistica 13.3. Распределения количественных признаков представлены в виде медиан и межквартильного интервала (1 и 3 квартили) — Me [Q1; Q3]. U-критерий Манна–Уитни был применен для сравнения количественных данных двух независимых выборок. Качественные данные представлены в виде абсолютных (n) частот. Сравнение качественных переменных в независимых выборках выполнялось с помощью критерия χ² Пирсона. Cтатистическая значимость различий устанавливалась при p<0,05.
Этическая экспертиза
Проведение исследования одобрено локальным этическим комитетом ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России (выписка из протокола № 13 от 13 июля 2022 г.). Все пациенты, включенные в исследование, подписывали информированное согласие.
РЕЗУЛЬТАТЫ
В исследование включено 2 группы пациентов с ожирением — контрольная группа без СД и лица с СД2 (n=30 в обеих группах). Сравнительные данные по антропометрическому и лабораторному обследованию приведены в табл. 1.
Таблица 1. Сравнительная оценка
основных общеклинических и биохимических показателей крови
в двух группах пациентов
|
Показатель |
СД2 |
Без СД |
p |
|
ИМТ, кг/м² |
39,65 [ 35,8; 43,6] |
37,4 [ 34,3: 44,1] |
0,319 |
|
Пол (муж/жен) |
11/19 |
9/21 |
0,150 (х²) |
|
Возраст, годы |
53,5 [ 46,0; 59,0] |
46 [ 36; 56] |
0,164 |
|
HbA1c, % |
8,8 [ 7,2; 10,8] |
5,7 [ 5,2; 5,8] |
0,000 |
|
Хс общий, ммоль/л |
5,26 [ 3,78; 5,83] |
4,99 [ 4,58; 6,09] |
0,706 |
|
ТГ, ммоль/л |
2,08 [ 1,55; 2,74] |
1,58 [ 1,04; 2,11] |
0,023 |
|
ЛПНП, ммоль/л |
3,26 [ 2,32; 4,10] |
3,22 [ 2,70; 4,10] |
0,918 |
Примечание. Данные количественных признаков представлены
в виде медианы и интерквартильного размаха (Q1; Q3),
качественных — в виде абсолютных частот.
Сравнение количественных признаков проводилось
с помощью U-критерия Манна–Уитни;
сравнение качественных признаков выполнялось
с помощью критерия χ² Пирсона.
Полужирным выделены статистически значимые значения p<0,05.
Обе группы были сопоставимы по ИМТ и возрасту. Группы закономерно отличались по уровню HbA1c, а также по уровню триглицеридов, который был выше у лиц с СД2.
У пациентов также проводилась оценка маркеров эндотелиальной дисфункции (табл. 2). Между контрольной группой и лицами с СД2 получены различия в уровне sE-Selectin, который был значимо выше в группе пациентов с СД2. По остальным показателям значимых различий не выявлено (табл. 2).
Таблица 2. Сравнительная характеристика
маркеров эндотелиальной дисфункции в двух группах пациентов
|
Показатель |
СД2 |
Без СД |
p |
|
sE-Selectin, нг/мл |
46,65 [ 36,23; 66,66] |
33,05 [ 22,1; 53,31] |
0,019 |
|
sICAM-1, пг/мл |
127,99 [ 103,40; 147,60] |
122,65 [ 107,19; 140,32] |
0,752 |
|
VEGF-A, пг/мл |
34,01 [ 22,36; 64,32] |
25,53 [ 10,22; 64,02] |
0,331 |
|
VWF, нг/мл |
12760 [ 8144; 20576] |
8840 [ 5856; 15032] |
0,057 |
Дополнительный анализ
С целью оценки влияния гликемического контроля на параметры состояния эндотелия мы провели сравнительную оценку маркеров эндотелиальной дисфункции внутри группы пациентов с ожирением и СД2. Из нашей выборки сформирована подгруппа, включающая 16 человек с относительно удовлетворительной компенсацией углеводного обмена (HbA1c≤8%), и подгруппа, включающая 13 человек с декомпенсацией углеводного обмена (HbA1с>8%). По результатам сравнения значимых различий всех четырех маркеров эндотелиальной дисфункции между двумя подгруппами обнаружено не было.
Также мы оценили маркеры эндотелиальной дисфункции в подгруппе пациентов, получающих кардиопротективные антидиабетические препараты. К данным препаратам относятся иНГЛТ-2 и арГПП-1. Для оценки влияния данных препаратов на маркеры эндотелиальной дисфункции группа лиц с СД2 была разделена на 2 подгруппы: 1 — лица, принимающие иНГЛТ-2 и/или арГПП-1, 2 — лица, принимающие любую сахароснижающую терапию, кроме иНГЛТ-2 и арГПП-1. Во второй подгруппе пациенты принимали различные комбинации бигуанидов, препаратов сульфонилмочевины, ингибиторов дипептидилпептидазы-4, инсулинотерапию. По результатам сравнения двух подгрупп значимых различий в уровне маркеров эндотелиальной дисфункции не получено.
ОБСУЖДЕНИЕ
Эндотелиальная дисфункция представляет собой ранний маркер метаболических заболеваний. Нарушение способности эндотелия продуцировать и высвобождать вазоактивные медиаторы считается начальным признаком нарушения сосудистой активности при СД и способствует ускоренному прогрессированию атеросклеротических поражений [10].
При СД2 инсулинорезистентность и компенсаторная гиперинсулинемия вызывают дисбаланс экспрессии/активности эндотелиальной синтазы оксида азота (eNOS), уменьшая количество субстратов/кофакторов eNOS и/или ускоряя превращение оксида азота (NO) в активные формы кислорода. Последствия заключаются в снижении сосудистой релаксации, повышенной экспрессии молекул адгезии, таких как VCAM-1 и E-Selectin, и более сильной предрасположенности к проатерогенным и воспалительным явлениям [11].
Механизмы дисфункции эндотелиальных клеток, связанные с воспалением, представлены на рис. 1.
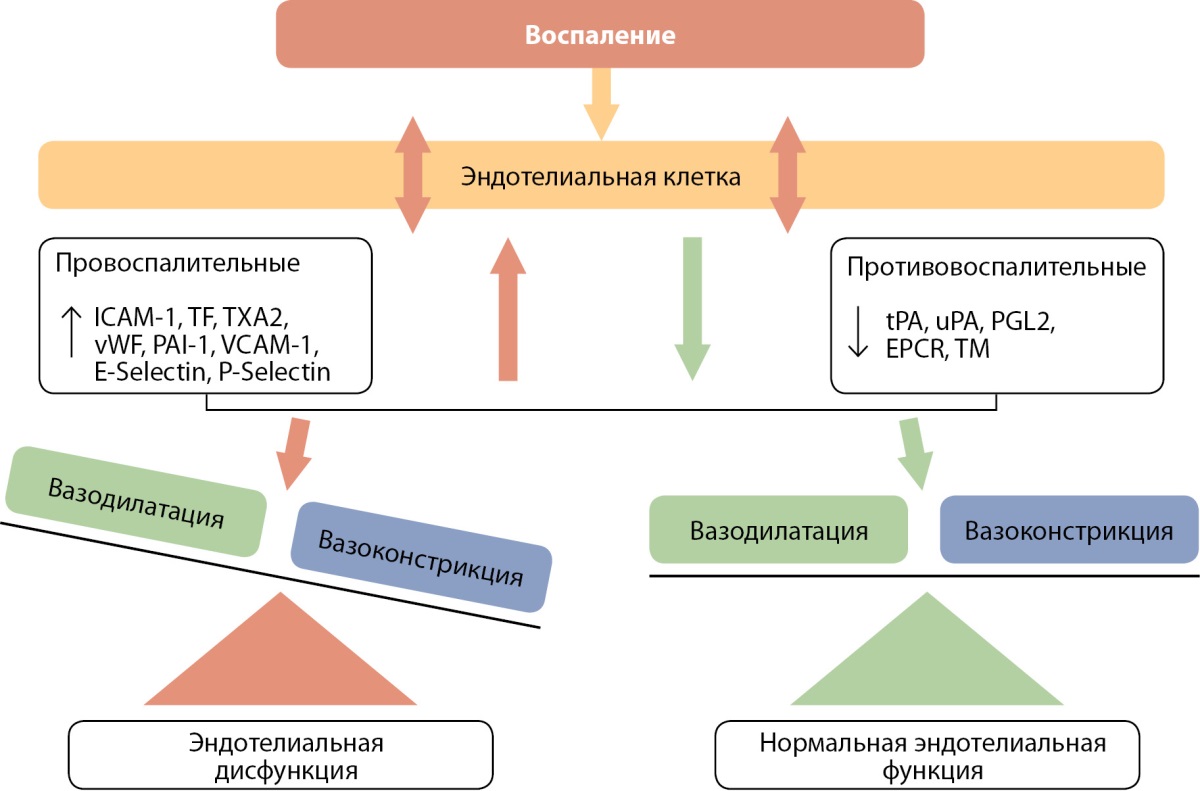
Рисунок 1. Механизмы дисфункции эндотелиальных клеток,
связанные с воспалением (адаптировано из [12]).
Существует большое количество маркеров эндотелиальной дисфункции, изучение которых проводится более 20 лет. В когортном исследовании MONICA/KORA с целью прогнозирования возникновения СД2 и коронарных событий предложен набор 13 биомаркеров, связанных с воспалением, который состоит из белка острой фазы (CRP), цитокинов (IL-6, IL-18, TGF-β1, MIF), хемокинов (MCP-1/CCL2, IL-8/CXCL8, IP-10/CXCL10, RANTES/CCL5), адипокинов (адипонектин, лептин) и растворимых молекул адгезии (sE-Selectin, sICAM-1) [13]. Помимо вышеописанной панели биомаркеров в развитии эндотелиальной дисфункции участвуют: растворимые молекулы адгезии сосудистых клеток (sVCAM), растворимый P-селектин (sP-с Selectin), асимметричный диметиларгинин (ADMA), окисленный липопротеин низкой плотности (oxLDL), ингибитор активатора плазминогена (PAI-1), VWF и С-реактивный белок (СРБ), эндотелин 1 (ET-1), фактор некроза опухоли альфа (TNF-α), интерлейкины (IL-1-6) [14].
В литературе отмечается, что эндотелиальная дисфункция наблюдается не только у лиц с развившимся СД2, но и у лиц с ожирением без нарушений углеводного обмена [12][15]. Однако сравнение выраженности продукции маркеров эндотелиальной дисфункции между двумя группами лиц с равной выраженностью ожирения, но разным статусом нарушений углеводного обмена не проводилось.
В нашем исследовании в обеих группах проводилась сравнительная оценка основных метаболических показателей (углеводный обмен, липидный спектр сыворотки крови), а также ряда маркеров эндотелиальной дисфункции (sE-Seleсtin, sICAM-1, VEGF-A, VWF).
ICAM-1
Молекула межклеточной адгезии-1 (ICAM-1) является членом суперсемейства иммуноглобулинов (Ig) и имеет решающее значение для остановки миграции лейкоцитов из кровеносных сосудов в ткани. ICAM-1 конститутивно присутствует на эндотелиальных клетках, но его экспрессия увеличивается под действием провоспалительных цитокинов. Растворимая форма (sICAM-1) была измерена в различных жидкостях организма, при этом повышенные уровни наблюдались у пациентов с атеросклерозом, сердечной недостаточностью, заболеванием коронарных артерий и трансплантационной васкулопатией [16]. sE-Selectin и sICAM-1 часто используются в качестве биомаркеров системной активации эндотелия у пациентов с ишемической болезнью сердца, а также при СД2. Сывороточные уровни sVCAM-1, sICAM-1 и sE-Selectin были выше у пациентов с СД2, чем в контрольной группе здоровых пациентов; уровни sVCAM-1 в сыворотке были выше у пациентов с СД2 и ССЗ по сравнению с пациентами с СД2 без ССЗ. У больных СД2 с ССЗ наблюдались значимые положительные ассоциации между уровнями sVCAM-1, sICAM-1 и sE-Selectin [17–19].
VEGF-A
Сосудистый эндотелиальный фактор роста А (VEGF-A или VEGF) представляет собой высококонсервативный секретируемый сигнальный белок, наиболее известный своей ролью в ангиогенезе [20]. VEGF является членом семейства белков, включающего VEGF-B, VEGF-C, VEGF-D, VEGF-E и плацентарный фактор роста (PlGF). Хотя существует несколько родственных генов, основное внимание сосредоточено на VEGF-A из-за его ключевой роли в регуляции ангиогенеза. Опосредованные VEGF патогенные эффекты в первую очередь связаны с его влиянием на проницаемость сосудов и неоангиогенез (неоваскуляризацию) [21]. Взаимодействие между VEGF и его рецептором активирует остаток тирозина, находящегося в интрацитоплазматической части рецептора, и запускает различные сигнальные каскады в эндотелиальных клетках, такие как пролиферация, миграция и увеличение сосудистой проницаемости [22]. VEGF является ключевым фактором в поддержании нормальной функции эндотелия в физиологических условиях; однако высокие концентрации VEGF вызывают аномальный ангиогенез [23]. Гипергликемия при СД2 способствует избыточному образованию VEGF в сыворотке, таким образом, существует прямая связь между увеличением VEGF и уровнем HbA1c, что было показано в ряде исследований [24–27]. Клинические исследования у пациентов с СД установили ключевую роль VEGF в возникновении и прогрессировании диабетической ретинопатии (ДР): индуцированное диабетом повышение уровня VEGF считается биомаркером тяжести ДР. Это привело к разработке специфических антител против VEGF (анти-VEGF) для успешного интравитреального лечения пролиферативной ретинопатии и диабетического макулярного отека [28][29].
Фактор фон Виллебранда (VWF)
Фактор фон Виллебранда (VWF) — мультимерный гликопротеин, который необходим для тромбоцитарнозависимого первичного гемостаза. Высокомолекулярные мультимеры VWF циркулируют и связываются с коллагеном и тромбоцитами, помогая образовывать тромбы при особом взаимодействии с субэндотелиальными рецепторами, вызывая первичный гемостаз [30][31]. Дефицит VWF вызывает нарушение свертываемости крови, называемое болезнью фон Виллебранда, а повышение его концентрации в сыворотке крови связывают с заболеваниями, характеризующимися повышенным тромбообразованием (ССЗ, СД2) [32]. Предположено, что комплексный механизм, включающий прогрессирующее повреждение клеток эндотелия сосудов и хроническую гипергликемию на фоне повышения функции фактора VWF, способствует прогрессированию ССЗ при СД2. Предлагалось использование VWF в качестве гемостатического маркера эндотелиальной дисфункции для уточнения оценки сердечно-сосудистого риска и ожидаемой пользы от антитромботических средств [33][34].
Е-Selectin
Селектины представляют собой ключевое семейство молекул клеточной адгезии, которое включает селектины С-типа, Р-Selectin, хранящийся в тромбоцитах и эндотелиальных клетках, L-Selectin, представленный в лейкоцитах, и E-Selectin, экспрессируемый в эндотелии. Е-Selectin, L-Selectin и Р-Selectin также существуют в растворимых формах и могут быть измерены в крови для характеристики состояния эндотелия и тромбоцитов [35]. Е-Selectin представляет собой рецептор адгезии, участвующий в замедлении свертывания лейкоцитов, его экспрессия ограничена эндотелиальными клетками. В нестимулированных эндотелиальных клетках Е-Selectin не обнаруживается. Исследования in vitro показали, что экспрессия Е-Selectin быстро увеличивается и достигает максимального уровня примерно через 4–6 ч после воздействия воспалительных стимулов (например, ИЛ-1β. ФНО-α) с последующим быстрым снижением за счет расщепления и выделения Е-Selectin. Отщепление эктодомена Е-Selectin снижает плотность молекул адгезии на мембране и, как следствие, приводит к снижению адгезии лейкоцитов к сосудистой стенке [36].
Полученное в нашем исследовании повышение уровня sE-Selectin может являться ранним маркером эндотелиальной дисфункции у лиц с ожирением и СД2, однако для проверки данной гипотезы требуется большая выборка пациентов. Ранее было показано, что уровни изучаемых нами маркеров были повышены в группе пациентов с СД2 по сравнению с контрольной выборкой здоровых пациентов, однако сравнение с группой пациентов с ожирением не проводилось. Известно, что пациенты с СД2 имеют более высокий риск развития ССЗ [37], и, как было указано ранее, концентрация sE-Selectin увеличивается у пациентов с ССЗ [18], что может быть объяснением значимого повышения sE-Selectin в группе пациентов с ожирением и СД2 относительно группы пациентов с ожирением без СД2. C другой стороны, можно предположить, что sE-Selectin может быть использован как маркер — предиктор развития СД2 у пациентов с ожирением без нарушений углеводного обмена, так как, по данным метаанализа [38], повышенные уровни циркулирующих ICAM-1 и E-Selectin приводят к повышенному риску развития СД2.
Существуют данные об увеличении уровня sE-Selectin при неудовлетворительной компенсации углеводного обмена [39][40].
В нашем исследовании мы не получили значимых корреляций по всем исследуемым маркерам эндотелиальной дисфункции в зависимости от компенсации углеводного обмена. Дополнительно нами была проведена оценка эндотелиальных маркеров в подгруппе пациентов, принимающих препараты иНГЛТ-2 и/или арГПП-1. Известно, что многие представители групп иНГЛТ-2 и арГПП-1 способны улучшать сердечно-сосудистый прогноз за счет снижения смертности, а также частоты развития инфаркта миокарда и инсульта. В литературе имеются данные об улучшении эндотелиальной дисфункции при приеме кардиопротективных препаратов [41–43], однако в нашем исследовании значимых различий между группами пациентов, принимающих и не принимающих данные препараты, обнаружено не было, что могло быть обусловлено небольшой выборкой пациентов.
ЗАКЛЮЧЕНИЕ
Целью нашего исследования была сравнительная оценка маркеров эндотелиальной дисфункции в двух группах лиц c ожирением (без СД2 и с СД2), а также влияния приема кардиопротективных препаратов (арГПП-1 и иНГЛТ-2) на данные маркеры. Получено значимое повышение уровня sЕ-Selectin в группе пациентов с ожирением и СД2 по сравнению с лицами без нарушений углеводного обмена. Различий по уровню маркеров эндотелиальной дисфункции в подгруппах пациентов с СД2 и HbA1c ≤8% и >8% обнаружено не было. Также не отмечено влияния назначения антидиабетических кардиопротективных препаратов (иНГЛТ-2 и/или арГПП-1) на исследуемые показатели функции эндотелия у лиц с СД2. Мы предполагаем, что повышение уровня sЕ-Selectin может являться ранним маркером эндотелиальной дисфункции у лиц с ожирением и СД2, однако результаты требуют проверки на большей выборке.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено за счет гранта Российского научного фонда № 19-15-00361, https://rscf.ru/project/19-15-00361/.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Покровская Е.В. — концепция и дизайн работы, сбор и анализ материала, написание текста рукописи; Шестакова Е.А. — концепция и дизайн работы, анализ материала, редактирование текста рукописи; Шестакова М.В. — концепция и дизайн работы, редактирование текста рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Lin X, Li H. Obesity: epidemiology, pathophysiology, and therapeutics. Front Endocrinol (Lausanne). 2021;(12):147-154. doi: https://doi.org/10.3389/fendo.2021.706978
2. Leitner DR, Fruhbeck G, Yumuk V, et al. Obesity and type 2 diabetes: Two diseases with a need for combined treatment strategies — EASO can lead the way. Obes Facts. 2017;10(5):483-492. doi: https://doi.org/10.1159/000480525
3. Ma CX, Ma XN, Guan CH, et al. Cardiovascular disease in type 2 diabetes mellitus: progress toward personalized management. Cardiovasc Diabetol. 2022;21(1):74. doi: https://doi.org/10.1186/s12933-022-01516-6
4. La Sala L, Pontiroli AE. Prevention of diabetes and cardiovascular disease in obesity. Int J Mol Sci. 2020;21(21):8178. doi: https://doi.org/10.3390/ijms21218178
5. Bluher M. Metabolically healthy obesity. Endocr Rev. 2020;41(3):bnaa004. doi: https://doi.org/10.1210/endrev/bnaa004
6. Шестакова М.В., Шестакова Е.А., Скляник И.А., Стафеев Ю.С. Ожирение и сахарный диабет — всегда ли вместе? // Терапевтический архив. — 2022. — Т. 94. — №10. — С. 1131-1135. doi: https://doi.org/10.26442/00403660.2022.10.201880
7. Liu M, Wang P, Xie P, et al. Expression of ICAM-1 and E-selectin in different metabolic obesity phenotypes: discrepancy for endothelial dysfunction. J Endocrinol Invest. 2023;46(11):2379-2389. doi: https://doi.org/10.1007/s40618-023-02094-4
8. Mulhem A, Moulla Y, Kloting N, et al. Circulating cell adhesion molecules in metabolically healthy obesity. Int J Obes (Lond). 2021;45(2):331-336. doi: https://doi.org/10.1038/s41366-020-00667-4
9. Smith GI, Mittendorfer B, Klein S. Metabolically healthy obesity: facts and fantasies. J Clin Invest. 2019;129(10):3978-3989. doi: https://doi.org/10.1172/JCI129186
10. Coco C, Sgarra L, Potenza MA, et al. Can epigenetics of endothelial dysfunction represent the key to precision medicine in type 2 diabetes mellitus? Int J Mol Sci. 2019;20(12):2949. doi: https://doi.org/10.3390/ijms20122949
11. Montagnani M, Ravichandran LV., Chen H, et al. Insulin receptor substrate-1 and phosphoinositide-dependent kinase-1 are required for insulin-stimulated production of nitric oxide in endothelial cells. Mol Endocrinol. 2002;16(8):1931-1942. doi: https://doi.org/10.1210/me.2002-0074
12. Kwaifa IK, Bahari H, Yong YK, Noor SM. Endothelial dysfunction in obesity-induced inflammation: Molecular mechanisms and clinical implications. Biomolecules. 2020;10(2):291. doi: https://doi.org/10.3390/biom10020291
13. Herder C, Baumert J, Zierer A, et al. Immunological and cardiometabolic risk factors in the prediction of type 2 diabetes and coronary events: MONICA/KORA Augsburg case-cohort study. PLoS One. 2011;6(6):e19852. doi: https://doi.org/10.1371/journal.pone.0019852
14. Kaur R, Kaur M, Singh J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies. Cardiovasc Diabetol. 2018;17(1):121. doi: https://doi.org/10.1186/s12933-018-0763-3
15. Virdis A, Masi S, Colucci R, et al. Microvascular endothelial dysfunction in patients with obesity. Curr Hypertens Rep. 2019;21(4):32. doi: https://doi.org/10.1007/s11906-019-0930-2
16. Lawson C, Wolf S. ICAM-1 signaling in endothelial cells. Pharmacol Rep. 2009;61(1):22-32. doi: https://doi.org/10.1016/s1734-1140(09)70004-0
17. Khoshbin M, Ahmadi SAY, Cheraghi M, et al. Association of E-Selectin gene polymorphisms and serum E-Selectin level with risk of coronary artery disease in lur population of Iran. Arch Physiol Biochem. 2023;129(2):387-392. doi: https://doi.org/10.1080/13813455.2020.1828481
18. Zhang W-J, Cheng J-H, Nie Z-C, et al. Association of E-selectin gene +A561C polymorphism with type 2 diabetes in chinese population. Clin Lab. 2022;68(08/2022):32. doi: https://doi.org/10.7754/Clin.Lab.2021.211045
19. Hegazy GA, Awan Z, Hashem E, et al. Levels of soluble cell adhesion molecules in type 2 diabetes mellitus patients with macrovascular complications. J Int Med Res. 2020;48(4):030006051989385. doi: https://doi.org/10.1177/0300060519893858
20. Wiszniak S, Schwarz Q. Exploring the Intracrine Functions of VEGF-A. Biomolecules. 2021;11(1):128 doi: https://doi.org/10.3390/biom11010128
21. Apte RS, Chen DS, Ferrara N. VEGF in signaling and disease: Beyond discovery and development. Cell. 2019;176(6):1248-1264. doi: https://doi.org/10.1016/j.cell.2019.01.021
22. Guo S, Colbert LS, Fuller M, Zhang Y, Gonzalez-Perez RR. Vascular endothelial growth factor receptor-2 in breast cancer. Biochim Biophys Acta. 2010;1806(1):108-121. doi: https://doi.org/10.1016/j.bbcan.2010.04.004
23. Laakkonen JP, Lahteenvuo J, Jauhiainen S, et al. Beyond endothelial cells: Vascular endothelial growth factors in heart, vascular anomalies and placenta. Vascul Pharmacol. 2019;112(4):91-101. doi: https://doi.org/10.1016/j.vph.2018.10.005
24. Sun X, Zhang H, Liu J, Wang G. Serum vascular endothelial growth factor level is elevated in patients with impaired glucose tolerance and type 2 diabetes mellitus. J Int Med Res. 2019;47(11):5584-5592. doi: https://doi.org/10.1177/0300060519872033
25. Saukkonen T, Mutt SJ, Jokelainen J, et al. Adipokines and inflammatory markers in elderly subjects with high risk of type 2 diabetes and cardiovascular disease. Sci Rep. 2018;8(1):12816. doi: https://doi.org/10.1038/s41598-018-31144-8
26. Hanefeld M, Appelt D, Engelmann K, et al. Serum and plasma levels of vascular endothelial growth factors in relation to quality of glucose control, biomarkers of inflammation, and diabetic nephropathy [published correction appears in Horm Metab Res. 2016;48(9):620]. Horm Metab Res. 2016;48(8):529-534. doi: https://doi.org/10.1055/s-0042-106295
27. Hetland ML, Christensen IJ, Lottenburger T, et al. Circulating VEGF as a biological marker in patients with rheumatoid arthritis? Preanalytical and biological variability in healthy persons and in patients. Dis Markers. 2008;24(1):1-10. doi: https://doi.org/10.1155/2008/707864
28. Yang J, Liu Z. Mechanistic pathogenesis of endothelial dysfunction in diabetic nephropathy and retinopathy. Front Endocrinol (Lausanne). 2022;13(4):91-101. doi: https://doi.org/10.3389/fendo.2022.816400
29. Porta M, Striglia E. Intravitreal anti-VEGF agents and cardiovascular risk. Intern Emerg Med. 2020;15(2):199-210. doi: https://doi.org/10.1007/s11739-019-02253-7
30. Schneppenheim R. The pathophysiology of von Willebrand disease: therapeutic implications. Thromb Res. 2011;128(S1):S3-S7. doi: https://doi.org/10.1016/S0049-3848(12)70002-6
31. Alsharidah AS. Diabetes mellitus and diabetic nephropathy: a review of the literature on hemostatic changes in coagulation and thrombosis. Blood Res. 2022;57(2):101-105. doi: https://doi.org/10.5045/br.2022.2021204
32. Vischer UM. von Willebrand factor, endothelial dysfunction, and cardiovascular disease. J Thromb Haemost. 2006;4(6):1186-1193. doi: https://doi.org/10.1111/j.1538-7836.2006.01949.x
33. Meigs JB, O'donnell CJ, Tofler GH, et al. Hemostatic markers of endothelial dysfunction and risk of incident type 2 diabetes: the Framingham Offspring Study. Diabetes. 2006;55(2):530-537. doi: https://doi.org/10.2337/diabetes.55.02.06.db05-1041
34. Meigs JB, O'Donnell CJ, Tofler GH, et al. Hemostatic markers of endothelial dysfunction and risk of incident type 2 diabetes. Diabetes. 2006;55(2):530-537. doi: https://doi.org/10.2337/diabetes.55.02.06.db05-1041
35. Zinellu A, Mangoni AA. Systematic review and metaanalysis of the effect of statins on circulating E-selectin, L-selectin, and P-selectin. Biomedicines. 2021;9(11):1707. doi: https://doi.org/10.3390/biomedicines9111707
36. Milstone DS, O'Donnell PE, Stavrakis G, et al. et al. E-selectin expression and stimulation by inflammatory mediators are developmentally regulated during embryogenesis. Lab Invest. 2000;80(6):943-954. doi: https://doi.org/10.1038/labinvest.3780097
37. Kelsey MD, Nelson AJ, Green JB, et al. Guidelines for cardiovascular risk reduction in patients with type 2 diabetes: JACC guideline comparison. J Am Coll Cardiol. 2022;79(18):1849-1857. doi: https://doi.org/10.1016/j.jacc.2022.02.046
38. Qiu S, Cai X, Liu J, et al. Association between circulating cell adhesion molecules and risk of type 2 diabetes: A meta-analysis. Atherosclerosis. 2019;(287):147-154. doi: https://doi.org/10.1016/j.atherosclerosis.2019.06.908
39. Albertini JP, Valensi P, Lormeau B, et al. Elevated concentrations of soluble E-selectin and vascular cell adhesion molecule-1 in NIDDM. Effect of intensive insulin treatment. Diabetes Care. 1998;21(6):1008-1013. doi: https://doi.org/10.2337/diacare.21.6.1008
40. Palella E, Cimino R, Pullano SA, et al. Laboratory parameters of hemostasis, adhesion molecules, and inflammation in type 2 diabetes mellitus: Correlation with glycemic control. Int J Environ Res Public Health. 2020;17(1):300. doi: https://doi.org/10.3390/ijerph17010300
41. Yue W, Li Y, Ou D, Yang Q. The GLP-1 receptor agonist liraglutide protects against oxidized LDL-induced endothelial inflammation and dysfunction via KLF2. IUBMB Life. 2019;71(9):1347-1354. doi: https://doi.org/10.1002/iub.2046
42. Ma X, Liu Z, Ilyas I, et al. GLP-1 receptor agonists (GLP-1RAs): cardiovascular actions and therapeutic potential. Int J Biol Sci. 2021;17(8):2050-2068. doi: https://doi.org/10.7150/ijbs.59965
43. Wei R, Wang W, Pan Q, Guo L. Effects of SGLT-2 inhibitors on vascular endothelial function and arterial stiffness in subjects with type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Front Endocrinol (Lausanne). 2022;(13):147-154. doi: https://doi.org/10.3389/fendo.2022.826604
Об авторах
Е. В. ПокровскаяРоссия
Покровская Елена Владиславовна – научный сотрудник.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Е. А. Шестакова
Россия
Шестакова Екатерина Алексеевна - доктор медицинских наук, ведущий научный сотрудник.
Москва
Конфликт интересов:
Нет
М. В. Шестакова
Россия
Шестакова Марина Владимировна – доктор медицинских наук, профессор, академик РАН.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Механизмы дисфункции эндотелиальных клеток, связанные с воспалением (адаптировано из [12]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(239KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Покровская Е.В., Шестакова Е.А., Шестакова М.В. Эндотелиальная дисфункция у лиц с ожирением при наличии и отсутствии сахарного диабета 2 типа: оценка специфических маркеров. Сахарный диабет. 2023;26(5):439-445. https://doi.org/10.14341/DM13088
For citation:
Pokrovskaya E.V., Shestakova E.A., Shestakova M.V. Endothelial dysfunction in patients with obesity and type 2 diabetes mellitus or normoglycemia: assessment of specific markers. Diabetes mellitus. 2023;26(5):439-445. (In Russ.) https://doi.org/10.14341/DM13088

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































