Перейти к:
Роль канаглифлозина в профилактике инсульта и хронической болезни почек у пациентов с сахарным диабетом 2 типа: резолюция совета экспертов
https://doi.org/10.14341/DM13086
Аннотация
За последние 10 лет изучения осложнений сахарного диабета 2 типа (СД2) и способов борьбы с ними удалось добиться существенного прогресса по одному из наиболее важных направлений лечения — профилактике кардиоваскулярных и почечных осложнений. Так, при использовании ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) было доказано существенное снижение рисков сердечно-сосудистой смертности и прогрессирования хронической сердечной недостаточности, которые занимают основное место в структуре смертности в данной когорте пациентов, а также положительное влияние на диабетическую нефропатию, одно из наиболее часто встречаемых осложнений СД2. Тем не менее остаются и другие осложнения, существенно влияющие на продолжительность и качество жизни пациентов. В частности, к ним относятся инсульт, занимающий 2-3 место по частоте смерти людей с СД2, и альбуминурия — частное проявление диабетической болезни почек, которое ассоциируется с повышенными рисками возникновения сердечно-сосудистых осложнений (в том числе и инсульта) и хронической почечной недостаточности. Недавние исследования свидетельствуют о важной роли НГЛТ-1 в развитии указанных осложнений. Наибольшим сродством к данным транспортерам из зарегистрированных в РФ иНГЛТ-2 обладает канаглифлозин. Настоящая статья призвана оценить механизмы действия канаглифлозина и его возможную роль в предотвращении развития инсульта и альбуминурии.
Ключевые слова
Для цитирования:
Шестакова М.В., Галстян Г.Р., Гринева Е.Н., Зилов А.В., Демидова Т.Ю., Мкртумян А.М., Петунина Н.А., Руяткина Л.А., Сухарева О.Ю., Суплотова Л.А., Шамхалова М.Ш. Роль канаглифлозина в профилактике инсульта и хронической болезни почек у пациентов с сахарным диабетом 2 типа: резолюция совета экспертов. Сахарный диабет. 2023;26(5):484-491. https://doi.org/10.14341/DM13086
For citation:
Shestakova M.V., Galstyan G.R., Grineva E.N., Zilov A.V., Demidova T.Yu., Mkrtumyan A.M., Petunina N.A., Ruyatkina L.A., Sukhareva O.Y., Suplotova L.A., Shamkhalova M.S. The role of canagliflozin in the prevention of stroke and chronic kidney disease in patients with type 2 diabetes mellitus: an expert council resolution. Diabetes mellitus. 2023;26(5):484-491. (In Russ.) https://doi.org/10.14341/DM13086
ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) являются лидирующей причиной смертности и инвалидности при сахарном диабете 2 типа (СД2) [1][2]. В последние годы удалось достичь существенного прогресса в понимании подходов к профилактике кардиоваскулярных осложнений СД2 благодаря появлению ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2). В ходе исследований прием данных препаратов сопровождался более низкой частотой общей смерти и смерти от сердечно-сосудистых причин, госпитализации по поводу хронической сердечной недостаточности, а также прогрессирования хронической болезни почек (ХБП) [3][4].
Однако, помимо вышеупомянутых состояний, существуют и другие научные проблемы осложнений СД2, требующие тщательного изучения и поиска решений. В настоящей статье мы рассмотрим влияние представителя иНГЛТ-2 канаглифлозина на риски развития инсульта и на состояние почечного фильтрационного аппарата, особенности действия препарата, данные об его эффективности и перспективы применения в клинической практике.
РОЛЬ КАНАГЛИФЛОЗИНА В ПРОФИЛАКТИКЕ ИНСУЛЬТА
Острое нарушение мозгового кровообращения (ОНМК) является третьей по частоте встречаемости причиной смерти у пациентов с СД2 [2]. К сожалению, указанная тенденция сохраняется и у молодых представителей данной когорты (в возрасте 40–59 лет) [5]. Наличие СД2 удваивает вероятность возникновения инсульта, поэтому является одним из основных факторов риска ОНМК [6][7]. Через 3–6 мес после инсульта когнитивные функции пациентов с СД2 оказываются ниже, чем при нормогликемии [7]. По данным post hoc анализа исследования POINT (Platelet Oriented Inhibition in New TIA and Minor Ischemic Stroke), СД2 увеличивает на 50% вероятность повторного ОНМК, на которую статистически значимо не влияет назначение двойной антиагрегантной терапии [8]. Инсульт — лидирующая причина инвалидности населения: почти каждый третий пациент после инсульта нуждается в посторонней помощи, каждый пятый — не может самостоятельно ходить [9]. Только 8% человек, перенесших ОНМК, смогли вернуться к прежней работе [9]. Вплоть до 54% случаев инсульта приводят к ухудшению отношений пациента с родственниками [10].
ОНМК при СД2 протекает по ишемическому (77,5% случаев) и геморрагическому (8,5%) типу [11].
Впервые положительное влияние канаглифлозина на основные сердечно-сосудистые неблагоприятные исходы (MACE) было продемонстрировано в рандомизированном контролируемом исследовании (РКИ) CANVAS (The CANagliflozin cardioVascular Assessment Study) [12]. В нем участвовали 10 142 пациента с СД2 и исходным уровнем гликированного гемоглобина (HbA1c) в пределах ≥7,0% и ≤10,5%. В исследование набирали участников с расчетной скоростью клубочковой фильтрации (рСКФ) ≥30 мл/мин/1,73 м² в возрасте ≥30 лет (при наличии атеросклеротического ССЗ) либо ≥50 лет при наличии ≥2 факторов риска развития ССЗ (длительность СД2 ≥10 лет, курение, микро- или макроальбуминурия, холестерин липопротеинов высокой плотности <1 ммоль/л или систолическое артериальное давление >140 мм рт.ст., несмотря на прием ≥1 антигипертензивного средства). На момент включения у 65% из них имелись ССЗ, у остальных — факторы риска развития ССЗ. В основной ветви исследования пациенты были рандомизированы в группы получения канаглифлозина 300 мг в сутки, 100 мг в сутки и плацебо в соотношении 1:1:1. В почечной «ветви» исследования CANVAS-R (CANVAS-Renal) рандомизация проводилась в группы плацебо и канаглифлозина 100 мг в сутки (1:1) с возможностью повышения дозы до 300 мг в сутки.
За период наблюдения (3,6 года в среднем) в группе канаглифлозина частота наступления MACE (включающей совокупность таких событий, как смерть от сердечно-сосудистых причин, нефатальный инфаркт миокарда или нефатальный инсульт) была ниже на 14% по сравнению с плацебо (р=0,02). Стоит отметить, что по каждому из компонентов МАСЕ наблюдалась тенденция к снижению риска возникновения, в том числе, и нефатального инсульта.
Последующее крупное РКИ с участием канаглифлозина было названо CREDENCE (The Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation trial) [13]. В него был включен 4401 пациент с СД2, с рСКФ >30 мл/мин/1,73 м² и исходным альбумин-креатининовым соотношением (АКС) в разовой порции мочи в пределах от >300 до ≤5000 мг/г. Участники прошли рандомизацию в группы получения канаглифлозина 100 мг/сут и плацебо в соотношении 1:1. В конце исследования, в среднем через 2,62 года, у принимающих канаглифлозин риск наступления MACE (смерть от сердечно-сосудистых причин, или нефатальный инфаркт миокарда, или нефатальный инсульт) был на 20% меньше, чем в группе контроля (р=0,01). Post hoc анализ CREDENCE помог уточнить, что канаглифлозин способствовал снижению риска наступления первичного сердечно-сосудистого осложнения (смерть от сердечно-сосудистых причин, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализация по поводу хронической сердечной недостаточности или нестабильной стенокардии) на 27% (р<0,001) и подобных событий в целом — на 29% (р<0,001) [14]. Изучение объединенных данных CANVAS и CREDENCE подтвердило позитивный сердечно-сосудистый эффект, который был сопоставимым при первичной и вторичной профилактике [15].
Байесовский метаанализ 53 РКИ показал, что только у канаглифлозина по сравнению с другими представителями класса иНГЛТ-2 имеются доказательства снижения риска инсульта (на 29%) [16]. В другом метаанализе пяти РКИ влияние канаглифлозина на риски развития инсульта подтвердилось только для геморрагического подтипа ОНМК — вероятность его возникновения снижалась на 57% (р=0,027) [17]. Стоит отметить, что в данном метаанализе дапаглифлозин и эмпаглифлозин не влияли на риски возникновения геморрагического ОНМК, а также при их использовании наблюдалась тенденция к более частому выявлению ишемического инсульта: отношение рисков составило 1,01 и 1,19 соответственно по сравнению с 0,89–0,96 в исследованиях канаглифлозина. В метаанализе Qiu M. и соавт., включившем 10 РКИ, у канаглифлозина был обнаружен наибольший показатель SUCRA1 в отношении риска инсульта по сравнению с другими иНГЛТ-2 [18].
Подобные данные, указывающие на возможное преимущество канаглифлозина перед другими иНГЛТ-2 в отношении профилактики инсульта, могут быть обусловлены отличиями в фармакологическом действии препарата. Канаглифлозин обладает низкой селективностью к натрий-глюкозному котранспортеру 2 типа (НГЛТ-2) — всего в 260 раз более сильное сродство, чем к натрий-глюкозному котранспортеру 1 типа (НГЛТ-1) [19]. В то же время другие обладают большей селективностью к НГЛТ-2 по сравнению с НГЛТ-1 (дапаглифлозин — 1200:1, эмпаглифлозин — 2500:1, эртуглифлозин — 2250:1) [19].
Данный феномен может объяснить результаты исследований по профилактике ОНМК при приеме канаглифлозина. В головном мозге НГЛТ представлены в основном транспортерами 1 типа, а роль НГЛТ-2 незначительна (рис. 1) [20].
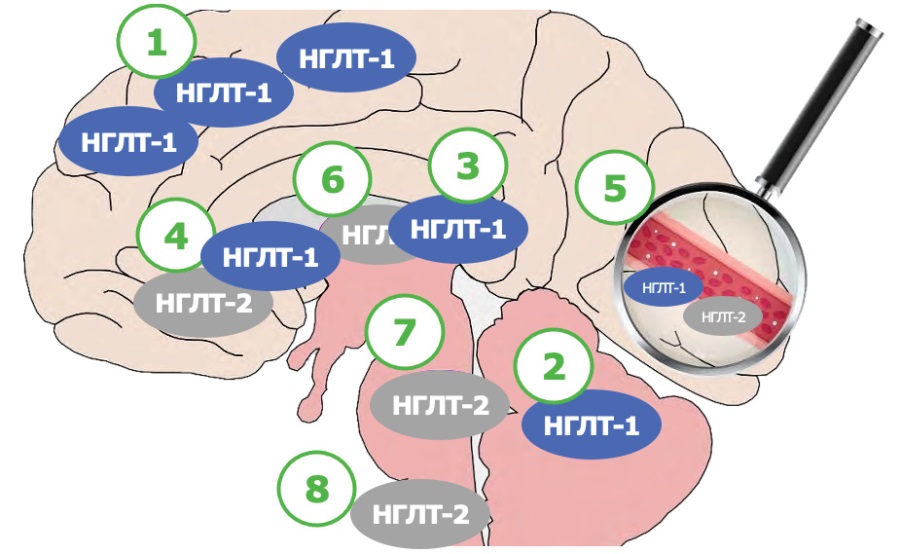
Рисунок 1. Распределение натрий-глюкозных котранспортеров 1 и 2 типа
в различных отделах головного мозга
(по Pawlos A. и соавт., 2021 г., с адаптацией) [21].
Обозначения: НГЛТ — натрий-глюкозный котранспортер;
1 — пирамидные клетки коры головного мозга;
2 — клетки Пуркинье мозжечка;
3 — пирамидальные и зернистые клетки гиппокампа;
4 — гипоталамус;
5 — микрососуды;
6 — миндалевидное тело;
7 — периакведуктальное серое вещество;
8 — дорсомедиальный мозг — ядро солитарного пути.
НГЛТ-1 участвуют в котранспорте глюкозы и натрия, а также кальция в нервную ткань, высвобождении нейротрансмиттеров, ишемическом повреждении [20]. При ОНМК при участии НГЛТ-1 в очаг повреждения с одной молекулой глюкозы транспортируется 2 иона Na+ (в отличие от НГЛТ-2, который котранспортирует глюкозу и Na+ в соотношении 1:1) [21]. Таким образом, в очаге повреждения происходит выраженный приток Na+ через НГЛТ-1, что усиливает реперфузионное/ишемическое повреждение, увеличивает размер отека, воспаления, очага поражения, сопровождающиеся гибелью нейронов и ухудшением когнитивных функций [21]. Напротив, ингибирование НГЛТ-1 ограничивает размеры очага повреждения, гибель нейронов, что способствует большей сохранности когнитивной функции [21].
Результаты исследований подтверждают важность ингибирования НГЛТ-1 при профилактике инсульта. В метаанализе 6 РКИ риск инсульта достоверно снижался при использовании ингибиторов с клинически значимым сродством к НГЛТ-1 (канаглифлозина, сотаглифлозина) — на 26%, в то время как селективные иНГЛТ-2 не оказывали влияния на вероятность возникновения ОНМК [22]. В этом же исследовании была обнаружена прямая взаимосвязь между степенью селективности к НГЛТ-2 и риском развития фатального и нефатального инсульта (р=0,011).
С учетом того, что основной вклад в смертность пациентов с СД2 от ОНМК вносит ишемический тип ОНМК, следует обратиться к патогенезу его развития при метаболическом синдроме (рис. 2).

Рисунок 2. Схема патогенеза ишемического инсульта при сахарном диабете
(по Mosenzon O. и соавт., 2023 г., с изменениями) [7].
Примечание: звездочкой выделены звенья патогенеза,
на которые воздействует канаглифлозин.
Канаглифлозин влияет на большинство патогенетических факторов развития ишемического инсульта при СД2:
- осуществляет эффективный контроль гликемии [23];
- способствует снижению массы тела, в том числе за счет висцерального жира [24];
- дозозависимо и достоверно снижает артериальное давление (АД) [25][26];
- снижает уровень холестерина липопротеидов низкой плотности, повышает уровень холестерина липопротеидов высокой плотности, уменьшает накопление липидов в атеросклеротических бляшках и сдерживает их рост, улучшает функцию эндотелия аорты — оказывает атеропротективное действие [27–29];
- уменьшает жесткость артерий независимо от антигипертензивного действия [25][30];
- снижает эндотелиальное воспаление через аденозинмонофосфат-активируемую киназу и другие механизмы [28][31].
Кроме того, вторичный анализ CANVAS и CREDENCE продемонстрировал возможное снижение частоты впервые возникших фибрилляции или трепетания предсердий (ФП/ТП) на 24%, и на 26% — их осложнений [32].
Мнение экспертов
В Федеральных клинических рекомендациях «Ишемический инсульт и транзиторная ишемическая атака у взрослых» 2021 г. указано следующее: «рекомендуется профилактика и лечение сахарного диабета (СД), так как это заболевание независимо увеличивает риск ишемического инсульта в 1,8–6 раз. Коррекцию уровня глюкозы крови рекомендуется осуществлять изменением образа жизни и назначением индивидуальной фармакотерапии» [9]. Помимо этого, для первичной профилактики ОНМК необходим контроль артериальной гипертензии, коррекция дислипидемии, нормализация массы тела [9].
Таким образом, эксперты констатируют, что канаглифлозин имеет преимущества перед другими селективными иНГЛТ-2 в отношении первичной и вторичной профилактики ишемических инсультов. Во-первых, в РКИ и метаанализах было отмечено его положительное влияние на MACE, и в том числе ОНМК. Во-вторых, по сравнению с более высокоселективными иНГЛТ-2 преимуществом канаглифлозина является его большее сродство к НГЛТ-1 и более выраженный контроль факторов риска инсульта — углеводного обмена, массы тела и АД, а также предпосылки к снижению риска ФП/ТП [33][34]. В медицинской инструкции по применению лекарственного препарата канаглифлозин для пациентов с СД2 и диагностированным ССЗ зарегистрировано показание о ¬применении «с целью снижения риска серьезных неблагоприятных осложнений со стороны сердечно-сосудистой системы (сердечно-сосудистой смерти, нефатального инфаркта миокарда и нефатального инсульта)» [35].
ВЛИЯНИЕ КАНАГЛИФЛОЗИНА НА ХРОНИЧЕСКУЮ БОЛЕЗНЬ ПОЧЕК
ХБП является прогрессирующим состоянием, которое поражает колоссальное количество людей — более 800 млн человек на планете, что составляет около 10% населения Земли [36]. Согласно исследованию CaReMe, СД вносит основной вклад (до 38%) в развитие данной патологии [37]. Примечательно, что у почти у трети участников диагноз ХБП определялся по уровню альбуминурии при сохранной рСКФ [37].
Альбуминурии в последнее время уделяется пристальное внимание исследователей. Это связано с несколькими причинами. Во-первых, при нормальной рСКФ наличие альбуминурии категории А2 (АКС в разовой порции мочи 30–300 мг/г по риску развития сердечно-сосудистых осложнений и терминальной почечной недостаточности сопоставимо со стадией ХБП С3а А1 по KDIGO (Инициатива по улучшению глобальных исходов заболеваний почек)), а альбуминурии категории А3 (АКС>300 мг/г) — с ХБП стадии С3б А1 [38]. Степень альбуминурии прямо коррелирует с повышением риска смерти от сердечно-сосудистых причин, риска развития ишемической болезни сердца, инсульта, хронической сердечной недостаточности [39]. Определение данной связи важно, поскольку ССЗ становятся причиной смерти у 52% пациентов с СД2 [2]. Во-вторых, при естественном развитии диабетической болезни почек альбуминурия появляется еще до снижения рСКФ менее 60 мл/мин/1,73 м² [40]. Обнаружение повышенной концентрации альбумина в моче означает нарушение селективности фильтрационного барьера из-за утраты эндотелиальных фенестр и подоцитов почечных клубочков — механизма повреждения почек при СД [41][42].
Таким образом, возникает практическая необходимость определения и контроля альбуминурии с учетом ее ценности как раннего маркера ХБП и маркера сердечно-сосудистых осложнений.
Положительное влияние канаглифлозина на профилактику развития патологической альбуминурии удалось продемонстрировать в исследовании CANVAS [12]. За период наблюдения у принимающих канаглифлозин риск прогрессирования альбуминурии (увеличение альбуминурии на 30% и переход ее в более тяжелую категорию) снижался на 27% (р=0,0184), что может свидетельствовать о нефропротективном эффекте препарата. Кроме того, в группе канаглифлозина регресс альбуминурии (использовались критерии, сопоставимые с таковыми для прогрессирования альбуминурии) наблюдался на 70% чаще по сравнению с плацебо.
Следующим крупным рандомизированным клиническим исследованием (РКИ), в котором оценивалось влияние канаглифлозина на прогрессирование ХБП, стало CREDENCE [13]. За средний период наблюдения 2,62 года в группе канаглифлозина средний уровень альбуминурии оказался на 31% меньше, чем в контрольной группе, причем существенная положительная динамика наблюдалась уже через 6 мес лечения.
Результаты, полученные в CANVAS и CREDENCE, наводят на определенные умозаключения. Если в CANVAS у 70% пациентов удалось добиться перехода альбуминурии в более легкую категорию, то в CREDENCE, несмотря на выраженное снижение степени потери альбумина с мочой, среднее АКС в группе канаглифлозина осталось в пределах 500–600 мг/г к концу исследования. Это может означать, что у существенной части пациентов данной когорты сохранилась исходная категория альбуминурии А2. Чем может быть вызвана подобная разница в результатах? Исходно в CANVAS средняя рСКФ составила 76,5 мл/мин/1,73 м² и медиана АКС — 12,3 мг/г (только у 17,5% пациентов, включенных в исследование, была нефропатия), в то время как в CREDENCE у участников исходно средняя рСКФ — 56 мл/мин/1,73 м² (у 60% рСКФ была ниже 60 мл/мин/1,73 м²), АКС — 927 мг/г. Таким образом, в первом исследовании предполагается у участников более сохранный исходный почечный функциональный резерв (ПФР). Учитывая способность иНГЛТ-2 уменьшать гиперфильтрацию и тем самым предотвращать повреждение гломерулярного аппарата, можно предположить, что назначение иНГЛТ-2 у пациентов с сохранным ПФР (при отсутствии ХБП или на самых ранних ее стадиях, как в CANVAS) может в большей степени снизить риски развития и прогрессирования диабетической болезни почек, чем при более выраженной ХБП (как в CREDENCE), когда предполагается сниженный ПФР [43][44]. Косвенно данный тезис подтверждают расчеты, при которых ранняя диагностика ХБП и назначение иНГЛТ-2 на ее ранних стадиях (при рСКФ 70 мл/мин/1,73 м² и более) позволяют отсрочить наступление терминальной почечной недостаточности на 11 лет, в то время как позднее назначение (при рСКФ 30 мл/мин/1,73 м²) — всего на 3 года [45]. В другом гипотетическом расчете, основанном на данных участников CREDENCE, назначение канаглифлозина пациентам с СД2 со средним возрастом 63 года, рСКФ 56 мл/мин/1,73 м² и альбуминурией А3 позволяет получить почти 13 дополнительных лет без диализа, в отличие от группы плацебо (22,85 года до диализа в группе канаглифлозина против 9,9 года в группе плацебо) (рис. 3) [46].
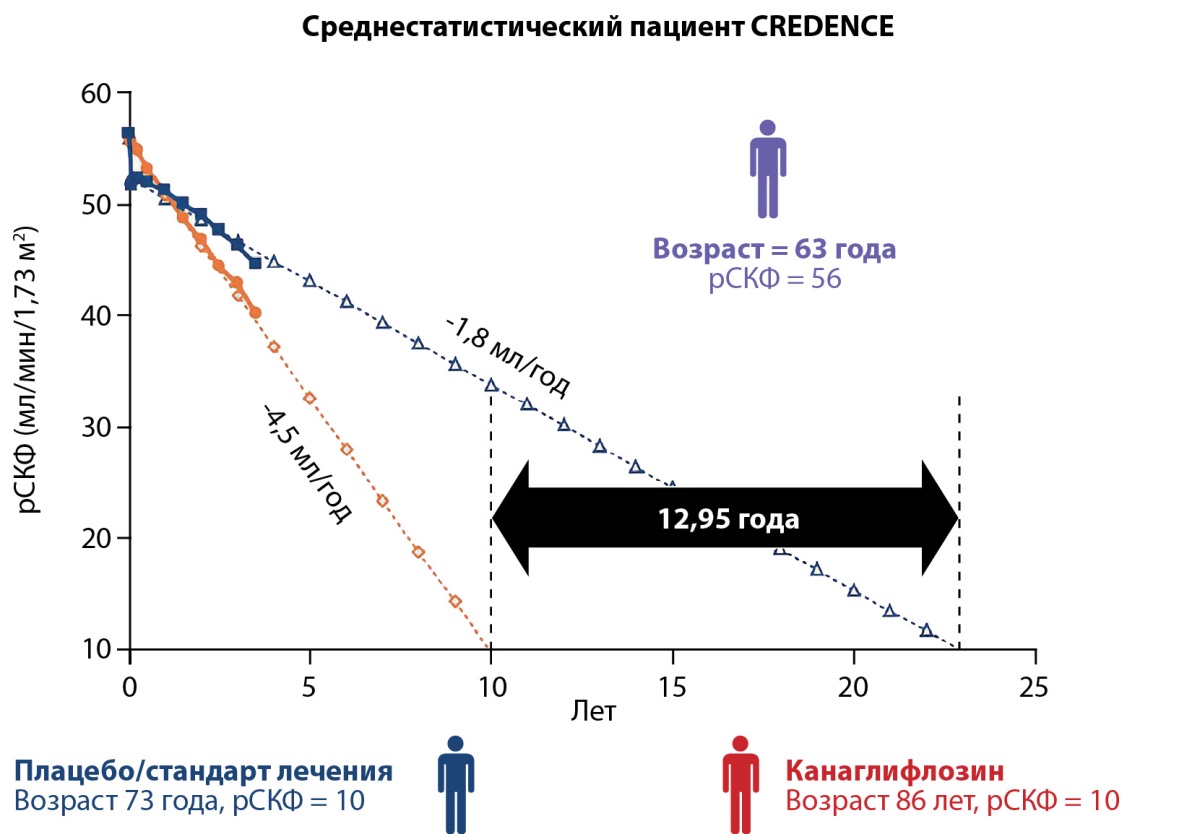
Рисунок 3. Изменение расчетной скорости клубочковой фильтрации
во времени у пациентов в группе канаглифлозина и плацебо
из исследования CREDENCE
(по Durkin M., Blais J., 2020 г., с адаптацией) [46].
Примечание: рСКФ — расчетная скорость клубочковой фильтрации.
С другой стороны, стоит отметить, что в CREDENCE пациенты получали 100 мг канаглифлозина, в то время как в CANVAS-R у 71,4% пациентов доза была увеличена со 100 до 300 мг в ходе исследования, что также могло повлиять на разницу во влиянии канаглифлозина на альбуминурию в этих исследованиях.
Мнение экспертов
Всем пациентам с впервые выявленным СД2 с целью своевременной диагностики показан скрининг с расчетом рСКФ и измерением АКС в разовой порции мочи и далее — не реже 1 раза в год [38].
Вне зависимости от наличия ХБП канаглифлозин влияет на факторы риска прогрессирования ХБП — осуществляет эффективный углеводный контроль при СД2, способствует снижению АД, улучшению липидного профиля, уменьшению веса и альбуминурии (доказательства данных эффектов были приведены выше) [47]. Важно отметить, что при блокировании НГЛТ-2 в ¬проксимальных почечных канальцах увеличивается концентрация глюкозы в macula densa [48]. Из-за этого увеличивается активность почечных НГЛТ-1, приводящая к избыточной секреции NO в области macula densa, вазодилатации и гиперфильтрации [48]. Большее сродство к НГЛТ-1 по сравнению с другими зарегистрированными в РФ иНГЛТ-2 может быть преимуществом канаглифлозина, так как блокада 1 и 2 типа НГЛТ в почках может в большей степени подавлять гиперфильтрацию, которая является одним из ключевых патогенетических звеньев диабетической болезни почек.
С учетом возможностей профилактики ХБП, назначение иНГЛТ-2, в том числе канаглифлозина, может быть оправдано с момента постановки диагноза «СД2» и особенно целесообразно пациентам с факторами риска ССЗ и ХБП (пожилой возраст, женский пол, ожирение, гипертоническая болезнь, , этнические, расовые меньшинства и др.).
Поскольку первая часть настоящей статьи была посвящена профилактике ОНМК, нельзя не отметить, что альбуминурия в рамках ХБП ассоциируется с повышенным риском инсульта из-за схожих этиологических факторов (гипергликемии, артериальной гипертензии), повышения концентрации нейротоксических веществ при уремии и рисков развития фибрилляции предсердий, тромботических событий [49]. Пациенты с ХБП имеют высокий риск как тромбоэмболии, так и кровотечения. Кроме того, в этой ситуации могут иметь место измененная реакция на антитромбоцитарные препараты и усиление геморрагических осложнений при антитромботической терапии [49]. Таким образом, назначение канаглифлозина при альбуминурии (важнейшем компоненте ХБП) может способствовать не только регрессу диабетической нефропатии, но и дополнительной профилактике ОНМК.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о церебро-, нефро-, атеро- и кардиопротективном действиях канаглифлозина. Реализация этих эффектов, по-видимому, осуществляется благодаря ко-ингибированию НГЛТ 1 и 2 типа, а также влиянию на ключевые факторы риска развития ОНМК и альбуминурии. Рассмотренные исследования демонстрируют благоприятное влияние канаглифлозина на состояние головного мозга и почек уже на этапе первичной профилактики, что позволяет задуматься о ранней инициации лечения пациентов с СД2. Следует придерживаться стандартов обследования при СД2 для своевременного выявления осложнений и их факторов риска.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Совет экспертов, результаты которого легли в основу этой статьи, проводился при поддержке ООО «Мерк».
Конфликт интересов. Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Участие авторов. Шестакова М.В. — концепция, редактирование и финальное утверждение рукописи; Галстян Г.Р., Гринёва Е.Н., Зилов А.В., Демидова Т.Ю., Мкртумян А.М., Петунина Н.А., Руяткина Л.А., Суплотова, Л.А., Шамхалова М.Ш. — написание, редактирование и финальное утверждение рукописи. Все авторы внесли значимый вклад в написание рукописи и подготовку к печати.
1. SUCRA (кумулятивная кривая распределения) — показатель, выявляющий метод лечения, который превосходит по каким-либо исходам наибольшее число конкурирующих методов лечения.
Список литературы
1. Gregg EW, Menke A. Diabetes and Disability. In: Diabetes in America 3rd edition. National Institute of Diabetes and Digestive and Kidney Diseases (US); 2018.
2. Дедов И.И., Шестакова М.В., Викулова О.К. и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021 // Сахарный диабет. — 2021. — Т. 24. — №3. — С. 204-221. doi: https://doi.org/10.14341/DM12759
3. Yau K, Dharia A, Alrowiyti I, et al. Prescribing SGLT2 Inhibitors in patients with CKD: Expanding indications and practical considerations. Kidney Int Rep. 2022;7(7):1463-1476. doi: https://doi.org/10.1016/j.ekir.2022.04.094
4. Cardoso R, Graffunder FP, Ternes CMP, et al. SGLT2 inhibitors decrease cardiovascular death and heart failure hospitalizations in patients with heart failure: A systematic review and meta-analysis. EClinicalMedicine. 2021;(36):100933. doi: https://doi.org/10.1016/j.eclinm.2021.100933
5. Данные Федерального регистра сахарного диабета Московской области [дата обращения: 01.07.2023].
6. Khan MM, Roberson S, Reid K, et al. Prevalence and predictors of stroke among individuals with prediabetes and diabetes in Florida. BMC Public Health. 2022;22(1):243. doi: https://doi.org/10.1186/s12889-022-12666-3
7. Mosenzon O, Cheng AY, Rabinstein AA, et al. Diabetes and stroke: What are the connections? J Stroke. 2023;25(1):26-38. doi: https://doi.org/10.5853/jos.2022.02306
8. Mac Grory B, Piccini JP, Yaghi S, et al. Hyperglycemia, risk of subsequent stroke, and efficacy of dual antiplatelet therapy: A post hoc analysis of the POINT trial. J Am Heart Assoc. 2022;11(3):e023223. doi: https://doi.org/10.1161/JAHA.121.023223
9. Всероссийское общество неврологов. [Электронный ресурс]. Клинические рекомендации «Ишемический инсульт и транзиторная ишемическая атака у взрослых» 2021. Доступно по: https://cr.minzdrav.gov.ru/recomend/171_2. Ссылка активна на 24.07.2023.
10. Daniel K, Wolfe CDA, Busch MA, et al. What Are the Social Consequences of Stroke for Working-Aged Adults? Stroke. 2009;40(6):e431-440. doi: https://doi.org/10.1161/STROKEAHA.108.534487
11. Megherbi S-E, Milan C, Minier D, et al. Association between diabetes and stroke subtype on survival and functional outcome 3 months after stroke: data from the European BIOMED Stroke Project. Stroke. 2003;34(3):688-694. doi: https://doi.org/10.1161/01.STR.0000057975.15221.40
12. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017;377(7):644-657. doi: https://doi.org/10.1056/NEJMoa1611925
13. Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019;380(24):2295-2306. doi: https://doi.org/10.1056/NEJMoa1811744
14. Li J-W, Arnott C, Heerspink HJL, et al. Effect of canagliflozin on total cardiovascular burden in patients with diabetes and chronic Kidney disease: A post hoc analysis from the CREDENCE trial. J Am Heart Assoc. 2022;11(16):e025045. doi: https://doi.org/10.1161/JAHA.121.025045
15. Ang F, Rapattoni W, Bajaj HS, et al. Effects of canagliflozin on cardiovascular and kidney outcomes and mortality in primary and secondary cardiovascular prevention: pooled analysis from the CANVAS program and CREDENCE trial. Eur Heart J. 2022;43(S2):2295-2306. doi: https://doi.org/10.1093/eurheartj/ehac544.2324
16. Odutayo A, da Costa BR, Pereira TV., et al. Sodium-glucose cotransporter 2 inhibitors, all-cause mortality, and cardiovascular outcomes in adults with type 2 diabetes: A bayesian meta-analysis and meta-regression. J Am Heart Assoc. 2021;10(18):2295-2306. doi: https://doi.org/10.1161/JAHA.120.019918
17. Tsai W-H, Chuang S-M, Liu S-C, et al. Effects of SGLT2 inhibitors on stroke and its subtypes in patients with type 2 diabetes: a systematic review and meta-analysis. Sci Rep. 2021;11(1):15364. doi: https://doi.org/10.1038/s41598-021-94945-4
18. Qiu M, Ding L-L, Zhou H-R. Comparative efficacy of five SGLT2i on cardiorenal events: A network meta-analysis based on ten CVOTs. Am J Cardiovasc Drugs. 2022;22(1):69-81. doi: https://doi.org/10.1007/s40256-021-00484-8
19. Zeng Q, Zhou Q, Liu W, et al. Mechanisms and Perspectives of Sodium-Glucose Co-transporter 2 Inhibitors in Heart Failure. Front Cardiovasc Med. 2021;8(18):2295-2306. doi: https://doi.org/10.3389/fcvm.2021.636152
20. Koepsell H. Glucose transporters in brain in health and disease. Pflugers Arch. 2020;472(9):1299-1343. doi: https://doi.org/10.1007/s00424-020-02441-x
21. Pawlos A, Broncel M, Wozniak E, et al. Neuroprotective effect of SGLT2 inhibitors. Molecules. 2021;26(23):7213. doi: https://doi.org/10.3390/molecules26237213
22. Sayour AA, Olah A, Ruppert M, et al. Pharmacological selectivity of SGLT2 inhibitors and cardiovascular outcomes in patients with type 2 diabetes: a meta-analysis. Eur Heart J. 2022;43(S2):2295-2306. doi: https://doi.org/10.1093/eurheartj/ehac544.2688
23. Meng Q, Shen Y, Liu D, et al. Efficacy of canagliflozin combined with antidiabetic drugs in treating type 2 diabetes mellitus: Meta-analysis of randomized control trials. J Diabetes Investig. 2016;7(3):359-365. doi: https://doi.org/10.1111/jdi.12417
24. Cefalu WT, Leiter LA, Yoon K-H, et al. Efficacy and safety of canagliflozin versus glimepiride in patients with type 2 diabetes inadequately controlled with metformin (CANTATA-SU): 52 week results from a randomised, double-blind, phase 3 non-inferiority trial. Lancet. 2013;382(9896):941-950. doi: https://doi.org/10.1016/S0140-6736(13)60683-2
25. Pfeifer M, Townsend RR, Davies MJ, et al. Effects of canagliflozin, a sodium glucose co-transporter 2 inhibitor, on blood pressure and markers of arterial stiffness in patients with type 2 diabetes mellitus: a post hoc analysis. Cardiovasc Diabetol. 2017;16(1):29. doi: https://doi.org/10.1186/s12933-017-0511-0
26. Geng Q, Hou F, Zhang Y, et al. Effects of different doses of canagliflozin on blood pressure and lipids in patients with type 2 diabetes: a meta-analysis. J Hypertens. 2022;40(5):996-1001. doi: https://doi.org/10.1097/HJH.0000000000003106
27. Zuo Q, Zhang G, He L, et al. Canagliflozin attenuates hepatic steatosis and atherosclerosis progression in Western Diet-Fed ApoE-Knockout Mice. Drug Des Devel Ther. 2022;(16):4161-4177. doi: https://doi.org/10.2147/DDDT.S388823
28. Nasiri-Ansari N, Dimitriadis GK, Agrogiannis G, et al. Canagliflozin attenuates the progression of atherosclerosis and inflammation process in APOE knockout mice. Cardiovasc Diabetol. 2018;17(1):106. doi: https://doi.org/10.1186/s12933-018-0749-1
29. Yaribeygi H, Maleki M, Reiner 2, et al. Mechanistic view on the effects of SGLT2 inhibitors on lipid metabolism in diabetic milieu. J Clin Med. 2022;11(21):6544. doi: https://doi.org/10.3390/jcm11216544
30. Ramirez AJ, Sanchez MJ, Sanchez RA. Diabetic patients with essential hypertension treated with amlodipine: blood pressure and arterial stiffness effects of canagliflozin or perindopril. J Hypertens. 2019;37(3):636-642. doi: https://doi.org/10.1097/HJH.0000000000001907
31. Uthman L, Kuschma M, Romer G, et al. Novel anti-inflammatory effects of canagliflozin involving Hexokinase II in lipopolysaccharide-stimulated human coronary artery endothelial cells. Cardiovasc Drugs Ther. 2021;35(6):1083-1094. doi: https://doi.org/10.1007/s10557-020-07083-w
32. Li C, Yu J, Hockham C, et al. Canagliflozin and atrial fibrillation in type 2 diabetes mellitus: A secondary analysis from the CANVAS Program and CREDENCE trial and meta-analysis. Diabetes Obes Metab. 2022;24(10):1927-1938. doi: https://doi.org/10.1111/dom.14772
33. Pinto LC, Rados DV, Remonti LR, et al. Dose-ranging effects of SGLT2 inhibitors in patients with type 2 diabetes: a systematic review and meta-analysis. Arch Endocrinol Metab. 2022;66(1):68-76. doi: https://doi.org/10.20945/2359-3997000000440
34. Zaccardi F, Webb DR, Htike ZZ, et al. Efficacy and safety of sodiumglucose co-transporter-2 inhibitors in type 2 diabetes mellitus: systematic review and network meta-analysis. Diabetes Obes Metab. 2016;18(8):783-794. doi: https://doi.org/10.1111/dom.12670
35. Инструкция по применению лекарственного препарата Инвокана® ЛП-002977. Доступно по: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=7e19c450-bd8a-4fa4-a9f1-f789b8515544&t=). Ссылка активна на 23.10.2023.
36. Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl. 2022;12(1):7-11. doi: https://doi.org/10.1016/j.kisu.2021.11.003
37. Sundstrom J, Bodegard J, Bollmann A, et al. Prevalence, outcomes, and cost of chronic kidney disease in a contemporary population of 2-4 million patients from 11 countries: The CaReMe CKD study. Lancet Reg Heal-Eur. 2022;20(1):100438. doi: https://doi.org/10.1016/j.lanepe.2022.100438
38. Алгоритмы специализированной медицинской помощи больным сахарным диабетом 11-й выпуск./ Под ред. Дедова И.И., Шестаковой М.В., Майорова А.Ю.. — М.; 2023. doi: https://doi.org/10.14341/DM13042
39. Matsushita K, Coresh J, Sang Y, et al. Estimated glomerular filtration rate and albuminuria for prediction of cardiovascular outcomes: a collaborative meta-analysis of individual participant data. Lancet Diabetes Endocrinol. 2015;3(7):514-525. doi: https://doi.org/10.1016/S2213-8587(15)00040-6
40. Tonneijck L, Muskiet MHA, Smits MM, et al. Glomerular hyperfiltration in diabetes: mechanisms, clinical significance, and treatment. J Am Soc Nephrol. 2017;28(4):1023-1039. doi: https://doi.org/10.1681/ASN.2016060666
41. Alicic RZ, Rooney MT, Tuttle KR. Diabetic Kidney disease: Challenges, progress, and possibilities. Clin J Am Soc Nephrol. 2017;12(12):2032-2045. doi: https://doi.org/10.2215/CJN.11491116
42. D'Amico G, Bazzi C. Pathophysiology of proteinuria. Kidney Int. 2003;63(3):809-825. doi: https://doi.org/10.1046/j.1523-1755.2003.00840.x
43. Balazki P, Schaller S, Eissing T, et al. A quantitative systems pharmacology kidney model of diabetes associated renal hyperfiltration and the effects of SGLT inhibitors. CPT Pharmacometrics Syst Pharmacol. 2018;7(12):788-797. doi: https://doi.org/10.1002/psp4.12359
44. Kluger AY, Tecson KM, Lee AY, et al. Class effects of SGLT2 inhibitors on cardiorenal outcomes. Cardiovasc Diabetol. 2019;18(1):99. doi: https://doi.org/10.1186/s12933-019-0903-4
45. Gohda T, Murakoshi M. Sodium-glucose cotransporter-2 inhibitors— miracle drugs for the treatment of chronic Kidney disease irrespective of the diabetes status: Lessons from the dedicated kidney disease-focused CREDENCE and DAPA-CKD trials. Int J Mol Sci. 2022;23(22):13749. doi: https://doi.org/10.3390/ijms232213749
46. Durkin M, Blais J. Linear projection of estimated glomerular filtration rate decline with canagliflozin and implications for dialysis utilization and cost in diabetic nephropathy. Diabetes Ther. 2021;12(2):499-508. doi: https://doi.org/10.1007/s13300-020-00953-4
47. Tziomalos K, Athyros VG. Diabetic nephropathy: New risk factors and improvements in diagnosis. Rev Diabet Stud. 2015;12(1-2):110-118. doi: https://doi.org/10.1900/RDS.2015.12.110
48. Zhang J, Wei J, Jiang S, et al. Macula densa SGLT1-NOS1-tubuloglomerular feedback pathway, a new mechanism for glomerular hyperfiltration during hyperglycemia. J Am Soc Nephrol. 2019;30(4):578-593. doi: https://doi.org/10.1681/ASN.2018080844
49. Hsieh C-Y, Sung S-F. From Kidney Protection to Stroke Prevention: The Potential Role of Sodium Glucose Cotransporter-2 Inhibitors. Int J Mol Sci. 2022;24(1):351. doi: https://doi.org/10.3390/ijms24010351
Об авторах
М. В. ШестаковаРоссия
Шестакова Марина Владимировна - доктор медицинских наук, профессор, академик РАН.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Г. Р. Галстян
Россия
Галстян Гагик Радикович - доктор медицинских наук, профессор.
Москва
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Е. Н. Гринева
Россия
Гринёва Елена Николаевна - доктор медицинских наук, профессор.
Санкт-Петербург
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
А. В. Зилов
Россия
Зилов Алексей Вадимович – кандидат медицинских наук, доцент.
Москва
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Т. Ю. Демидова
Россия
Демидова Татьяна Юльевна - доктор медицинских наук, профессор.
Москва
Researcher ID: D-3425-2018; Author ID: 7003771623
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
А. М. Мкртумян
Россия
Мкртумян Ашот Мусаелович - доктор медицинских наук, профессор.
Москва
Author ID: 513441
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Н. А. Петунина
Россия
Петунина Нина Александровна - доктор медицинских наук, профессор.
Москва
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Л. А. Руяткина
Россия
Руяткина Людмила Александровна - доктор медицинских наук, профессор.
Новосибирск
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
О. Ю. Сухарева
Россия
Сухарева Ольга Юрьевна – кандидат медицинских наук, доцент.
Москва
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Л. А. Суплотова
Россия
Суплотова Людмила Александровна - доктор медицинских наук, профессор.
Тюмень
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
М. Ш. Шамхалова
Россия
Шамхалова Минара Шамхаловна - доктор медицинских наук
Москва
Конфликт интересов:
Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Распределение натрий-глюкозных котранспортеров 1 и 2 типа в различных отделах головного мозга (по Pawlos A. и соавт., 2021 г., с адаптацией) [21]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(146KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Схема патогенеза ишемического инсульта при сахарном диабете (по Mosenzon O. и соавт., 2023 г., с изменениями) [7]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(216KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Изменение расчетной скорости клубочковой фильтрации во времени у пациентов в группе канаглифлозина и плацебо из исследования CREDENCE (по Durkin M., Blais J., 2020 г., с адаптацией) [46]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(203KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шестакова М.В., Галстян Г.Р., Гринева Е.Н., Зилов А.В., Демидова Т.Ю., Мкртумян А.М., Петунина Н.А., Руяткина Л.А., Сухарева О.Ю., Суплотова Л.А., Шамхалова М.Ш. Роль канаглифлозина в профилактике инсульта и хронической болезни почек у пациентов с сахарным диабетом 2 типа: резолюция совета экспертов. Сахарный диабет. 2023;26(5):484-491. https://doi.org/10.14341/DM13086
For citation:
Shestakova M.V., Galstyan G.R., Grineva E.N., Zilov A.V., Demidova T.Yu., Mkrtumyan A.M., Petunina N.A., Ruyatkina L.A., Sukhareva O.Y., Suplotova L.A., Shamkhalova M.S. The role of canagliflozin in the prevention of stroke and chronic kidney disease in patients with type 2 diabetes mellitus: an expert council resolution. Diabetes mellitus. 2023;26(5):484-491. (In Russ.) https://doi.org/10.14341/DM13086
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































