Перейти к:
Нейропротекторный потенциал глифлозинов
https://doi.org/10.14341/DM13085
Аннотация
Глифлозины – сравнительно новый класс пероральных сахароснижающих препаратов, все более широко входящий в рутинную практику при лечении пациентов с сахарным диабетом 2 типа (СД2). Гипогликемический эффект глифлозинов связан со стимуляцией глюкозурии, однако, помимо выраженного сахароснижающего эффекта и высокой безопасности эти препараты так же обладают множеством плейотропных свойств, ввиду наличия как прямых, так и опосредованных точек приложения. Целью настоящей работы является обзорное представление наиболее изученных на данный момент нейропротекторных эффектов этого класса препаратов. В качестве материалов в ходе работы использовались исследования зарубежных коллег, в том числе фундаментальные работы in vitro, а также клинические испытания. Анализ работ показал, что нейропротективное действие глифлозинов связано со множеством различных механизмов - так, глифлозины реализуют противовоспалительный эффект путем активации М2-субпопуляции макрофагов, снижением провоспалительных нейромедиаторов (относящихся, в первую очередь к инфламмасоме). Кроме того, в следствии снижения активности сигнального пути mTOR препараты уменьшают количество бета-амилоида и улучшают процессы нейротрансмиссии. Группой работ было также показано и антиацетилхолинэстеразное действие глифлозинов, не говоря уже о снижении интенсивности неферментативного гликирования протеинов и инсулинорезистентности. Все вышеперечисленные механизмы обеспечивают противовоспалительный, антиатерогенный эффект, улучшение когнитивных способностей у пациентов, снижение частоты геморрагических ОНМК, а также потенциально могут улучшать прогнозы у пациентов с болезнью Альцгеймера (БА). Описанные выше эффекты были получены в ходе доклинических испытаний и множества экспериментальных работ, а некоторые эффекты уже продемонстрировали свою состоятельность и в ходе проспективных клинических испытаний. Однако, полученных данных пока недостаточно для формирования четких показаний для этого класса препаратов в неврологии, поэтому тема требует дальнейшего изучения и клинических испытаний.
Ключевые слова
Для цитирования:
Кокин А.С., Суплотова Л.А. Нейропротекторный потенциал глифлозинов. Сахарный диабет. 2023;26(6):596-602. https://doi.org/10.14341/DM13085
For citation:
Kokin A.S., Suplotova L.A. Neuroprotective potential of gliflozins. Diabetes mellitus. 2023;26(6):596-602. (In Russ.) https://doi.org/10.14341/DM13085
ВВЕДЕНИЕ
Класс глифлозинов, появившийся сравнительно недавно, прочно обосновался в рутинной клинической практике при лечении пациентов с сахарным диабетом 2 типа (СД2). Это можно объяснить не только наличием достаточного сахароснижающего эффекта, но и высокой безопасностью препаратов, а также наличием плейотропных эффектов. Так, в последнее время глифлозины используются не только в качестве средства для контроля гликемии, но и для улучшения прогнозов у пациентов с хронической сердечной недостаточностью, а также для снижения прогрессирования повреждения почек при хронической болезни почек. Кроме того, существуют работы, показывающие положительные эффекты глифлозинов при назначении пациентам с неалкогольной жировой болезнью печени [1]. Все это делает данный класс препаратов незаменимым при лечении коморбидных пациентов с СД2, однако помимо вышеобозначенных эффектов глифлозины также продемонстрировали и нейропротекторное действие, которое является предметом научного интереса множества исследователей по всему миру. В настоящей статье авторский коллектив предлагает литературный обзор научного материала, касающегося нейропротекторных эффектов глифлозинов.
Сбор материала для обзора производился путем поиска статей в электронных библиотеках Pubmed, Cochraine, NCBI и Web of Science по ключевым словам: sglt, gliflozins, neuroprotection, non-fatal stroke, empagliflozin, canagliflozin, dapagliflozin, ertugliflozin. При включении материала в обзор предпочтение отдавалось более поздним статьям, опубликованным в последние 5–7 лет, за исключением некоторых фундаментальных работ, несущих важную информацию по теме, но опубликованных ранее обозначенного срока.
ФИЗИОЛОГИЯ БЕЛКОВ-ПЕРЕНОСЧИКОВ ГЛЮКОЗЫ В НЕРВНОЙ СИСТЕМЕ
Транспорт глюкозы в организме осуществляется с помощью двух классов переносчиков: GLUT-системы, с помощью которой происходит облегченный транспорт глюкозы, и системы SGLT, участвующей в активном энергозависимом транспорте, которая сопряжена с градиентом натрия, проходящего через клеточную мембрану. Всего существует 12 членов семейства SGLT человека, которые включают котранспортеры сахаров, анионов, витаминов и короткоцепочечных жирных кислот [2]. В зависимости от локализации и типа SGLT имеют селективность в отношении разных сахаров — так, группа белков первого типа, расположенная главным образом в тощей кишке, отвечает за транспорт всех естественных сахаров (таких как глюкоза и галактоза), в то время как SGLT второго типа, экспрессирующиеся в почках, носят исключительно селективный характер в отношении глюкозы [3][4]. Кроме того, некоторые SGLT вообще не являются транспортерами в привычном понимании — так, третий тип этих белков является своеобразным глюкосенсором, расположенным в энтеральной нервной системе, мышцах и других тканях и предоставляющим организму информацию о текущей концентрации глюкозы в крови [2].
Что касается нервной системы — практически все типы SGLT встречаются в головном мозге (рис. 1). Однако наибольшим распространением обладает SGLT1, находящийся в пирамидных клетках коры головного мозга, клетках мозжечка, пирамидных, зернистых клетках гиппокампа, эндотелии сосудов мозга и гематоэнцефалическом барьере. SGLT1 переносит в клетку 2 молекулы Na+ и 1 молекулу D-глюкозы и участвует тем самым в формировании регуляторных механизмов, направленных на гомеостаз глюкозы [5][6]. Второй тип белков-переносчиков, в отличие от первого, переносит 1 молекулу Na+ и 1 молекулу глюкозы через клеточную стенку и встречается в микрососудах гематоэнцефалического барьера, а также в миндалевидном теле, гипоталамусе, коре головного мозга и в дорсомедиальном отделе продолговатого мозга, а именно — в ядрах солитарного тракта [7][8]. При этом SGLT2 в этих структурах, по-видимому, не оказывают влияния на углеводный обмен, но принимают активное участие в регуляции вегетативных центров, отвечающих за артериальное давление. Экспрессия белков семейства SGLT в нервной ткани регулируется группой генов SLC5, которая может быть активирована, например, травмой головного мозга [9]. Кроме того, есть основания полагать, что блокирование SGLT1 может оказывать благотворное влияние на площадь поражения головного мозга, объем поврежденной ткани, отек и нарушение двигательных функций. Этот эффект может быть связан с тем, что SGLT1 создают повышенный ток натрия в клетку, что приводит к внутриклеточному отеку и развитию вышеобозначенных эффектов [10].
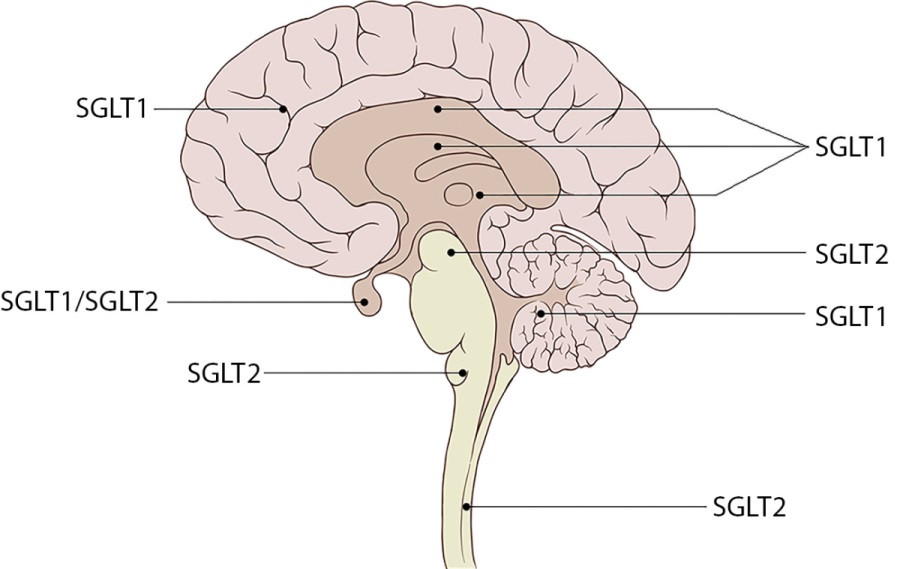
Рисунок 1. Преимущественная распространенность котранспортеров глюкозы
в центральной нервной системе.
ОСОБЕННОСТИ НЕЙРОНАЛЬНОГО ДЕЙСТВИЯ ГЛИФЛОЗИНОВ
Учитывая преимущественную распространенность в центральной нервной системе (ЦНС) именно SGLT1, можно предположить, что взаимодействие с этой группой белков будет предиктором нейрональных эффектов глифлозинов. Однако в настоящее время работ, показывающих эти эффекты, нет, и тема остро нуждается в освещении [11]. Спектр действия глифлозинов на ЦНС достаточно широк, что связано не столько с непосредственным влиянием препаратов на систему SGLT, сколько с большим количеством иных взаимодействий, одним из которых является антиацетилхолинэстеразная активность, лежащая в основе эффективности глифлозинов при нейродегенеративных заболеваниях. Ацетилхолинэстераза (АХЭ) — нейрональный фермент, в норме отвечающий за утилизацию избыточного количества ацетилхолина, одного из основных участников процессов нейрональной трансмиссии. Однако существует ряд заболеваний, при которых происходит растормаживание АХЭ, что приводит к разнообразным моторным и когнитивным нарушениям. Одним из таких заболеваний является болезнь Альцгеймера (БА), патогенетическим звеном которой является уменьшение количества ацетилхолиновых рецепторов и, как следствие, связанная с этим относительная ацетилхолиновая недостаточность в ЦНС. В группе глифлозинов наибольшей способностью ингибировать АХЭ обладает канаглифлозин — в работе, посвященной фармакодинамике препарата, было показано, что канаглифлозин проникает через гематоэнцефалический барьер в достаточном количестве для осуществления антиацетилхолинэстеразной активности, в связи с чем авторы назвали его «двойным ингибитором SGLT2 и АХЭ» [12]. Валидность этого термина подтвердилась в ходе экспериментов на крысиных моделях БА, когда было продемонстрировано улучшение когнитивных способностей при применении канаглифлозина (так же, как и галантамина — одного из основных препаратов, активно использующегося для лечения БА у людей) при решении задач на прохождение Y-образного и водного лабиринтов [13]. Эффекты глифлозинов на нейродегенерацию не ограничиваются лишь ацетилхолинэстеразной активностью — доказано влияние глифлозинов и на сигнальный путь mTOR (мишень рапамицина млекопитающих), который связывает метаболические и когнитивные нарушения. Это важный клеточный координатор многих метаболических путей, гиперактивация которого проявляется разнообразными анаболическими эффектами (увеличение уровня глюкозы, аминокислот, факторов роста). Неограниченная активация mTOR также связана с гиперфосфорилированием и агрегацией тау- и бета-амилоида при БА, более того, хроническая активация mTOR нарушает функцию лизосомальных протеинов, что подтверждает гипотезу «эндолизосомальной дисфункции» БА, согласно которой метаболизм бета-амилоида затруднен вследствие относительной недостаточности лизосомальных протеаз [14]. Глифлозины, помимо глюкозурического эффекта, также стимулируют гликогенолиз и глюконеогенез из жирных кислот, уменьшая таким образом количество субстрата для mTOR и, следовательно, снижая степень его активности [15]. Кроме того, согласно данным M. Packer, глифлозины вызывают транскрипционные изменения в клетках, обычно возникающие во время голодания, этот феномен получил название «состояние мимикрии натощак» и включает активацию сигнального пути SIRT/AMPK и подавление Akt/mTOR [16]. Глифлозины, снижая степень активности mTOR, могут быть полезны в лечении пациентов с БА в соответствии с гипотезами «диабета 3 типа», «митохондриального каскада» и «эндолизосомальной дисфункции» [15]. Кроме того, растормаживание mTOR вызывает дисфункцию эндотелиальных клеток, что является не только ключевым моментом атеросклероза, но также способствует нарушению гематоэнцефалического барьера [17].
Помимо действия на SGLT1, антиацетилхолинэстеразного эффекта и прямого ингибирования SGLT2 в ЦНС, известен еще и эффект глифлозинов на мозговой нейтрофический фактор (BDNF — brain-derived neurotrophic factor), проявляющийся в увеличении концентрации этого нейромедиатора, который обладает противовоспалительным (по-видимому, через увеличение М2 популяции макрофагов, путем активации сигнального пути STAT3), прокогнитивным действием, а также участвует в росте нейротрофов и процессах нейротрансмиссии [18–20]. Концентрация этого нейромедиатора значительно снижается у пациентов с DMAA (diabetes melitus-accelerated atherosclerosis), что может говорить о наличии патогенетических связей между BDNF и атеросклерозом и/или СД [21]. Эта гипотеза подтверждается в другом исследовании, в ходе которого использование BDNF у мышей снижало частоту мозговых атеросклеротических поражений [18]. Более подробно антиатеросклеротический эффект глифлозинов был исследован в работе Z. Liu и соавт., в ходе которой было показано, что, действуя через снижение экспрессии моноцитарного хемоаттрактантного белка-1, молекулы адгезии сосудистых клеток-1, а также подавление количества молекул межклеточной адгезии-1, интерлейкина-1β, интерлейкина-6 и фактора некроза опухоли-α, глифлозины снижают активность и распространение атеросклеротической трансформации сосудов человека [22]. Другой важный антиатеросклеротический механизм действия глифлозинов заключается в действии на систему паттерн-распознающих рецепторов (PRR — pattern-recognition receptor, также известная как инфламмасома), которая отвечает за высвобождение множества провоспалительных факторов с дальнейшей инфильтрацией стенки сосуда липопротеинами низкой плотности [23]. В исследовании D. Kim был продемонстрирован антиатеросклеротический эффект эмпаглифлозина, реализуемый путем снижения NLRP3 — важнейшего компонента, активирующего PRR-систему [24]. Кроме того, гиперактивация PRR-системы снижает метаболизм бета-амилоида при БА, что является еще одним механизмом действия глифлозинов на это заболевание [25].
Кроме вышеупомянутых механизмов, с помощью которых глифлозины могут влиять на патогенетические звенья БА, этот класс препаратов также положительно действует на гомеостаз инсулина, снижая инсулинорезистентность тканей, в т.ч. и на уровне ЦНС. Инсулинорезистентность присутствует у 8 из 10 пациентов, страдающих БА, это подтверждается данными исследования J. Langbaum, в котором было выявлено снижение скорости метаболизма глюкозы головным мозгом пациентов с БА в ходе теста позитронно-эмиссионной томографии с фтордезоксиглюкозой [26][27]. Повышенный уровень инсулина в головном мозге способствует патологии БА, так как фермент, разрушающий инсулин, также принимает участие в деградации амилоидных бляшек [28]. Однако, несмотря на то, что глифлозины достоверно улучшают инсулиновый гомеостаз в нейрональной ткани, клинических испытаний, валидизирующих этот эффект на людях, пока не проводилось [11]. Кроме того, в настоящее время нет убедительных данных об улучшении прогнозов или уменьшении риска развития болезни Паркинсона, а также других нейродегенеративных заболеваний.
Глифлозины показали некоторую эффективность в отношении возникновения и развития когнитивных нарушений. Группой исследователей была изучена взаимосвязь между назначением препаратов и развитием когнитивных нарушений у пациентов как самостоятельного явления: в ходе проспективного анализа 162 пациентов с диабетом и когнитивными нарушениями было показано значительное улучшение когнитивных показателей по результатам Монреальского когнитивного теста в группе эмпаглифлозина в сравнении с группами метформина и инсулина [29]. На данный момент это первое и единственное исследование подобного рода, однако, в настоящее время проводится еще одно клиническое испытание EMPA ELDERLY на популяции пожилых пациентов с СД2 и когнитивными нарушениями из Японии [30].
Препараты также обладают и противовоспалительным эффектом, который реализуется в двух основных механизмах: первый — путем ингибирования уже упомянутой PRR-системы (NLRP3 играет главную роль и в этом взаимодействии), а также через макрофагеальную систему — подавляя JAK2/STAT1-систему, глифлозины повышают количество М2 популяции макрофагов, вырабатывающих противовоспалительные цитокины: интерлейкин-1, интерлейкин-10 и коллаген [31][32]. Макрофагеальное воспаление является важнейшим звеном в развитии оксидативного стресса при травмах и инфекциях мозга, проницаемости гематоэнцефалического барьера, а также развития атеросклероза и когнитивных нарушений [33].
Глифлозины не являются строго селективными в отношении корецепторов SGLT2 — они также в разной степени влияют и на SGLT1. Из всего ряда современных представителей класса сотаглифлозин имеет наибольшее сродство к рецепторам SGLT1, однако этот препарат пока не нашел широкого применения в лечении пациентов с СД2 и не зарегистрирован в России. Среди широко используемых глифлозинов наибольшим потенциалом ингибирования рецепторов SGLT1 обладает канаглифлозин, в то время как эмпаглифлозин и эртуглифлозин являются наиболее селективными в отношении SGLT2 и имеют самый низкий потенциал взаимодействия с SGLT1. Таким образом, теоретически для получения нейропротекторного эффекта, связанного с ингибированием SGLT1 (если таковой будет доказан в будущих исследованиях) у больных СД сотаглифлозин и канаглифлозин могут быть предпочтительнее, чем другие представители класса.
РОЛЬ ГЛИФЛОЗИНОВ ПРИ ИНСУЛЬТЕ
Глифлозины продемонстрировали впечатляющее влияние на снижение количества серьезных неблагоприятных сердечно-сосудистых событий, в связи с чем на этот класс препаратов возлагались большие надежды в отношении влияния на цереброваскулярные нарушения, особенно учитывая их нормогликемический эффект [34]. В более ранних метаанализах предполагалось, что ингибиторы SGLT2 могут увеличить риск ишемического инсульта из-за уменьшения объема циркулирующей крови, ортостатической гипотензии и общей дегидратации, вызванных слабым петлевым диуретическим эффектом, а интенсивное лечение СД2 не способствует снижению риска возникновения инсульта [35][36]. Кроме того, в 2019 г. K. Sato и его команда выполнили исследование, показавшее, что прием глифлозинов связан с повышенным риском ишемического инсульта, включая тромбоз, лакунарный инфаркт и эмболию [37]. Однако в дальнейшем было проведено несколько крупных клинических испытаний, результаты которых противоречат предыдущим исследованиям, — данные говорят о значительном снижении риска инсульта, особенно у пациентов с низкой расчетной скоростью клубочковой фильтрации (рСКФ) [38][39]. Подобное расхождение в результатах разных исследований, посвященных одной теме, можно объяснить тем, что работа K. Sato включала в себя пациентов только с нормальными почечными показателями, в то время как более поздние исследования содержали разнообразные группы пациентов в т.ч. и со сниженной рСКФ.
Роль различных представителей класса глифлозинов в отношении инсультов была исследована в ходе крупных рандомизированных клинических испытаний, выполненных по всем правилам доказательной медицины. Так, действие эмпаглифлозина было показано в исследовании EMPA-REG OUTCOME, первичной задачей которого являлось установить вероятность возникновения трехточечного события MACE (включает в себя сердечно-сосудистую смерть, нефатальный инфаркт миокарда и нефатальный инсульт) у пациентов, принимающих эмпаглифлозин в сравнении с группой контроля. Всего в исследовании участвовали 7020 пациентов из разных стран с разнообразным соматическим анамнезом, медиана времени наблюдения составляла около 3 лет. Результаты исследования показали значимое снижение MACE на 14% в группе эмпаглифлозина по сравнению с плацебо, что опосредованно позволяло судить об эффективности препарата и в отношении инсульта. Однако, в ходе дифференцированного анализа выяснилось, что частота возникновения инсульта в обеих группах не представляется статистически значимой. Таким образом, несмотря на доказанную эффективность эмпаглифлозина в отношении наступления MACE, этот препарат не оказывает положительного влияния на прогнозы наступления ишемического инсульта [40][41]. К аналогичным результатам пришли в исследованиях, посвященных канаглифлозину (в ходе исследования CANVAS) и дапаглифлозину (исследование DECLARE-TIMI 58): при сравнении частоты наступления трехточечного МАСЕ у пациентов в группе препарата наблюдалась положительная, статистически достоверная динамика, однако при изолированном сравнении частоты наступления инсультов разница между исследуемыми и контрольными группами достоверных различий выявлено не было [38][42][43].
Особого внимания заслуживает изучение риска инсульта у пациентов с ХБП — по данным A.D. Kaze и соавт., пациенты с рСКФ менее 60 мл/мин/1,73 м² и уровнем альбуминурии более 30 мг/г на 50% более подвержены риску развития недифференцированного инсульта, что делает данные показатели значимыми факторами риска и требует соответствующего терапевтического подхода [44]. Кроме того, в настоящее время завершены анализы, исследовавшие влияние глифлозинов на риски наступления недифференцированного инсульта у пациентов с разными уровнями снижения рСКФ, — выяснилось, что из всех представителей глифлозинов только канаглифлозин снижал соответствующие риски, при этом эффект препарата проявлялся сильнее в группе со снижением рСКФ менее 45 мл/мин/1,73 м² [39].
В 2021 г. закончен большой метаанализ данных, полученных из пяти больших рандомизированных клинических исследований с участием 46 969 человек, в ходе которого исследовалась частота сообщений о случаях дифференцированного инсульта (фатальный, нефатальный, ишемический, геморрагический и транзиторная ишемическая атака (ТИА)) у пациентов в группе с глифлозинами и группе контроля, который показал, что ни один из исследованных препаратов (в метаанализе исследовались дапаглифлозин, канаглифлозин, эмпаглифлозин и эртуглифлозин) не увеличивает риск недифференцированного инсульта и имеет по крайней мере нейтральный эффект среди различных подтипов инсульта (рис. 2). Главной находкой данного метаанализа стало установление влияния канаглифлозина на частоту возникновения геморрагического инсульта: при анализе исследований EMPA-REG OUTCOME, CANVAS и CREDENCE установлено статистически достоверное снижение числа геморрагических инсультов в группе с препаратом вплоть до 50% [39][45]. Одним из объяснений этого явления является известное гипотензивное действие глифлозинов, реализующееся через стимуляцию диуреза и влияние на вегетативные центры в ЦНС [46]. Кроме того, исследователями была проанализирована частота наступления ТИА в разных группах: выяснилось, что глифлозины не оказывают значимого влияния на риски наступления ТИА в сравнении с группой плацебо [39].

Рисунок 2. Forest-графики эффектов ингибиторов
натрий-глюкозного котранспортера 2 типа на подтип инсульта.
(А) ишемический инсульт,
(В) геморрагический инсульт и
(С) транзиторная ишемическая атака.
Примечание:
iSGLT2 — ингибиторы натрий-глюкозного котранспортера 2 типа;
ОР — отношение рисков;
ТИА — транзиторная ишемическая атака.
ЗАКЛЮЧЕНИЕ
Таким образом, СД2, атеросклероз, острые нарушения мозгового кровообращения, когнитивные и нейродегенеративные нарушения являются серьезной проблемой для прогноза выживаемости пациентов, поскольку это хронические неизлечимые заболевания, ведущие к снижению качества и продолжительности жизни. При этом многие из обозначенных заболеваний имеют общие патогенетические звенья, ввиду чего важно применять препараты, воздействующие на эти предпосылки, для получения максимального терапевтического эффекта при назначении минимального количества многоцелевых препаратов. В обзоре авторский состав выделил дополнительные свойства глифлозинов, проявляющиеся в снижении частоты когнитивных нарушений, геморрагического инсульта и атеросклероза. Отдельного внимания заслуживает канаглифлозин, показавший эффективность в отношении наступления недифференцированного инсульта у пациентов со сниженной рСКФ. Несмотря на то что механизмы реализации этих клинических эффектов изучены не в полной мере, уже сейчас понятно, что в этом участвуют противовоспалительные и антиатеросклеротические свойства, ингибирование АХЭ, а также нормогликемическое действие глифлозинов. Тем не менее, пути реализации ряда эффектов все еще не вполне ясны, ввиду чего требуются новые экспериментальные работы в этих направлениях. В частности, в освещении остро нуждается физиология действия SGLT1 на нейрональные ткани, так как множество не объясненных до сих пор эффектов глифлозинов могут быть связаны именно с этими белками. Кроме того, необходимы долгосрочные клинические испытания, чтобы установить, являются ли вышеупомянутые механизмы клинически значимыми, поскольку нейропротекторные эффекты не будут немедленными и потребуют длительного приема препаратов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Кокин А.С. — поиск, отбор, анализ данных, написание и редактирование финальной версии рукописи; Суплотова Л.А. — разработка концепции исследования, редактирование и финальное утверждение рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Nasiri-Ansari N, Nikolopoulou C, Papoutsi K, et al. Empagliflozin attenuates Non-Alcoholic Fatty Liver Disease (NAFLD) in high fat diet fed ApoE(-/-) mice by activating autophagy and reducing er stress and apoptosis. Int J Mol Sci. 2021;22(2):818. doi: https://doi.org/10.3390/ijms22020818
2. Wright EM, Loo DDF, Hirayama BA. Biology of human sodium glucose transporters. Physiol Rev. 2011;91(2):733-794. doi: https://doi.org/10.1152/physrev.00055.2009
3. Deng D, Yan N. GLUT, SGLT, and SWEET: Structural and mechanistic investigations of the glucose transporters. Protein Science. 2016;25(3):546-558. doi: https://doi.org/10.1002/pro.2858
4. Lehmann A, Hornby PJ. Intestinal SGLT1 in metabolic health and disease. Am J Physiol Liver Physiol. 2016;310(11):G887-G898. doi: https://doi.org/10.1152/ajpgi.00068.2016
5. Hu G, Wang X, Meng L, et al. SGLT1/2 as the potential biomarkers of renal damage under Apoe−/− and chronic stress via the BP neural network model and support vector machine. Front Cardiovasc Med. 2022;9. doi: https://doi.org/10.3389/fcvm.2022.948909
6. Poppe R, Karbach U, Gambaryan S, et al. Expression of the Na+-d-Glucose Cotransporter SGLT1 in Neurons. J Neurochem. 2002;69(1):84-94. doi: https://doi.org/10.1046/j.1471-4159.1997.69010084.x
7. Nguyen T, Wen S, Gong M, et al. Dapagliflozin activates neurons in the Ther. 2020;(13):2781central nervous system and regulates cardiovascular activity by inhibiting SGLT-2 in mice. Diabetes, Metab Syndr Obes Targets -2799. doi: https://doi.org/10.2147/DMSO.S258593
8. Pawlos A, Broncel M, Woźniak E, Gorzelak-Pabiś P. Neuroprotective effect of SGLT2 inhibitors. Molecules. 2021;26(23):7213. doi: https://doi.org/10.3390/molecules26237213
9. Oerter S, Förster C, Bohnert M. Validation of sodium/ glucose cotransporter proteins in human brain as a potential marker for temporal narrowing of the trauma formation. Int J Legal Med. 2019;133(4):1107-1114. doi: https://doi.org/10.1007/s00414-018-1893-6
10. Sebastiani A, Greve F, Gölz C, et al. RS1 (Rsc1A1) deficiency limits cerebral SGLT1 expression and delays brain damage after experimental traumatic brain injury. J Neurochem. 2018;147(2):190-203. doi: https://doi.org/10.1111/jnc.14551
11. Jayarathne HSM, Debarba LK, Jaboro JJ, et al. Neuroprotective effects of Canagliflozin: Lessons from aged genetically diverse UM-HET3 mice. Aging Cell. 2022;21(7):e13653. doi: https://doi.org/10.1111/acel.13653
12. Rizvi S, Shakil S, Biswas D, et al. Invokana (Canagliflozin) as a dual inhibitor of acetylcholinesterase and sodium glucose Co-transporter 2: Advancement in Alzheimer’s disease diabetes type 2 linkage via an enzoinformatics study. CNS Neurol Disord Drug Targets. 2014;13(3):447-451. doi: https://doi.org/10.2174/18715273113126660160
13. Arafa NMS, Ali EHA, Hassan MK. Canagliflozin prevents scopolamineinduced memory impairment in rats: Comparison with galantamine hydrobromide action. Chem Biol Interact. 2017;(277):195-203. doi: https://doi.org/10.1016/j.cbi.2017.08.013
14. Van Skike CE, Galvan V. A perfect sTORm: The role of the mammalian Target of Rapamycin (mTOR) in cerebrovascular dysfunction of Alzheimer’s disease: A mini-review. Gerontology. 2018;64(3):205-211. doi: https://doi.org/10.1159/000485381
15. Stanciu GD, Rusu RN, Bild V, et al. Systemic actions of SGLT2 inhibition on chronic mTOR activation as a shared pathogenic mechanism between Alzheimer’s disease and diabetes. Biomedicines. 2021;9(5):576. doi: https://doi.org/10.3390/biomedicines9050576
16. Packer M. SGLT2 inhibitors produce cardiorenal benefits by promoting adaptive cellular reprogramming to induce a state of fasting mimicry: A paradigm shift in understanding their mechanism of action. Diabetes Care. 2020;43(3):508-511. doi: https://doi.org/10.2337/dci19-0074
17. Uddin MdS, Rahman MdA, Kabir MdT, et al. Multifarious roles of mTOR signaling in cognitive aging and cerebrovascular dysfunction of Alzheimer’s disease. IUBMB Life. 2020;72(9):1843-1855. doi: https://doi.org/10.1002/iub.2324
18. Bi C, Fu Y, Li B. Brain-derived neurotrophic factor alleviates diabetes mellitus-accelerated atherosclerosis by promoting M2 polarization of macrophages through repressing the STAT3 pathway. Cell Signal. 2020;70:109569. doi: https://doi.org/10.1016/j.cellsig.2020.109569
19. Lin B, Koibuchi N, Hasegawa Y, et al. Glycemic control with empaglifl zin, a novel selective SGLT2 inhibitor, ameliorates cardiovascular injury and cognitive dysfunction in obese and type 2 diabetic mice. Cardiovasc Diabetol. 2014;13(1):148. doi: https://doi.org/10.1186/s12933-014-0148-1
20. Bathina S, Das UN. Brain-derived neurotrophic factor and its clinical implications. Archives of Medical Science. 2015;6:1164-1178. doi: https://doi.org/10.5114/aoms.2015.56342
21. Zhen YF, Zhang J, Liu XY, et al. Low BDNF is associated with cognitive deficits in patients with type 2 diabetes. Psychopharmacology (Berl). 2013;227(1):93-100. doi: https://doi.org/10.1007/s00213-012-2942-3
22. Liu Z, Ma X, Ilyas I, et al. Impact of sodium glucose cotransporter 2 (SGLT2) inhibitors on atherosclerosis: from pharmacology to preclinical and clinical therapeutics. Theranostics. 2021;11(9):4502-4515. doi: https://doi.org/10.7150/thno.54498
23. Kelley N, Jeltema D, Duan Y, He Y. The NLRP3 inflammasome: An overview of mechanisms of activation and regulation. Int J Mol Sci. 2019;20(13):3328. doi: https://doi.org/10.3390/ijms20133328
24. Kim SR, Lee SG, Kim SH, et al. SGLT2 inhibition modulates NLRP3 inflammasome activity via ketones and insulin in diabetes with cardiovascular disease. Nat Commun. 2020;11(1):2127. doi: https://doi.org/10.1038/s41467-020-15983-6
25. Tejera D, Mercan D, Sanchez‐Caro JM, et al. Systemic inflammation impairs microglial Aβ clearance through NLRP 3 inflammasome. EMBO J. 2019;38(17). doi: https://doi.org/10.15252/embj.2018101064
26. Sim AY, Barua S, Kim JY, et al. Role of DPP-4 and SGLT2 inhibitors connected to Alzheimer disease in type 2 diabetes mellitus. Front Neurosci. 2021;15. doi: https://doi.org/10.3389/fnins.2021.708547
27. Langbaum JBS, Chen K, Lee W, et al. Categorical and correlational analyses of baseline fluorodeoxyglucose positron emission tomography images from the Alzheimer’s Disease Neuroimaging Initiative (ADNI). Neuroimage. 2009;45(4):1107-1116. doi: https://doi.org/10.1016/j.neuroimage.2008.12.072
28. Cork SC, Richards JE, Holt MK, et al. Distribution and characterisation of Glucagon-like peptide-1 receptor expressing cells in the mouse brain. Mol Metab. 2015;4(10):718-731. doi: https://doi.org/10.1016/j.molmet.2015.07.008
29. Mone P, Lombardi A, Gambardella J, et al. Empagliflozin improves cognitive impairment in frail older adults with type 2 diabetes and heart failure with preserved ejection fraction. Diabetes Care. 2022;45(5):1247-1251. doi: https://doi.org/10.2337/dc21-2434
30. Yabe D, Shiki K, Suzaki K, et al. Rationale and design of the EMPAELDERLY trial: a randomised, double-blind, placebo-controlled, 52-week clinical trial of the efficacy and safety of the sodiumglucose cotransporter-2 inhibitor empagliflozin in elderly Japanese patients with type 2 diabetes. BMJ Open. 2021;11(4):e045844. doi: https://doi.org/10.1136/bmjopen-2020-045844
31. Lee SG, Lee SJ, Lee JJ, et al. Anti-Inflammatory Effect for atherosclerosis progression by Sodium-Glucose Cotransporter 2 (SGLT-2) inhibitor in a normoglycemic rabbit model. Korean Circ J. 2020;50(5):443. doi: https://doi.org/10.4070/kcj.2019.0296
32. Lee N, Heo YJ, Choi SE, et al. Anti-inflammatory effects of empaglifl zin and gemigliptin on LPS-stimulated macrophage via the IKK/NF-κB, MKK7/JNK, and JAK2/STAT1 signalling pathways. J Immunol Res. 2021;2021:1-11. doi: https://doi.org/10.1155/2021/9944880
33. Barrett TJ. Macrophages in atherosclerosis regression. Arterioscler Thromb Vasc Biol. 2020;40(1):20-33. doi: https://doi.org/10.1161/ATVBAHA.119.312802
34. Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. The Lancet. 2019;393(10166):31-39. doi: https://doi.org/10.1016/S0140-6736(18)32590-X
35. Ray KK, Seshasai SRK, Wijesuriya S, et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. The Lancet. 2009;373(9677):1765-1772. doi: https://doi.org/10.1016/S0140-6736(09)60697-8
36. Kimura G. Sodium-Glucose Cotransporter 2 (SGLT2) inhibitors and stroke. Circ J. 2017;81(6):898. doi: https://doi.org/10.1253/circj.CJ-17-0040
37. Sato K, Mano T, Iwata A, Toda T. Subtype‐dependent reporting of stroke With SGLT2 inhibitors: implications from a Japanese pharmacovigilance study. J Clin Pharmacol. 2020;60(5):629-635. doi: https://doi.org/10.1002/jcph.1561
38. Perkovic V, de Zeeuw D, Mahaffey KW, et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program randomised clinical trials. Lancet Diabetes Endocrinol. 2018;6(9):691-704. doi: https://doi.org/10.1016/S2213-8587(18)30141-4
39. Zhou Z, Jardine MJ, Li Q, et al. Effect of SGLT2 Inhibitors on stroke and atrial fibrillation in diabetic kidney disease. Stroke. 2021;52(5):1545-1556. doi: https://doi.org/10.1161/STROKEAHA.120.031623
40. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015;373(22):2117-2128. doi: https://doi.org/10.1056/NEJMoa1504720
41. Zinman B, Inzucchi SE, Lachin JM, et al. Empagliflozin and cerebrovascular events in patients with type 2 diabetes mellitus at high cardiovascular risk. Stroke. 2017;48(5):1218-1225. doi: https://doi.org/10.1161/STROKEAHA.116.015756
42. Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019;380(24):2295-2306. doi: https://doi.org/10.1056/NEJMoa1811744
43. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019;380(4):347-357. doi: https://doi.org/10.1056/NEJMoa1812389
44. Kaze AD, Jaar BG, Fonarow GC, Echouffo-Tcheugui JB. Diabetic kidney disease and risk of incident stroke among adults with type 2 diabetes. BMC Med. 2022;20(1):127. doi: https://doi.org/10.1186/s12916-022-02317-0
45. Tsai WH, Chuang SM, Liu SC, et al. Effects of SGLT2 inhibitors on stroke and its subtypes in patients with type 2 diabetes: a systematic review and meta-analysis. Sci Rep. 2021;11(1):15364. doi: https://doi.org/10.1038/s41598-021-94945-4
46. Baker WL, Smyth LR, Riche DM, et al. Effects of sodium-glucose co-transporter 2 inhibitors on blood pressure: A systematic review and meta-analysis. J Am Soc Hypertens. 2014;8(4):262-275.e9. doi: https://doi.org/10.1016/j.jash.2014.01.007
Об авторах
А. С. КокинРоссия
Кокин Артем Сергеевич, ординатор
г. Тюмень
Л. А. Суплотова
Россия
Суплотова Людмила Александровна, д.м.н., профессор
625023 г. Тюмень, ул. Одесская, д. 54
Дополнительные файлы
|
|
1. Рисунок 1. Преимущественная распространенность котранспортеров глюкозы в центральной нервной системе. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(145KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Forest-графики эффектов ингибиторов натрий-глюкозного котранспортера 2 типа на подтип инсульта. (А) ишемический инсульт, (В) геморрагический инсульт и (С) транзиторная ишемическая атака. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(531KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кокин А.С., Суплотова Л.А. Нейропротекторный потенциал глифлозинов. Сахарный диабет. 2023;26(6):596-602. https://doi.org/10.14341/DM13085
For citation:
Kokin A.S., Suplotova L.A. Neuroprotective potential of gliflozins. Diabetes mellitus. 2023;26(6):596-602. (In Russ.) https://doi.org/10.14341/DM13085
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































