Перейти к:
Особенности функционального состояния энтеропанкреатической гормональной системы у беременных с гестационным сахарным диабетом
https://doi.org/10.14341/DM13049
Аннотация
ОБОСНОВАНИЕ. Распространенность гестационного сахарного диабета (ГСД) стремительно растет, вместе с чем меняется типичный портрет беременной с данным заболеванием. Частое выявление ГСД на ранних сроках беременности обусловливает высокий интерес к изучению новых механизмов его развития.
ЦЕЛЬ. Оценка состояния инкретинового ответа, основанного на анализе секреции глюкагоноподобного пептида 1 типа (ГПП-1), глюкагона, инсулина и С-пептида, у беременных с разным сроком развития ГСД.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое проспективное сравнительное неконтролируемое исследование, включавшее беременных с ГСД, разделенных на 2 группы в зависимости от срока развития заболевания: 1-я группа — беременные, которым диагноз установлен на сроке <24 нед гестации (n=65), 2-я группа — на сроке ≥24 нед гестации (n=26). Всем пациентам проводился комплекс диагностических мероприятий, включавший нагрузочный тест с определением ГПП-1, глюкагона, инсулина, С-пептида до и после смешанного завтрака, оценку инсулинорезистентности. Части беременных с ГСД произведен мониторинг глюкозы с применением системы FreeStyle Libre Flash (Abbott Diabetes Care Ltd., UK).
РЕЗУЛЬТАТЫ. Общая численность исследуемых — 91 пациентка. Средний возраст составил 32,05±5,6 (ДИ 95% 30,9; 33,2) года. Беременные обеих групп были сопоставимы по возрасту, массе тела и уровню гликемии на момент установки диагноза. Базальный уровень инсулина крови в общей группе составил 7,2 [4,9; 12,1] мкМЕ/мл, С-пептида — 1,5 [1,2; 2,2] нг/мл, глюкагона — 70,1 [56,2; 100,0] пг/мл, ГПП-1 — 1,16 [0,94; 1,22] нг/мл. У 31% женщин показатель HOMA-IR составил ≥2,7. Базальный уровень глюкагона был достоверно выше в группе раннего развития ГСД: 70,9 [57,7; 109,2] пг/мл против 61,7 [46,6; 87] пг/мл, р=0,04. В обеих группах беременных снижение секреции глюкагона не было статистически значимым, у большинства отмечался парадоксальный прирост секреции глюкагона. При оценке динамики ГПП-1 достоверный прирост показателя выявлен только в 1-й группе: Δ ГПП-1 0,15 [-0,07; 0,96], p<0,01. Во 2-й — динамика показателя оказалась статистически не значимой (р=0,2). Выявлена отрицательная корреляция прироста ГПП-1 с MAGE (r=-0,4, p<0,05), индексом лабильности гликемии LI (r=-0,4, p<0,05) и J-индексом (r=0,4, p<0,05).
ЗАКЛЮЧЕНИЕ. Установлено сохранение физиологической секреции инсулина и С-пептида в виде удовлетворительного прироста показателей после пищевой нагрузки. Выявлено нарушение постпрандиального подавления секреции глюкагона. Прирост ГПП-1 в ответ на пищевую нагрузку был нарушен в случае развития ГСД на сроке беременности ≥24 нед.
Ключевые слова
Для цитирования:
Ушанова Ф.О., Демидова Т.Ю., Короткова Т.Н. Особенности функционального состояния энтеропанкреатической гормональной системы у беременных с гестационным сахарным диабетом. Сахарный диабет. 2023;26(6):526-536. https://doi.org/10.14341/DM13049
For citation:
Ushanova F.O., Demidova T.Y., Korotkova T.N. Features of the functional state of the enteropancreatic hormonal system in pregnant women with gestational diabetes mellitus. Diabetes mellitus. 2023;26(6):526-536. (In Russ.) https://doi.org/10.14341/DM13049
ОБОСНОВАНИЕ
Гестационный сахарный диабет (ГСД) — это заболевание, характеризующееся гипергликемией, впервые выявленной во время беременности, но не соответствующей критериям «манифестного» сахарного диабета (СД) [1].
Предполагается, что ГСД поражает до 13% беременных женщин во всем мире, причем, по многочисленным данным, его распространенность продолжает стремительно расти. Согласно данным Международной диабетической федерации (IDF), от матерей с различными формами нарушений углеводного обмена, более 80% из которых составлял ГСД, за 2021 г. родилось более 21 млн детей [2]. При этом показатели распространенности в разных странах варьируют, так как используются разные подходы к выявлению и диагностике данного заболевания. Это связано с тем, что до настоящего времени в международном профессиональном сообществе не приняты единые критерии определения ГСД и принципы проведения скрининговых мероприятий, что, несомненно, сказывается на отсутствии общей эпидемиологической характеристики данной проблемы и представления о клиническом портрете беременной с ГСД. Однако по мере внедрения новых, более строгих критериев диагностики в ряде стран четко прослеживается увеличивающаяся тенденция к выявляемости заболевания с 2–4 до 7–22% [3][4].
Гипергликемия во время беременности представляет потенциальную опасность для состояния матери и ребенка, а отсутствие строгого контроля при ГСД может быть связано с серьезными последствиями, в том числе отдаленными [5]. Так, метаболические сдвиги при ГСД могут играть роль в развитии многоводия, материнского травматизма при родах крупным плодом, преэклампсии, увеличении частоты кесарева сечения, слабости родовой деятельности и других осложнений [6]. В последующем у женщин с ГСД повышается вероятность развития кардиометаболических расстройств, таких как СД 2 типа (СД2) и сердечно-сосудистые заболевания (ССЗ) [7–10]. А к перинатальным рискам некомпенсированного ГСД относят в первую очередь диабетическую фетопатию, основным проявлением которой является макросомия, а также респираторный дистресс-синдром (РДС), неонатальную гипогликемию, полицитемию, гипербилирубинемию и другие [11–14]. Помимо этого, дети, перенесшие хроническую гипергликемию во внутриутробном периоде, подвержены повышенному риску развития СД2, ССЗ, а также ожирения и других состояний, сопровождающихся инсулинорезистентностью (ИР), в более позднем возрасте [15].
Существующая на сегодняшний день проблема управления ГСД и предотвращения развития его осложнений в определенной степени связана с недостаточным пониманием механизмов развития заболевания, особенно развивающегося на ранних сроках беременности. Известно, что любая беременность сама по себе является «диабетогенным» состоянием, обусловленным изменением углеводного метаболизма с нарастанием ИР на фоне повышения выработки плацентой гормонов с контринсулярной активностью и компенсаторной гиперинсулинемии [16]. Предполагается, что в таких условиях для поддержания нормогликемии происходит увеличение его секреции клетками поджелудочной железы (ПЖЖ) на 200–250% [17]. То есть беременность может являться мощным физиологическим стимулом для экспансии ß-клеток ПЖЖ, способным компенсировать относительный дефицит инсулина, что подтверждалось в некоторых экспериментальных работах. Так, в исследовании S. Rieck и соавт. изучение механизмов, потенциально способствующих увеличению секреции инсулина в популяции беременных крыс, показало, что в этот период увеличивается пролиферация клеток ПЖЖ в 3–4 раза и достигает пика примерно через две трети срока беременности. Данный процесс сопровождается гипертрофией, гиперплазией, неогенезом и снижением апоптоза ß-клеток [18].
Однако в ряде случаев резервные возможности ПЖЖ оказываются ограниченными, что проявляется в неспособности β-клеток компенсировать повышенные потребности организма в инсулине и развитие гипергликемии. Среди возможных механизмов недостаточности β-клеток ПЖЖ могут выступать некоторые дефекты инсулинового аппарата, генетические нарушения образования, секреции или действия инсулина. Также, принимая во внимание патофизиологическое сходство ГСД с СД2, в качестве одной из возможных причин развития гестационных нарушений углеводного обмена обсуждается неадекватный ответ в системе инкретиновых гормонов, вырабатывающихся в кишечнике. Инкретиновые пептиды, такие как глюкозозависимый инсулинотропный полипептид и глюкагоноподобный пептид-1 (ГПП-1), играют важную роль в гомеостазе глюкозы, поскольку они усиливают глюкозозависимую стимуляцию инсулина и подавляют секрецию глюкагона, снижают резистентность к инсулину, а также ингибируют апоптоз и потенциально стимулируют пролиферацию β-клеток. Рецепторы ГПП-1 экспрессируются в множестве тканей-мишеней организма, что обуславливает широкий диапазон плейотропных эффектов данных молекул [19]. Так, инкретиновые эффекты обеспечивают положительное влияние на кардиоваскулярную систему, центральную нервную систему, нефропротекцию, способствуют снижению аппетита и чувства голода и т.д. Нарушение секреции ГПП-1 и инкретинового ответа в целом предположительно может приводить к недостаточной реактивности клеток ПЖЖ, начиная с самых ранних сроков беременности. В связи с крайней малочисленностью работ, посвященных оценке состояния инкретиновой системы при беременности, судить о возможном вкладе данных нарушений в развитие ГСД и его осложнений не представляется возможным. Изучение состояния энтеропанкреатической гормональной оси в данной группе женщин позволит расширить существующее представление о механизмах развития углеводных нарушений на разных сроках гестации.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценка состояния инкретинового ответа, основанного на анализе секреции ГПП-1, глюкагона, инсулина и С-пептида, у беременных с разным сроком развития ГСД.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Работа выполнена в структурных подразделениях Государственного бюджетного учреждения здравоохранения (ГБУЗ) города Москвы «Городская клиническая больница (ГКБ) им. В.П. Демихова Департамента здравоохранения города Москвы»: женских консультациях (10 женских консультаций на территории ЮВАО г. Москвы) и роддоме № 8 (с 2023 г. структурные подразделения ГБУЗ «ГКБ №15 им. О.М. Филатова ДЗМ»).
Время исследования. Сбор данных пациентов для последующего анализа проводился в период с марта 2021 г. по декабрь 2021 г.
Изучаемые популяции
В исследование вошли беременные с установленным диагнозом ГСД. С целью изучения особенностей развития ГСД на разных сроках гестации все пациентки были разделены на 2 группы: 1-ю группу составили беременные, которым диагноз был установлен в рамках 1-й диагностической фазы скрининга, согласно действующим в нашей стране клиническим рекомендациям, на сроке <24 нед гестации (n=65); во 2-ю группу вошли беременные, у которых ГСД был выявлен в рамках 2-й диагностической фазы, на сроке ≥24 нед гестации (n=26).
Критерии включения: самостоятельно наступившая беременность; возраст женщины 18–45 лет; установленный диагноз «гестационный сахарный диабет» в соответствии с действующими клиническими рекомендациями; одноплодная беременность; подписанная форма информированного согласия.
Критерии исключения: сахарный диабет, диагностированный до беременности; манифестный сахарный диабет, выявленный во время текущей беременности; многоплодная беременность; тяжелая сопутствующая патология.
Критерии прекращения участия в исследовании: отказ от продолжения участия в исследовании; прерывание беременности на сроке менее 20 нед гестации.
Способ формирования выборки из изучаемой популяции
Исследуемая группа была сформирована методом случайной выборки.
Дизайн исследования
Выполнено одноцентровое динамическое проспективное сравнительное неконтролируемое исследование.
Описание медицинского вмешательства
Всем пациентам проводился спектр диагностических мероприятий, включавший общеклиническое обследование (сбор анамнеза по основной и сопутствующей патологии, оценка антропометрических данных (масса тела, рост, ИМТ при постановке на учет по беременности, гестационная прибавка массы тела за период беременности), анализ первичной медицинской документации (амбулаторные карты беременных)).
Для оценки состояния инкретинового ответа и секреторной способности L-клеток кишечника и α- и β-клеток островкового аппарата ПЖЖ всем включенным в исследование беременным с ГСД (n=91) проводился нагрузочный тест с определением ГПП-1, глюкагона, инсулина, С-пептида до и после смешанного завтрака (соотношение белки/жиры/углеводы (г)/ккал = 17,86/15,45/42,32 (г)/382,0 ккал).
Всем пациенткам (n=91) проводилась оценка ИР β-клеток ПЖЖ и периферических тканей путем определения индексов HOMA-β (homeostasis model assessment β) и HOMA-IR (homeostasis model assessment of insulin resistance). Модель оценки функции β-клеток (HOMA-β) представляет собой показатель секреторных возможностей инсулина, рассчитанный на основании концентрации глюкозы в плазме натощак и инсулина. Нормальная функциональная активность β-клеток ПЖЖ принята за 100%. А показатель HOMA-IR, в свою очередь, представляет собой математическую гомеостатическую модель для оценки резистентности тканей к инсулину. Условно нормальная чувствительность периферических тканей к инсулину определялась при значениях НОМА-IR<2,7 [20].
Части пациенток с ГСД из общей группы (n=50) с целью оценки гликемических профилей и анализа вариабельности гликемии, с последующим анализом взаимосвязи с гормональным профилем, выполнено мониторирование гликемии с использованием системы для флэш-мониторинга.
Методы
Забор венозной крови натощак и после нагрузки на глюкагон и ГПП-1 проводился в вакуумную пробирку с этилендиаминтетрауксусной кислотой; на инсулин и С-пептид — в пробирку с разделительным гелем и активатором свертывания. В соответствии с опубликованными данными пик секреции глюкагона и ГПП-1 при проведении тестов с нагрузкой наблюдается через 30–40 мин после приема глюкозы, а инсулина — через 120 мин [21][22]. Исходя из этого, повторная оценка ГПП-1 и глюкагона в исследовании производилась через 30 мин после приема смешанного завтрака; инсулина и С-пептида — через 120 мин после пищевой нагрузки. После взятия крови пробирки были центрифугированы на 3000 оборотах в течение 15 мин, после чего отделенная плазма была заморожена при -80 °С.
Уровни инсулина и С-пептида определялись иммунохемилюминесцентным анализом на автоматическом иммунохимическом анализаторе LIAISON XL (DiaSorin S.p.A., Италия). Единицы измерения для инсулина — мкМЕ/мл, для С-пептида — нг/мл. Глюкагон и ГПП-1 определялись путем иммуноферментного анализа с использованием наборов стандартного коммерческого набора BioVendor (ELISA, Швеция). Единицы измерения для глюкагона — пг/мл, для ГПП-1 — нг/мл.
Мониторирование глюкозы выполнено с применением системы FreeStyle Libre Flash (Abbott Diabetes Care Ltd., Witney, UK). По завершении работы датчика (через 14 дней) данные со сканера выгружались с помощью компьютерной программы FreeStyle Libre с формированием отчета о характере гликемических кривых и времени в целевом диапазоне, в диапазонах ниже и выше целевого, гликемической вариабельности (ГВ). Для оценки ГВ использованы значения глюкозы в разные временные точки, полученные по данным мониторинга, и рассчитаны следующие параметры: средний уровень гликемии, ммоль/л; MAGE (Mean Average of Glucose Excursions) — средняя aмплитуда отклонения глюкозы, включая исключительно изменения более чем на 1 стандартное отклонение в гликемических значениях; CONGA (continuous overlapping net glycemic action) — непрерывное частично перекрывающееся изменение гликемии, индекс применяется для оценки вариабельности в пределах суток — более высокие значения данного показателя отмечаются при нестабильном контроле гликемии; LI — индекс лабильности гликемии, который используется для оценки риска тяжелых гипогликемий; индекс J — индикатор качества контроля гликемии; индексы риска гипогликемии и гипергликемии (LBGI, HBGI); среднее значение суточных различий гликемии, характеризующее длительность изменчивости глюкозы, — MODD; индекс прогнозирования рисков дисгликемии (как гипо-, так и гипергликемии) — ADRR.
Статистический анализ
Накопление и систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2010 (Microsoft, США). Статистический анализ был выполнен с использованием программного пакета STATISTICA v.10 (разработчик — StatSoft.Inc, США). Для обработки данных, полученных с устройства для мониторинга гликемии, и расчета параметров вариабельности гликемии использовался электронный калькулятор EasyGV, версия 9, разработанный исследовательской группой Оксфордского университета (Великобритания) и доступный для свободного использования. Для описания количественных признаков выборки использовалось среднее значение (М) со среднеквадратическим отклонением (δ) и 95% доверительным интервалом, а признаков, распределение которых отличается от нормального, — медиана с интерквартильным размахом Me [Q1; Q3]. Качественные данные выборки описаны с указанием абсолютной и относительной частоты — n (%). Для сравнения двух независимых групп использовались непараметрические двусторонние критерии Манна–Уитни и Фишера. Для количественного описания тесноты связи между признаками проводился корреляционный анализ по Спирмену. Для сравнения двух зависимых групп признаков использовался биномиальный критерий. Критическим уровнем значимости считали 0,05.
Этическая экспертиза
Работа одобрена локальным этическим комитетом ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (протокол заседания № 186 от 26 июня 2019 г.). Все участники перед выполнением исследования ознакомились и подписали информированное согласие на участие в процедурах исследования.
Результаты
Общая численность беременных женщин с ГСД, включенных в исследование, составила 91. Средний возраст включенных в исследование женщин составил 32,1±5,6 (95% ДИ 30,9; 33,2) года. Большинство беременных при постановке на учет имели нормальный ИМТ (медиана составила 23,3 [ 20,7; 27,7] кг/м²) и массу тела (63,2 [ 55; 74] кг). Ожирение было отмечено лишь у 14,3% женщин, но в 36,6% случаев фиксировался избыточный вес (ИМТ≥25 кг/м²). Гестационная прибавка веса в общей выборке не превышала общепопуляционные рекомендованные цифры, медиана значений в общей группе составила 11,0 [ 8; 15] кг. В большинстве случаев диагноз ГСД выставлялся в I (53%) или II (40%) триместре беременности на основании превышения пороговых значений гликемии натощак, медиана срока гестации на момент установки диагноза составила 12 [ 8; 24] нед. Медиана уровня глюкозы венозной плазмы натощак на момент постановки диагноза ГСД составила 5,3 [ 5,2; 5,7] ммоль/л, HbA1c — 5,3 [ 5,1; 6,0]%. У 55% женщин текущая беременность была повторной, в 45% случаев ГСД развивался у первобеременных.
Обе группы беременных с разным сроком развития заболевания (группа 1 — менее 24 нед гестации (n=65); группа 2 — ≥24 нед гестации (n=26)) были сопоставимы по возрасту, массе тела и уровню гликемии на момент установления диагноза. Сравнительная характеристика групп представлена в табл. 1.
Таблица 1. Сравнительная характеристика групп беременных
с разным сроком развития гестационного сахарного диабета
|
Параметр |
Группа 1 |
Группа 2 |
Значение р, U-test |
|
Me [ Q1; Q3] |
|||
|
Возраст, лет |
33,0 [ 28; 37] |
32 [ 29; 34,8] |
0,576 |
|
Вес исходный, кг |
64 [ 57; 74,2] |
61 [ 54,9; 66,8] |
0,127 |
|
ИМТ, кг/м² |
24,1 [ 20,8; 28,1] |
22,3 [ 20,8; 24,6] |
0,161 |
|
Гестационная прибавка веса, кг |
10,0 [ 8,0; 14,8] |
11,0 [ 9,5; 16,5] |
0,322 |
|
Глюкоза венозной плазмы натощак, ммоль/л |
5,3 [ 5,2; 5,7] |
5,3 [ 5,1; 5,65] |
0,226 |
|
HbA1c, % |
5,4 [ 5,1; 6,0] |
5,1 [ 4,93; 5,3] |
0,083 |
Примечание. HbA1c — гликированный гемоглобин;
ИМТ — индекс массы тела.
В анализируемой выборке не выявлено выраженной ИР, медиана значений HOMA-IR составила 1,7 [ 1,2; 2,9]. Только у 31% беременных выявлено значение HOMA-IR, равное или превышающее показатель 2,7. Медиана значений HOMA-β составила в общей группе 77,9 [ 57,8; 126,6]%. А при сравнительном анализе параметров ИР у женщин с разным сроком развития ГСД достоверной разницы в группах не выявлено как по уровню HOMA-IR (1,8 [ 1,2; 2,8] в группе раннего развития ГСД против 1,5 [ 1,1; 3,0] в группе более позднего выявления (р=0,4)), так и по значениям HOMA-β (82,4 [ 58,2; 126,6]% и 71 [ 53,9; 117,2] соответственно, р=0,5) (рис. 1).
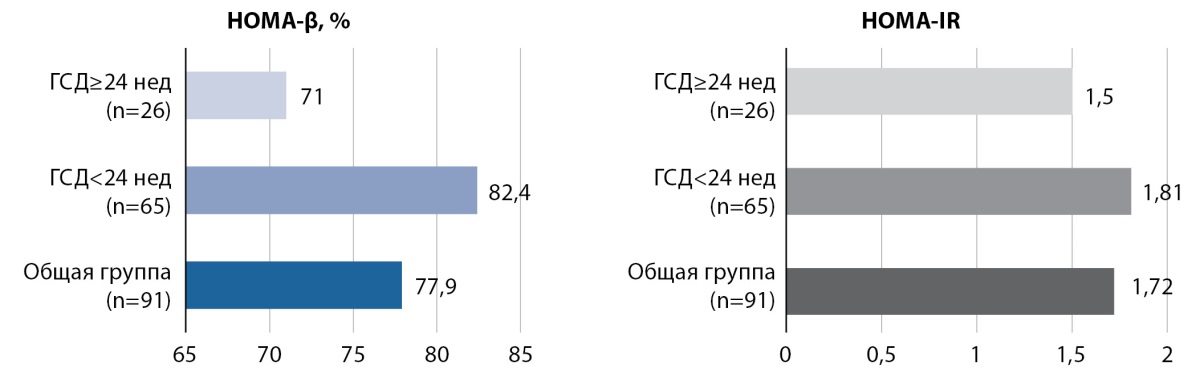
Рисунок 1. Характеристика параметров инсулинорезистентности
в зависимости от срока манифестации гестационного сахарного диабета.
Примечание. ГСД — гестационный сахарный диабет
Всем включенным в исследование беременным выполнена оценка инкретинового ответа в ходе нагрузочного пищевого теста. Полученные данные гормонального анализа представлены в табл. 2.
Таблица 2. Средние значения гормональных показателей
общей группы беременных женщин с гестационным сахарным диабетом
|
Гормональные показатели до и после стимуляции |
Значение параметра, n=91 Me [ Q1; Q3] |
|
С-пептид, нг/мл |
|
|
Базальный (0 мин) |
1,5 [ 1,2; 2,2] |
|
Стимулированный (через 120 мин) |
3,9 [ 2,97; 5,6] |
|
Инсулин, мкМЕ/мл |
|
|
Базальный (0 мин) |
7,2 [ 4,9; 12,1] |
|
Стимулированный (через 120 мин) |
19,90 [ 13,5; 33,7] |
|
Глюкагон, пг/мл |
|
|
Базальный (0 мин) |
70,1 [ 56,2; 100] |
|
Стимулированный (через 30 мин) |
61,6 [ 57,9; 77] |
|
ГПП-1, нг/мл |
|
|
Базальный (0 мин) |
1,16 [ 0,94; 1,22] |
|
Стимулированный (через 30 мин) |
1,25 [ 1,04; 2,49] |
Прмечание. ГПП-1 — глюкагоноподобный пептид-1
В результате сравнительного анализа гормонального профиля в группах получено, что базальный уровень гормонов у беременных с разным сроком развития ГСД в основном был сопоставим, за исключением исходного уровня глюкагона. Уровень глюкагона, характеризующий состояние α-клеток ПЖЖ, в группе раннего развития ГСД достоверно превышал таковой во 2-й группе: 70,9 [ 57,7; 109,2] пг/мл против 61,7 [ 46,6; 87] пг/мл соответственно (р=0,04, U-test), однако через 30 мин после нагрузки показатели практически сравнялись в обеих группах: 61,9 [ 58,5; 79,0] пг/мл и 60,9 [ 56,6; 67,7] пг/мл соответственно. Значения инсулина, С-пептида и ГПП-1 оказались сопоставимы в группах как натощак, так и на фоне пищевой нагрузки.
Для оценки особенностей динамики секреции гормонов энтероинсулярной оси на фоне пищевой нагрузки в зависимости от срока развития ГСД проведено сравнение показателей прироста гормональных показателей в группах (табл. 3).
Таблица 3. Оценка динамики гормональных показателей
на фоне нагрузочного теста в зависимости от срока развития
гестационного сахарного диабета
|
Показатели |
Δ значений Приращение Me [ Q1; Q3] |
Количество беременных, у которых значение показателя |
Достоверность прироста по группам (биномиальный критерий) |
||
|
снизилось |
увеличилось |
||||
|
Инсулин |
1-я группа |
10,9 [ 5,7; 22,2] |
3 |
62 |
p<0,0000001 |
|
2-я группа |
9,9 [ 7,3; 21,7] |
0 |
26 |
p=0,0000002 |
|
|
Значение р (U-test) |
0,930 |
||||
|
С-пептид |
1-я группа |
2,0 [ 1,16; 3,7] |
2 |
63 |
p<0,0000001 |
|
2-я группа |
2,3 [ 1,7; 3,97] |
0 |
26 |
р=0,0000001 |
|
|
Значение р (U-test) |
0,404 |
||||
|
Глюкагон |
1-я группа |
-6,3 [ -29,1; 7,3] |
39 |
26 |
р=0,071 |
|
2-я группа |
2,5 [ -11,8; 21] |
10 |
16 |
р=0,112 |
|
|
Значение р (U-test) |
0,040 |
||||
|
ГПП-1 |
1-я группа |
0,15 [ -0,08; 0,97] |
22 |
43 |
р=0,009 |
|
2-я группа |
0,6 [ -0,1; 2,1] |
10 |
16 |
р=0,211 |
|
|
Значение р (U-test) |
0,416 |
||||
Примечание. ГПП-1 — глюкагоноподобный пептид-1
Полученные данные демонстрируют статистически значимый прирост уровня инсулина и С-пептида в обеих группах. При этом степень прироста в сравниваемых группах оказалась сопоставимой (р=0,930) (рис. 2).

Рисунок 2. Сравнительная оценка секреции инсулина и С-пептида
на фоне пищевой нагрузки у беременных с разным сроком развития
гестационного сахарного диабета.
Примечание. ГСД — гестационный сахарный диабет
При анализе динамики секреции ГПП-1 установлено, что достоверным прирост оказался в 1-й группе: Δ ГПП-1 0,15 [-0,07; 0,96], p<0,01. А во 2-й группе прирост оказался недостоверным (р=0,211), хотя само значение Δ ГПП-1 было выше 0,56 [-0,1; 2,1]), что, по-видимому, обусловлено неадекватным ответом L-клеток кишечника почти у половины из них (рис. 3). У 40% женщин данной группы выявлено парадоксальное снижение ГПП-1 в ответ на пищевую нагрузку. Аналогичная тенденция к неадекватной инкретиновой реакции отмечалась и в 1-й группе, но в меньшинстве случаев (22 из 65).

Рисунок 3. Сравнительная оценка динамики секреции
глюкагоноподобного пептида 1 типа на фоне пищевой нагрузки
у беременных с разным сроком развития гестационного сахарного диабета.
Примечание. ГСД — гестационный сахарный диабет,
ГПП-1 — глюкагоноподобный пептид-1
По уровню глюкагона получена статистически значимая разница в группах не только по исходному значению, как было упомянуто выше, но и по динамике его секреции (рис. 4).

Рисунок 4. Сравнительная оценка динамики секреции глюкагона
на фоне пищевой нагрузки у беременных с разным сроком развития
гестационного сахарного диабета.
Примечание. ГСД — гестационный сахарный диабет
При этом в обеих группах беременных снижение секреции глюкагона не было статистически значимым. Более того, у значимой части женщин также отмечалось парадоксальное увеличение секреции глюкагона: почти у половины беременных в 1-й группе (26 из 65) и у большинства женщин 2-й группы (16 из 25).
Взаимосвязь гормонов энтероинсулярной оси и гликемической вариабельности
Согласно результатам суточного мониторирования гликемии с использованием устройства Freestyle libre, беременные с ГСД проводили около 16% [ 11; 31] времени ниже целевого диапазона. Время, проведенное в зоне выше целевого диапазона, было минимальным — медиана составила 1% [ 0; 4,0]. Медиана значений длительности нахождения в целевом диапазоне в общей группе составила 86% [ 68; 87]. Однако в связи с неприемлемостью использования общепринятых методов оценки амбулаторного гликемического профиля, разработанных для пациентов с СД, у беременных с ГСД на основании полученных показателей мониторинга гликемии выполнен расчет параметров гликемической вариабельности (ГВ) с оценкой наиболее часто используемых индексов. Проведен сравнительный анализ параметров ГВ у беременных в зависимости от срока манифестации ГСД. Статистически значимая разница в группах получена по показателю MAGE: 2,4 [ 1,96; 2,7] в 1-й группе против 1,95 [ 1,7; 2,1] во 2-й группе, р=0,004. По другим параметрам ГВ статистически значимой разницы между группами не выявлено (табл. 4).
Таблица 4. Сравнительный анализ параметров вариабельности гликемии
в зависимости от срока манифестации гестационного сахарного диабета
|
Коэффициент ГВ |
1-я группа n=31 |
2-я группа n=7 |
Значение р, U-test |
|
Me [ Q1; Q3] |
|||
|
Средний уровень гликемии, ммоль/л |
4,6 [ 4,3; 4,7] |
4,5 [ 4,3; 4,7] |
0,617 |
|
MAGE |
2,4 [ 1,96; 2,7] |
1,95 [ 1,7; 2,1] |
0,004 |
|
LI |
1,2 [ 0,9; 1,9] |
1,2 [ 0,8; 1,5] |
0,532 |
|
HBGI |
5,3 [ 4,3; 7,3] |
4,8 [ 3,8; 6,3] |
0,414 |
|
LBGI |
5,3 [ 4,4; 7,3] |
4,8 [ 3,8; 6,3] |
0,414 |
|
J-index |
9,5 [ 8,5; 11,6] |
9,6 [ 9,2; 9,4] |
0,926 |
|
MODD |
0,8 [ 0,8; 1,1] |
0,9 [ 0,7; 0,97] |
0,908 |
|
ADRR |
1,0 [ 0,5; 3,2] |
0,9 [ 0,5; 3,4] |
0,911 |
|
CONGA |
3,9 [ 3,7; 3,9] |
3,9 [ 3,7; 4,2] |
0,7 |
Примечание. ГВ — гликемическая вариабельность
В результате анализа взаимосвязи гормональных показателей инкретиновой оси с параметрами углеводного обмена и ГВ выявлено, что уровень базального инсулина положительно коррелирует с уровнем глюкозы в дебюте заболевания (r=0,4, p<0,05). Также выявлена положительная корреляция уровня базального инсулина с LI, который был создан специально для оценки риска тяжелых гипогликемий (r=0,3, p<0,05). В то же время установлена отрицательная корреляция показателя прироста ГПП-1 с такими клинически значимыми и изученными параметрами ГВ, как MAGE (r=-0,4, p<0,05), LI (r=-0,4, p<0,05) и J-индекс (r=0,4, p<0,05), применяющийся как индикатор качества углеводного контроля.
ОБСУЖДЕНИЕ
Общепринято, что в развитии ГСД ведущую роль играет прогрессирование ИР на фоне увеличения продукции гормонов с контринсулярной активностью, усугубляющееся воздействием таких факторов риска, как ожирение, избыточный гестационный набор массы тела, малоподвижный образ жизни и другие. При этом накопившиеся за последнее десятилетие данные демонстрируют изменение классического портрета беременной женщины с ГСД. Так, зачастую диагноз устанавливается достаточно молодым женщинам без значимых факторов риска метаболических расстройств на достаточно ранних сроках беременности, еще не характеризующихся выраженной ИР. Такая тенденция свидетельствует о возможном наличии еще неизученных механизмов гестационных углеводных расстройств.
Известно, что гомеостаз глюкозы и инсулина в организме тесно взаимосвязаны, так как реакция β-клеток на концентрацию глюкозы определяет секрецию инсулина, а инсулин, в свою очередь, регулирует уровень глюкозы в организме не только за счет ее утилизации в тканях, но и влияя на эндогенный глюконеогенез в печени. Соответственно, недостаточность инсулина может отражать сниженную реакцию β-клеток ПЖЖ на стимулирующие агенты, к которым относится не только глюкоза, но и, например, ГПП-1.
Исходя из таких предположений, в основу настоящего исследования положен поиск возможной связи между снижением инсулинпродуцирующей функции β-клеток ПЖЖ у беременных и нарушением продукции инкретинов как одних из важных стимулирующих агентов островковых клеток [23]. Однако полученные в работе уровни инсулина и C-пептида в анализируемой выборке соответствовали физиологическим концентрациям и демонстрировали удовлетворительный постпрандиальный прирост в ходе теста. Ожидаемой гиперинсулинемии и выраженной ИР в исследуемых группах не выявлено, что может объясняться изменением характеристики беременных с данным диагнозом в целом и частым выявлением заболевания на ранних сроках гестации. При сравнительном анализе показателей прироста в группах с разным сроком развития ГСД статистически значимой разницы не получено ни по динамике инсулина (р=0,9), ни по динамике C-пептида (р=0,4). Таким образом, установленные результаты не позволяют утверждать, что есть взаимосвязь срока развития ГСД с особенностями состояния β-клеток ПЖЖ, более того, в целом не подтверждают значимый вклад ИР в развитие заболевания в данной группе.
Известно, что в патогенезе СД2 ведущее место занимает гиперглюкагонемия. На сегодняшний день частично доступна информация об интерпретации значений глюкагона крови для общей популяции, так, согласно Greenspan’s Basic & Clinical Endocrinology (2018 г.) [24], нормальный уровень глюкагона для взрослых людей составляет ≤60 пг/мл, а по данным Mosby’s Diagnostic & Laboratory Test Reference [25], референсный диапазон составляет 50–100 пг/мл. В отношении беременных сведения об особенностях состояния α-клеток ПЖЖ отсутствуют, в связи с чем определение нормодиапазона для данной категории не представляется возможным. В нашем исследовании установлено, что беременные с более ранним развитием ГСД имели относительную базальную гиперглюкагонемию по сравнению с группой развития заболевания на сроке ≥24 нед. Более того, уровень глюкагона незначительно коррелировал с возрастом беременных (r=0,219, р<0,05). Полученные результаты частично согласуются с результатами исследования Т.В. Саприной и соавт. (2016 г.), по данным которого при беременности, осложненной ГСД, фиксируется более высокий базальный и стимулированный уровень глюкагона, особенно при раннем дебюте ГСД. Но следует отметить, что в указанное исследование были включены женщины только с ИМТ более 25 кг/м², что и могло определять более высокий уровень глюкагона в анализируемой когорте [23]. По нашим результатам, важной особенностью, которая потенциально может играть роль в развитии и поддержании гипергликемии у беременных, стала парадоксальная реакция α-клеток на пищевую нагрузку. Немедленное подавление секреции глюкагона в α-клетках ПЖЖ при поступлении глюкозы у здоровых людей имеет важное значение в бигормональной регуляции гликемии [26]. А в нашей работе подавление секреции глюкагона в ответ на пищевую нагрузку отсутствовало как в группе раннего развития ГСД, так и в группе более позднего начала заболевания, и, что более примечательно, у значительной части женщин отмечался постпрандиальный прирост уровня глюкагона вместо снижения. Соответственно, сохраняющаяся гиперглюкагонемия может играть роль в развитии как гипергликемии натощак, так и постпрандиальной гипергликемии при ГСД.
В качестве одной из вероятных причин отсутствия адекватного подавления глюкагона в ходе пищевой нагрузки может выступать дисбаланс в функционировании энтеропанкреатической гормональной оси, связанный с недостаточным ингибирующим влиянием ГПП-1 или других инкретинов на α-клетки ПЖЖ. Некоторые исследования подтверждают связь снижения уровня инкретиновых пептидов, таких как ГПП-1, с развитием ГСД [27]. Более того, в одной из работ была продемонстрирована отрицательная связь между высокими значениями ГПП-1 и избыточным ростом плода [28]. По полученным нами данным, беременные с ГСД характеризуются достаточно высоким уровнем базального ГПП-1 и в то же время недостаточным его приростом после пищевой нагрузки у женщин с более поздним классическим началом ГСД. Повышенный базальный уровень ГПП-1 у женщин с ГСД потенциально может быть обусловлен изменением функционального состояния L-клеток тонкого кишечника, направленным на поддержание нормогликемии у беременных, как это описано в отношении β-клеток ПЖЖ, а также может свидетельствовать о возможной резистентности тканей к действию инкретинов. Сходные результаты были получены в исследовании P. Nadkarni и соавт. [29], в котором продемонстрирован неадекватно повышенный базальный уровень ГПП-1 у женщин с ГСД по сравнению с контрольной группой. Согласующиеся с результатами нашего исследования данные также были продемонстрированы в работе L. Bonde и соавт., где было отмечено снижение постпрандиального ответа ГПП-1 у беременных с ГСД [30]. Интересно, что в указанной работе подтверждена обратимость снижения постпрандиальной секреции ГПП-1 через несколько месяцев после родоразрешения. Предположительно, это может свидетельствовать о том, что снижение инкретинового ответа развивается вторично по отношению к ИР или гипергликемии и не является основным патогенетическим дефектом в развитии ГСД [30].
При оценке гликемических профилей установлено, что в группе более раннего развития ГСД наблюдалась более выраженная ГВ, однако статистически значимой разница оказалась лишь в отношении MAGE, являющегося важным клиническим и прогностическим параметром оценки углеводного обмена. А в результате корреляционного анализа обратила на себя внимание отрицательная связь прироста ГПП-1 с MAGE, LI и J-индексом. Это может указывать на то, что более выраженная постпрандиальная секреция ГПП-1 обеспечивает более стабильный гликемический профиль и снижение ГВ, что может иметь важное значение в контроле углеводного обмена и теоретически стать новой мишенью терапевтического управления ГСД в будущем. Однако целесообразно дальнейшее более глубокое изучение данного вопроса для лучшего понимания роли нарушения секреции ГПП-1 в гестационных нарушениях углеводного обмена и возможностей воздействия на данную проблему.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате выполненного исследования установлено сохранение физиологического ответа секреции инсулина и С-пептида у беременных с ГСД в виде удовлетворительного прироста показателей после пищевой нагрузки. Отсутствие подавления глюкагона и прироста ГПП-1 после углеводной нагрузки может свидетельствовать о большем вкладе гиперглюкагонемии на фоне нарушенной инкретиновой секреции в развитие ГСД. Выявленные закономерности могут стать основанием для продолжения исследований в этом направлении, так как расширение понимания патофизиологических основ развития ГСД позволит изучить новые интервенционные возможности, направленные на профилактику ГСД и его осложнений.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Ушанова Ф.О. — концепция и дизайн исследования, набор материала, анализ, статистическая обработка и интерпретация полученных данных, написание текста; Демидова Т.Ю. — концепция и дизайн исследования, редактирование текста; Короткова Т.Н. — выполнение лабораторных исследований. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (10-й выпуск) // Сахарный диабет. — 2021. — Т. 24. — S1. — С. 1-235. doi: https://doi.org/10.14341/DM12802
2. International Diabetes Federation. IDF Diabetes Atlas, 10th edn. Brussels, Belgium: 2021 [cited 15.11.2023]. Available from: https://www.diabetesatlas.org
3. Fritsche L, Heni M, Eckstein SS, et al. Incretin hypersecretion in gestational diabetes mellitus. J Clin Endocrinol Metab. 2022;107(6):e2425-e2430. doi: https://doi.org/10.1210/clinem/dgac095
4. Hillier TA, Pedula KL, Ogasawara KK, et al. A pragmatic, randomized clinical trial of gestational diabetes screening. N Engl J Med. 2021;384(10):895-904. doi: https://doi.org/10.1056/NEJMoa2026028
5. Diabetes in pregnancy: management from preconception to the postnatal period. London: National Institute for Health and Care Excellence (NICE); 2020.
6. Gascho CLL, Leandro DMK, Ribeiro e Silva T, Silva JC. Predictors of cesarean delivery in pregnant women with gestational diabetes mellitus. Rev Bras Ginecol e Obs. 2017;39(02):060-065. doi: https://doi.org/10.1055/s-0037-1598644
7. You H, Hu J, Liu Y, et al. Risk of type 2 diabetes mellitus after gestational diabetes mellitus: A systematic review & meta-analysis. Indian J Med Res. 2021;154(1):62. doi: https://doi.org/10.4103/ijmr.IJMR_852_18
8. Daly B, Toulis KA, Thomas N, et al. Increased risk of ischemic heart disease, hypertension, and type 2 diabetes in women with previous gestational diabetes mellitus, a target group in general practice for preventive interventions: A populationbased cohort study. PLOS Med. 2018;15(1):e1002488. doi: https://doi.org/10.1371/journal.pmed.1002488
9. Carr DB, Utzschneider KM, Hull RL, et al. Gestational diabetes mellitus increases the risk of cardiovascular disease in women with a family history of type 2 diabetes. Diabetes Care. 2006;29(9):2078-2083. doi: https://doi.org/10.2337/dc05-2482
10. Tobias DK, Stuart JJ, Li S, et al. Association of history of gestational diabetes with long-term cardiovascular disease risk in a large prospective cohort of US women. JAMA Intern Med. 2017;177(12):1735. doi: https://doi.org/10.1001/jamainternmed.2017.2790
11. Lowe WL Jr, Scholtens DM, Kuang A, et. al. HAPO followup study cooperative research group. Hyperglycemia and Adverse Pregnancy Outcome Follow-up Study (HAPO FUS): Maternal gestational diabetes mellitus and childhood glucose metabolism. Diabetes Care. 2019;42(3):372-380. doi: https://doi.org/10.2337/dc18-1646
12. Rayanagoudar G, Hashi AA, Zamora J, et. al. Quantification of the type 2 diabetes risk in women with gestational diabetes: a systematic review and meta-analysis of 95,750 women. Diabetologia. 2016;59(7):1403-1411. doi: https://doi.org/10.1007/s00125-016-3927-2
13. Burlina S, Dalfrà MG, Chilelli NC, Lapolla A. Gestational diabetes mellitus and future cardiovascular risk: An update. Int J Endocrinol. 2016;2016(12):1-6. doi: https://doi.org/10.1155/2016/2070926
14. Retnakaran R. Hyperglycemia in pregnancy and its implications for a woman’s future risk of cardiovascular disease. Diabetes Res Clin Pract. 2018;145(12):193-199. doi: https://doi.org/10.1016/j.diabres.2018.04.008
15. Scholtens DM, Kuang A, Lowe LP, et al. Hyperglycemia and Adverse Pregnancy Outcome Follow-up Study (HAPO FUS): Maternal glycemia and childhood glucose metabolism. Diabetes Care. 2019;42(3):381-392. doi: https://doi.org/10.2337/dc18-2021
16. Catalano PM. Trying to understand gestational diabetes. Diabet Med. 2014;31(3):273-281. doi: https://doi.org/10.1111/dme.12381
17. Barbour LA, McCurdy CE, Hernandez TL, et. al. Cellular mechanisms for insulin resistance in normal pregnancy and gestational diabetes. Diabetes Care. 2007;30:S112-S119. doi: https://doi.org/10.2337/dc07-s202
18. Rieck S, White P, Schug J, et al. The transcriptional response of the islet to pregnancy in mice. Mol Endocrinol. 2009;23(10):1702-1712. doi: https://doi.org/10.1210/me.2009-0144
19. Deacon CF, Ahrén B. Physiology of incretins in health and disease. Rev Diabet Stud. 2011;8(3):293-306. doi: https://doi.org/10.1900/RDS.2011.8.293
20. Geloneze B, Repetto EM, Geloneze SR, et. al. The threshold value for insulin resistance (HOMA-IR) in an admixtured population IR in the Brazilian metabolic syndrome study. Diabetes Res Clin Pract. 2006;72(2):219-220. doi: https://doi.org/10.1016/j.diabres.2005.10.017
21. Herrmann C, Göke R, Richter G, et. al. Glucagon-like peptide-1 and glucose-dependent insulin-releasing polypeptide plasma levels in response to nutrients. Digestion. 1995;56(2):117-126. doi: https://doi.org/10.1159/000201231
22. Tura A, Muscelli E, Gastaldelli A, et. al. Altered pattern of the incretin effect as assessed by modelling in individuals with glucose tolerance ranging from normal to diabetic. Diabetologia. 2014;57(6):1199-1203. doi: https://doi.org/10.1007/s00125-014-3219-7
23. Саприна Т.В., Тимохина Е.С., Гончаревич О.К., и др. Состояние энтеропанкреатической гормональной системы при гестационном сахарном диабете // Сахарный диабет. — 2016. — Т. 19. — №2. — С. 150-157. doi: https://doi.org/10.14341/DM2004134-37
24. Gardner DG, Shoback D. Greenspan’s basic & clinical endocrinology. 10th ed. New York: McGraw-Hill Education; 2018.
25. Pagana KD, Pagana TJ, Pagana TN. Mosby’s diagnostic & laboratory test reference. 14th ed. St. Louis, Mo: Elsevier; 2019.
26. Forbes S, Godsland IF, Taylor-Robinson SD, et al. A history of previous gestational diabetes mellitus is associated with adverse changes in insulin secretion and VLDL metabolism independently of increased intrahepatocellular lipid. Diabetologia. 2013;56(9):2021-2033. doi: https://doi.org/10.1007/s00125-013-2956-3
27. Mosavat M, Omar SZ, Jamalpour S, Tan PC. Serum GlucoseDependent Insulinotropic Polypeptide (GIP) and Glucagon-Like Peptide-1 (GLP-1) in association with the risk of gestational diabetes: A prospective case-control study. J Diabetes Res. 2020;2020(10):1-7. doi: https://doi.org/10.1155/2020/9072492
28. Fritsche L, Heni M, Eckstein SS, et al. Incretin hypersecretion in gestational diabetes mellitus. J Clin Endocrinol Metab. 2022;107(6):e2425-e2430. doi: https://doi.org/10.1210/clinem/dgac095
29. Nadkarni P, Chepurny OG, Holz GG. Regulation of glucose homeostasis by GLP-1. Prog Mol Biol Transl Sci. 2014:(121):23-65. doi: https://doi.org/10.1016/B978-0-12-800101-1.00002-8
30. Bonde L, Vilsbøll T, Nielsen T, et al. Reduced postprandial GLP‐1 responses in women with gestational diabetes mellitus. Diabetes, Obes Metab. 2013;15(8):713-720. doi: https://doi.org/10.1111/dom.12082
Об авторах
Ф. О. УшановаРоссия
Ушанова Фатима Омариевна, к.м.н., ассистент
117997, г. Москва, ул. Островитянова, д. 1
Т. Ю. Демидова
Демидова Татьяна Юльевна, д.м.н., профессор
Scopus Author ID: 7003771623
г. Москва
Т. Н. Короткова
Короткова Татьяна Николаевна, к.м.н.
г. Москва
Дополнительные файлы
|
|
1. Рисунок 1. Характеристика параметров инсулинорезистентности в зависимости от срока манифестации гестационного сахарного диабета. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(114KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Сравнительная оценка секреции инсулина и С-пептида на фоне пищевой нагрузки у беременных с разным сроком развития гестационного сахарного диабета. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(149KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Сравнительная оценка динамики секреции глюкагоноподобного пептида 1 типа на фоне пищевой нагрузки у беременных с разным сроком развития гестационного сахарного диабета. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(110KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Сравнительная оценка динамики секреции глюкагона на фоне пищевой нагрузки у беременных с разным сроком развития гестационного сахарного диабета. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(160KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Ушанова Ф.О., Демидова Т.Ю., Короткова Т.Н. Особенности функционального состояния энтеропанкреатической гормональной системы у беременных с гестационным сахарным диабетом. Сахарный диабет. 2023;26(6):526-536. https://doi.org/10.14341/DM13049
For citation:
Ushanova F.O., Demidova T.Y., Korotkova T.N. Features of the functional state of the enteropancreatic hormonal system in pregnant women with gestational diabetes mellitus. Diabetes mellitus. 2023;26(6):526-536. (In Russ.) https://doi.org/10.14341/DM13049
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































