Перейти к:
Метформин — активатор АМФ-зависимой протеинкиназы. Известные и новые механизмы действия
https://doi.org/10.14341/DM13044
Аннотация
Метформин, известный медицинскому сообществу как препарат выбора при сахарном диабете 2-го типа, относится к группе бигуанидов и давно используется в клинической практике, демонстрируя успешные результаты лечения. Долгое время знания о фармакодинамических свойствах метформина ограничивались следующими общеизвестными механизмами: снижением гипергликемии, обусловленным повышением чувствительности периферических рецепторов к инсулину и утилизацией глюкозы клетками, торможением глюконеогенеза в печени и увеличением транспортной емкости всех типов мембранных переносчиков глюкозы, активацией фибринолиза и уменьшением содержания атерогенных липопротеидов. Исследования последних лет показывают, что спектр положительных плейотропных эффектов не исчерпывается вышеперечисленным, а молекулярные механизмы действия препарата сложнее, чем считалось ранее. В настоящей статье представлены менее известные, но не менее значимые положительные эффекты метформина, в частности, антионкогенный, противовирусный и антивозрастной. Мы акцентируем внимание на том, что первостепенным механизмом действия, благодаря которому возможна реализация практически всех благоприятных эффектов, является активация 5’-аденозинмонофосфат-активируемой протеинкиназы (АМФК). В свете современной научной информации о фармакологии препарата, а также патогенетической неопределенности термина «бигуанид» представляется справедливым и обоснованным использовать в отношении метформина более актуальную дефиницию — «активатор АМФК».
Ключевые слова
Для цитирования:
Мкртумян А.М., Маркова Т.Н., Овчинникова М.А., Иванова И.А., Кузьменко К.В. Метформин — активатор АМФ-зависимой протеинкиназы. Известные и новые механизмы действия. Сахарный диабет. 2023;26(6):585-595. https://doi.org/10.14341/DM13044
For citation:
Mkrtumyan A.M., Markova T.N., Ovchinnikova M.A., Ivanova I.A., Kuzmenko K.V. Metformin as an activator of AMP-activated protein kinase. Known and new mechanisms of action. Diabetes mellitus. 2023;26(6):585-595. (In Russ.) https://doi.org/10.14341/DM13044
Метформин, представитель класса бигуанидов, остается препаратом первой линии терапии сахарного диабета 2 типа (СД2) на протяжении многих лет. К известным механизмам антигипергликемического действия метформина относятся: ингибирование печеночного глюконеогенеза и гликогенолиза, усиление синтеза гликогена путем активации гликогенсинтазы, уменьшение инсулинорезистентности периферических тканей посредством нормализации активности тирозинкиназы инсулинового рецептора и стимуляции захвата глюкозы мембранными белками-переносчиками (GLUT-4, GLUT-1) в клетках инсулинзависимых тканей. Наряду с этим, метформин оказывает положительное воздействие на обмен липидов, снижая уровень общего холестерина, липопротеидов низкой плотности и триглицеридов [1]. Исследования D.K. Nagi и соавт. показали, что лечение метформином ассоциировано с улучшением фибринолитических свойств крови за счет подавления активности ингибитора активатора тканевого плазминогена (PAI-1) [2]. Вышеперечисленные эффекты метформина общеизвестны и приведены в официальной инструкции к препарату, однако современная научная литература описывает широкий спектр других патологических состояний, при которых метформин оказывает благоприятное влияние. В частности, установлено антионкогенное действие [3]; увеличивается доказательная база в пользу противовирусного и антивозрастного эффектов [4][5]. Продемонстрировано снижение риска остеопоротических переломов и улучшение функции миокарда у пациентов с СД2, получающих метформин [6][7]. Опубликован ряд научных работ об успешном использовании метформина в качестве адъювантной терапии при метаболическом синдроме, туберкулезе, синдроме поликистозных яичников и поликистозной болезни почек [8–10]. Такое множество и богатое разнообразие эффектов побуждают задаться вопросом: какой же непосредственный механизм действия лежит в основе вышеуказанных клинических достижений? Отражает ли хрестоматийное понятие «бигуанид» реальную фармакодинамику препарата, наподобие таких дефиниций противодиабетических классов, как ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) или агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1)? В результате ряда доклинических исследований были выявлены более тонкие молекулярные пути реализации плейотропных эффектов метформина. «Дирижером», который направляет, регулирует эти внутриклеточные процессы, является АМФ-зависимая протеинкиназа (АМФК). Стоит отметить, что некоторые зарубежные авторы при описании метформина начинают использовать термины: «агонист АМФК», «активатор АМФК» [11][12], которые, на наш взгляд, крайне точно и емко отражают актуальный на сегодня механизм действия препарата в отношении практически всех положительных эффектов. В рамках данной статьи остановимся на трех из них.
АНТИОНКОГЕННОЕ ДЕЙСТВИЕ МЕТФОРМИНА
На протяжении десятилетий связь СД2 и рака остается предметом многочисленных дискуссий и научных исследований. Первые доказательства этой связи были опубликованы в 1960-х годах на основании популяционных исследований [13]. К настоящему времени установлено, что СД2 ассоциирован с более высоким риском развития рака печени, поджелудочной железы, эндометрия, толстой и прямой кишки, молочной железы и мочевого пузыря [14]. Поэтому краеугольным камнем стоит вопрос своевременной и эффективной профилактики злокачественных новообразований в данной популяции. Особый интерес представляет метформин, показавший в ряде исследований влияние на онкогенез (табл. 1).
Таблица 1. Исследования, оценивающие эффекты метформина
у пациентов с различными видами рака
|
Вид рака |
Авторы |
Дизайн исследования |
Цель исследования |
Число пациентов |
Основные результаты |
Оценка результата |
|
Рак молочной железы |
R.T. Chlebowski [15] |
Когортное исследование из числа участников клинических испытаний «Инициативы по охране здоровья женщин» (наблюдение в течение 11,8 года) |
Оценить связь между заболеваемостью раком молочной железы у женщин с СД2, принимающих метформин и не принимающих метформин |
68 019 женщин 50–79 лет (в том числе 3401 с СД2, из них 556 получали метформин), за время наблюдения – 3273 случая диагностированных инвазивных форм рака молочной железы |
По сравнению с женщинами без СД2 заболеваемость раком молочной железы у женщин с СД2 различалась в зависимости от принимаемого противодиабетического препарата (P=0,04). Женщины с СД2, не получавшие метформин, имели более высокую заболеваемость раком молочной железы (отношение рисков (ОР) 1,16; 95% доверительный интервал (ДИ) 0,93–1,45), а женщины с СД2, получавшие метформин, имели более низкую заболеваемость раком молочной железы (ОР 0,75; 95% ДИ 0,57–0,99). Связь наблюдалась для опухолей, положительных как по рецептору эстрогена (ER), так и по рецептору прогестерона (PgR), и для опухолей, отрицательных по рецептору HER2 |
Позитивный эффект |
|
Рак молочной железы |
P.J. Goodwin [16] |
Рандомизированное плацебо-контролируемое двойное слепое исследование в период с августа 2010 г. до октября 2020 г. (Канада, Швейцария, США и Великобритания) |
Первичная конечная точка: инвазивная безрецидивная выживаемость при раке молочной железы, положительном по гормональным рецепторам |
3649 женщин без СД2 с неметастатическим раком молочной железы высокого риска, получавших стандартную терапию (1824 принимали метформин 850 мг) |
Частота случаев инвазивной безрецидивной выживаемости составила 2,78 на 100 пациенто-лет в группе метформина по сравнению с 2,74 на 100 пациенто-лет в группе плацебо (ОР 1,01; 95% ДИ 0,84–1,21; P=0,93), а уровень смертности составил 1,46 на 100 пациенто-лет в группе метформина против 1,32 на 100 пациенто-лет в группе плацебо (ОР 1,10; 95% ДИ 0,86–1,41; P=0,47). Среди пациентов с ER/PgR-, наблюдаемых в среднем в течение 94,1 месяца, частота случаев безрецидивной выживаемости составила 3,58 против 3,60 на 100 пациенто-лет соответственно (ОР 1,01; 95% ДИ 0,79–1,30; Р=0,92) |
Нейтральный эффект |
|
Рак молочной железы |
Hee Jeong Kim [17] |
База данных Медицинского центра Асан в период с 1997 г. по 2007 г. (случай-контроль) |
Оценить связь использования метформина с выживаемостью пациенток с СД2 и раком молочной железы в зависимости от подтипа рака молочной железы и системного лечения |
6967 женщин с диагностированным раком молочной железы (6581 без СД2, 202 с СД2, получавших метформин, 184 с СД2, не получавших метформин) |
В анализе Каплана–Мейера группа пациентов с СД2, получающих метформин, имела лучшую общую и онкоспецифическую выживаемость по сравнению с группой без метформина (P<0,005). Не выявлено различий в выживаемости между группой без диабета и группой с СД2 на метформине. В многофакторном анализе группа, не получавшая метформин, имела тенденцию к более высокому риску метастазирования (ОР 5,37; 95% ДИ 1,88–15,28) и смерти от рака молочной железы (ОР 6,51, 95% ДИ 1,88–15,28) при гормон-рецептор+ и HER2- раке молочной железы по сравнению с группой на метформине. Выявлено значительное преимущество метформина в отношении выживаемости группы пациентов с СД2, получавших химиотерапию и эндокринную терапию (ОР для безрецидивной выживаемости 2,14; 95% ДИ 1,14–4,04), в отличие от группы пациентов с СД2, не получавших эти виды лечения |
Позитивный эффект |
|
Колоректальный рак |
Zhi-Jiang Zhang |
База данных PubMed и SciVerse Scopus в период с января 1966 г. по март 2011 г. (2 случай-контроль и 3 ретроспективных когортных исследования в Китае, Корее, Великобритании) |
Изучить связь между терапией метформином и заболеваемостью колоректальным раком (в 4 исследованиях) и колоректальной аденомой (в 1 исследовании) |
108 161 пациентов с СД2 |
Терапия метформином ассоциирована с более низким риском развития колоректального новообразования, а именно колоректальной аденомы и колоректального рака (ОР 0,63; 95% ДИ 0,50–0,79; P<0,001). В 4 исследованиях, включающих 107 961 пациента с СД2 и 589 случаев колоректального рака в исходе наблюдения, терапия метформином была связана с более низким риском развития колоректального рака (ОР 0,63; ДИ 0,47–0,84; P=0,002). Не выявлено существенной гетерогенности между пятью исследованиями (Q=4,86; P=0,30; I 2=18%) |
Позитивный эффект |
|
Рак печени |
Siddhart Singh [19] |
Метаанализ обсервационных исследований (база данных Medline, EMBASE и Web of Science) |
Оценить влияние метформина, тиазолидиндионов, производных сульфонилмочевины (СМ) и/или инсулина на риск развития гепатоцеллюлярной карциномы (ГЦК) |
334 307 с СД2 (650 случаев ГЦК) |
Выявлено снижение частоты развития ГЦК на 50% при применении метформина (n=8 исследований; ОШ 0,50; 95% ДИ 0,34–0,73), повышение частоты развития ГЦК на 62 и 161% при применении препаратов СМ (n=8 исследований; ОШ 1,62; 95% ДИ 1,16–2,24) и инсулина (n=7; ОШ 2,61; 95% ДИ 1,46–4,65) соответственно. Прием тиазолидиндионов не влиял на риск развития ГЦК (n=4; ОШ 0,54; 95% ДИ 0,28–1,02). Между исследованиями наблюдалась значительная гетерогенность, что частично объяснялось условиями исследования, местом и тем, были ли исследования скорректированы с учетом одновременного использования других противодиабетических препаратов |
Позитивный эффект |
|
Рак эндометрия |
E.M. Ko |
Ретроспективный когортный анализ в период с 2005 по 2010 гг. |
Исследовать связь приема метформина с исходами рака эндометрия (время до рецидива, безрецидивная выживаемость (БРВ), общая выживаемость (ОВ)) |
1495 с раком эндометрия (363 с СД2, из них 54% получают метформин) |
В группе метформина выявлена более высокие БРВ и ОВ. В группе без метформина БРВ в 1,8 раза хуже (95% ДИ 1,1–2,9, р=0,02), ОВ в 2,3 раза хуже (95% ДИ 1,3–4,2, р=,005) с учетом поправки на возраст, стадию, класс, гистологию и адъювантное лечение. Использование метформина не влияло на время до рецидива — по мнению авторов, из-за снижения общей смертности |
Позитивный эффект |
Приведенный выше перечень исследований не является исчерпывающим. Научная база регулярно пополняется новыми публикациями, в связи с чем важно упомянуть и об отечественных ученых, вносящих немалый вклад в изучение противоопухолевых эффектов метформина. Так, многолетние научные труды Л.М. Берштейна и соавт. в области клинической онкологии посвящены исследованию точек приложения метформина как противоопухолевого агента (в особенности механизму активации АМФК), феномену приобретенной резистентности к метформину при некоторых видах рака, а также генетическим полиморфизмам, связанным с положительным ответом на метформин [21][22].
Лежащие в основе патогенеза СД2 инсулинорезистентность и гиперинсулинемия играют ключевую роль в канцерогенезе, поскольку инсулин, являющийся анаболическим гормоном, способен напрямую воздействовать на эпителиальные ткани, стимулируя рост и пролиферацию клеток [23], а также опосредованно влиять на уровни других потенциально онкогенных модуляторов, таких как инсулиноподобный фактор роста-1 (ИФР-1), фактор роста эндотелия сосудов (VEGF) и другие факторы роста, половые гормоны, провоспалительные цитокины [23][24]. Поэтому неудивительно, что у препарата, снижающего инсулинорезистентность и гиперинсулинемию, — метформина — выявлено антионкогенное действие. Ряд исследователей, например A.M. Gonzalez-Angulo и M. Cejuela, предлагают классифицировать данный противоопухолевый механизм как непрямой, или инсулинзависимый [23][25]. Вместе с тем принципиальная роль отводится прямому, или инсулиннезависимому, механизму действия. Основные звенья канцерогенеза и мишени метформина (как препарата-антионкогена) суммированы на рис. 1.

Рисунок 1. Противоопухолевые эффекты метформина.
Адаптировано из [23].
Примечание. АМФК — 5’-аденозинмонофосфат-активируемая протеинкиназа,
АФК — активные формы кислорода,
mTOR — мишень рапамицина млекопитающих.
Итак, непрямое действие метформина заключается в снижении концентрации инсулина в крови и впоследствии уровня ИФР-1, регулирующего рост и дифференцировку клеток, апоптоз и злокачественную трансформацию. Поскольку экспрессируются рецепторы к инсулину и ИФР-1 во многих тканях, метформин опосредует снижение влияния данных агентов на пролиферативный статус и жизненный цикл практически каждой клетки организма [23]. Снижение взаимодействия инсулина и ИФР-1 со своими рецепторами на поверхности клеток ограничивает активацию важнейших внутриклеточных сигнальных путей: PI3K/AKT/mTOR и RAS/RAF/MAPK. Именно эти пути считаются ответственными за инициацию и прогрессирование опухолевого процесса [26]. Молекулярные механизмы антионкогенного действия метформина, описанные в настоящем разделе, схематично представлены на рис. 2.
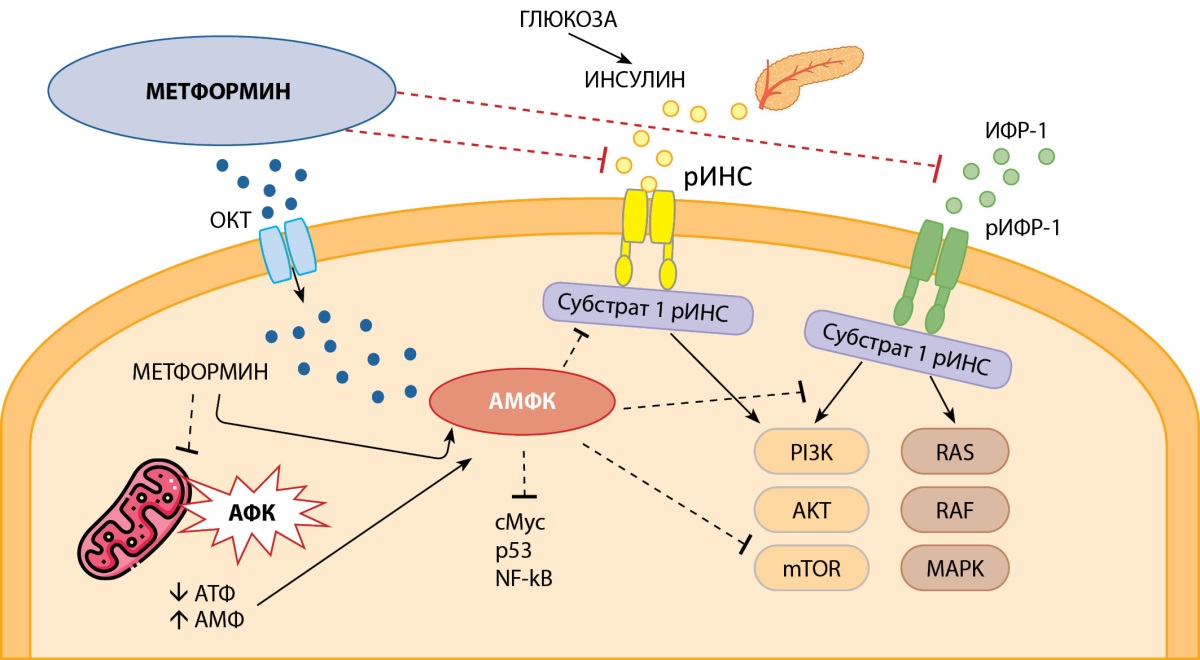
Рисунок 2. Внутриклеточные пути противоопухолевого действия метформина.
Адаптировано из [23].
Примечание. ОКТ — органические катионные транспортеры,
рИНС — рецептор к инсулину, рИФР-1 — рецептор к ИФР-1,
АМФК — 5’-аденозинмонофосфат-активируемая протеинкиназа,
АФК — активные формы кислорода,
АТФ — аденозинтрифосфат,
АМФ — аденозинмонофосфат,
cMyc — белок, кодируемый протоонкогеном cMyc,
p53 — белок, кодируемый антионкогеном TP53,
NF-κB — ядерный фактор «каппа-би»,
RAS/RAF/MAPK и PI3K/AKT/mTOR — внутриклеточные белковые пути,
представляющие собой цепь одноименных белков-киназ в клетке,
сигнальный каскад которых заключается
в последовательной активации нижележащих белков;
RAS — G-белок из семейства ферментов гидролаз,
RAF — протоонкогенная серин/треонин-протеинкиназа,
MAPK — активируемая митогеном протеинкиназа,
PI3K — фосфоинозитид-3-киназа,
AKT — протеинкиназа В,
mTOR — мишень рапамицина млекопитающих.
В основе прямого действия метформина лежит стимуляция главного «энергетического датчика» клетки — АМФК [27]. Последующий запуск АМФК-зависимых внутриклеточных путей вызывает мощное подавление мишени рапамицина млекопитающих (mTOR) [28]. Поскольку комплекс mTOR является главным регулятором транскрипции генов и синтеза белка, а соответственно, отвечает за инициацию роста, пролиферацию и дифференцировку клеток, активация АМФК приводит к угнетению опухолевого процесса [26][28]. Кроме того, работа киназы стабилизирует активность транскрипционного фактора p53 — одного из опухолевых супрессоров [29], а также подавляет экспрессию протоонкогена cMyc [30], что также замедляет онкогенез. Примечательно, что для клеток злокачественных новообразований характерно выраженное снижение АМФК–активности [30]. Другой не менее важный антионкогенный путь заключается в ингибировании метформином комплекса I дыхательной цепи переноса электронов в митохондриях [31]. Это приводит к дефициту энергетических запасов в клетке и запускает митохондриальный оксидативный стресс, в ходе которого активные формы кислорода (АФК) повреждают ДНК опухолевой клетки [27]. Особое внимание исследователи уделяют влиянию АМФК на опухолевый метаболизм, в частности на присущий многим раковым клеткам «эффект Варбурга» [32]. Суть данного эффекта заключается в том, что даже в аэробных условиях опухолевая клетка активно использует гликолиз для энергообеспечения. Характерная для рака инактивация АМФК способствует растормаживанию индуцируемого гипоксией фактора-1α (HIF-1α) и метаболическому сдвигу в сторону «эффекта Варбурга» [30][32]. Высокоскоростной гликолиз стимулирует рост опухоли в связи с повышенным образованием предшественников липидов, аминокислот и нуклеотидов, а образующийся в большом количестве лактат приводит к закислению внеклеточной среды, создавая благоприятные условия для опухолевой инвазии, метастазирования, уклонения раковых клеток от надзора иммунной системы [30]. Активация АМФК, в свою очередь, вынуждает клетку к переходу от быстрого «гликолитического» образования АТФ к более медленному окислительному фосфорилированию, используемому здоровыми клетками в состоянии покоя (G0-фаза клеточного цикла), что губительно для опухолевого генеза [30][33]. Несмотря на богатую научную базу, интерес ученых к изучению молекулярных механизмов действия метформина только растет. В частности, недавно проведенные исследования раскрывают совершенно новые звенья противоопухолевого действия метформина. Например, установлено, что метформин активирует путь АМФК/SIRT1 (сиртуин 1)/NF-κB (ядерный фактор «каппа-би»), приводящий к запуску работы caspase-3 (каспазы-3) и расщеплению белка GSDME (газдермина Е). Конечный метаболит газдермина Е образует многочисленные поры в плазматической мембране раковой клетки, что обусловливает ее гибель посредством пироптоза [34]. Авторы сообщают, что в будущем данное открытие может привести к использованию метформина в терапии GSDME-экспрессирующих опухолей различной локализации.
Таким образом, прямые и непрямые механизмы антипролиферативной, антиангиогенной и, как следствие, антиканцерогенной активности метформина в первую очередь обусловлены активацией АМФК. К настоящему моменту собрана обширная научная база в поддержку использования метформина в качестве «активатора АМФК», как одного из составляющих многокомпонентной терапии рака. Дальнейшее изучение механизмов действия препарата представляется крайне перспективным в отношении разработки новых подходов к профилактике и лечению онкологических заболеваний.
ПРОТИВОВИРУСНОЕ ДЕЙСТВИЕ МЕТФОРМИНА
Известно, что предшественник метформина, прогуанил, в 1948 г. был одобрен FDA как препарат для лечения малярии. В поисках других противомалярийных препаратов прогуанил был модифицирован до метформина [35]. С 1950-х годов по 2019 г. имеются данные единичных исследований, в которых изучалась возможность применения метформина при лечении ряда других инфекционных заболеваний, в частности вирусного гриппа [36], вирусного гепатита В и С [37–40], ВИЧ [41], Staphylococcus aureus и Pseudomonas aeruginosa [42]. В декабре 2019 г. появились данные о новом опасном вирусном заболевании — COVID-19, которое впоследствии распространилось по всему миру и привело к объявлению пандемии в марте 2020 г. На сегодняшний день известно, что факторами риска летального исхода от COVID-19 являются возраст, пол и наличие сопутствующих заболеваний, наиболее значимыми из которых являются артериальная гипертензия, СД2 и сердечно-сосудистые заболевания [43]. Вышеуказанное привело к анализу безопасности и эффективности исходной терапии сопутствующих заболеваний, в том числе сахароснижающих препаратов. Результаты ряда исследований выявили статистически достоверный положительный эффект метформина на тяжесть течения и летальность от COVID-19 [44]. Так, например, в августе 2021 г. были опубликованы данные крупного метаанализа, проведенного Han T., Ma S., Sun C. и соавт., в который включили 66 914 участников с положительным результатом теста на наличие SARS-CoV-2, где у пациентов с СД2 предшествующее применение метформина снизило риск смертности на 38% (объединенное ОШ=0,62; 95% ДИ 0,50–0,76, р=0,000, I ²= 77,6%) в сравнении с другими сахароснижающими препаратами [45]. Ранее в июле 2021 г. медицинскому сообществу представили ретроспективное исследование C.T. Bramante и соавт. с участием 9555 человек с инфекцией COVID-19 и избыточной массой тела или ожирением (ИМТ>25 кг/м²) со следующими результатами: в группе, принимавшей метформин, выявили значимое снижение смертности от COVID-19 (ОР=0,32; ДИ 0,15–0,66, p=0,002) и снижение числа госпитализаций по поводу COVID-19 (ОР=0,78; 95% ДИ 0,58–1,04; p=0,087) [46]. Также C.T. Bramante и соавт. было проведено рандомизированное клиническое исследование (РКИ), в котором оценивалось влияние метформина, ивермектина и флувоксамина на частоту госпитализаций и смертность у пациентов с COVID-19 (включено 1323 пациента): получено значительное преимущество только у метформина (ОШ для метформина 0,58; 95% ДИ 0,35–0,94]) [47]. В 2020 г. в России М.В. Шестаковой и соавт. выполнен ретроспективный анализ, включивший пациентов с СД2 и перенесенными пневмонией/COVID-19, который доказал снижение летальности у пациентов, принимавших метформин (OR=0,26; 95% ДИ 0,14−0,5; p<0,0001) [48]. Годом позже Т.Н. Марковой и А.А. Пономаревой представлены данные ретроспективного анализа влияния применяемых до госпитализации по поводу COVID-19 сахароснижающих препаратов: метформин снижал риск летального исхода в 3,6 раз, в то время как использование других групп сахароснижающих препаратов не выявило статистически значимых результатов [49].
Вышеуказанные результаты подтверждаются в ряде других исследований (C. Kan, A. Lukito, C. Kow), где метформин также снижал риск летального исхода у госпитализированных больных с COVID-19 [50–52]. Y. Li со своей командой провели метаанализ 28 исследований, оценивающих связь между использованием метформина и исходами у пациентов с COVID-19, в том числе в домах престарелых. Метформин показал уменьшение риска смертности на 34% и госпитализации на 27% [53]. W. Yang и соавт. в метаанализе 17 исследований выявили, что прием метформина ассоциирован со снижением смертности (OР=0,64; 95% ДИ=0,51–0,79) и тяжести течения COVID-19 (OР=0,81; 95% ДИ 0,66–0,99) [54].
В соответствии с вышеизложенным, к 2023 г. накоплено большое количество научных данных в пользу эффективности метформина против SARS-COV-2 и других инфекционных агентов. Для понимания противовирусного эффекта метформина рассмотрим механизм проникновения и размножения вируса в клетках хозяина. SARS-COV-2 связывается с помощью белка шипа [S] с ангиотензинпревращающим ферментом 2 (AПФ2) клеток человека, в результате чего происходит рецептор-зависимый эндоцитоз. Процесс репликации вируса напрямую зависит от вновь синтезированных фосфолипидов и реконструированных мембранных везикул клеток хозяина. Для этого SARS-CoV-2 повышает сигнальную активность PI3K/AKT/mTOR/S6K, что увеличивает выработку липидных анаболических ферментов: синтазу жирных кислот и ацетил-КоА-карбоксилазу. Впоследствии повышается синтез пальмитата, который используется для пальмитоилирования белков и дальнейшего превращения в более сложные липиды, использующиеся для построения вирусных оболочек и органелл репликации; собранные вирионы высвобождаются путем экзоцитоза. Связывание SARS-CoV-2 с АПФ2 и снижение его доступности для лиганда создает дисбаланс в ренин-ангиотензин-альдостероновой системе (РААС), приводя к гиперактивации оси AngII/AT1R и запуску воспалительного процесса, опосредованного активацией NF-κB. В результате увеличивается синтез и секреция провоспалительных цитокинов: фактора некроза опухоли-альфа (TNFα), интерлейкина-6 (IL-6), интерлейкина-1 (IL-1), интерлейкина-1 бета (IL-1β) [4][55].
Ключевая роль в противовирусном действии метформина отводится активации АМФК. Конформационные изменения мембранного белка АПФ2 в связи с фосфорилированием по Ser 680 приводят к ингибированию прикрепления вируса к плазматической мембране клеток. Другим немаловажным эффектом является выключение внутриклеточного мультимолекулярного сигнального комплекса — мишени рапамицинового комплекса 1 (mTORC1), что приводит к остановке процесса клеточной трансляции. Также АМФК фосфорилирует фермент, снижающий активность ацетил-КоА-карбоксилазы, что приводит к подавлению синтеза пальмитата и последующему замедлению сборки вириона. Дополнительный противовирусный механизм метформина заключается в воздействии на вакуолярную АТФазу и Na+/H+-обменники эндосом клеток, что увеличивает клеточный и эндосомальный pH и подавляет созревание вириона.
В литературе описано иммуномодулирующее действие метформина, которое также опосредуется активацией АМФК. Ингибирование mTORС1, снижение синтеза пальмитата и активности NF-κB, уменьшение вирусозависимого гликолиза и окислительного стресса приводит к подавлению моноцитарно-макрофагальной дифференцировки, усилению дифференцировки Т-клеток в регуляторные Т-клетки и Т-клетки памяти, снижению активации генов, кодирующих ряд провоспалительных цитокинов и молекул клеточной адгезии, увеличению продукции интерферонов (данное действие наблюдается и при других вирусных инфекциях, вызываемых флавивирусами [56], вирусом гепатита В (HBV) [37][40], вирусом Коксаки В3 [57]). За счет ингибирования митохондриальной генерации АФК метформином блокируется высвобождение Ca2+ из эндоплазматического ретикулума и поступление Ca2+ через CRAC-канал, что предотвращает Ca2+-опосредованное высвобождение IL-6 [4][35][55][58]. Вышеуказанные противовирусные эффекты метформина представлены на рис. 3.
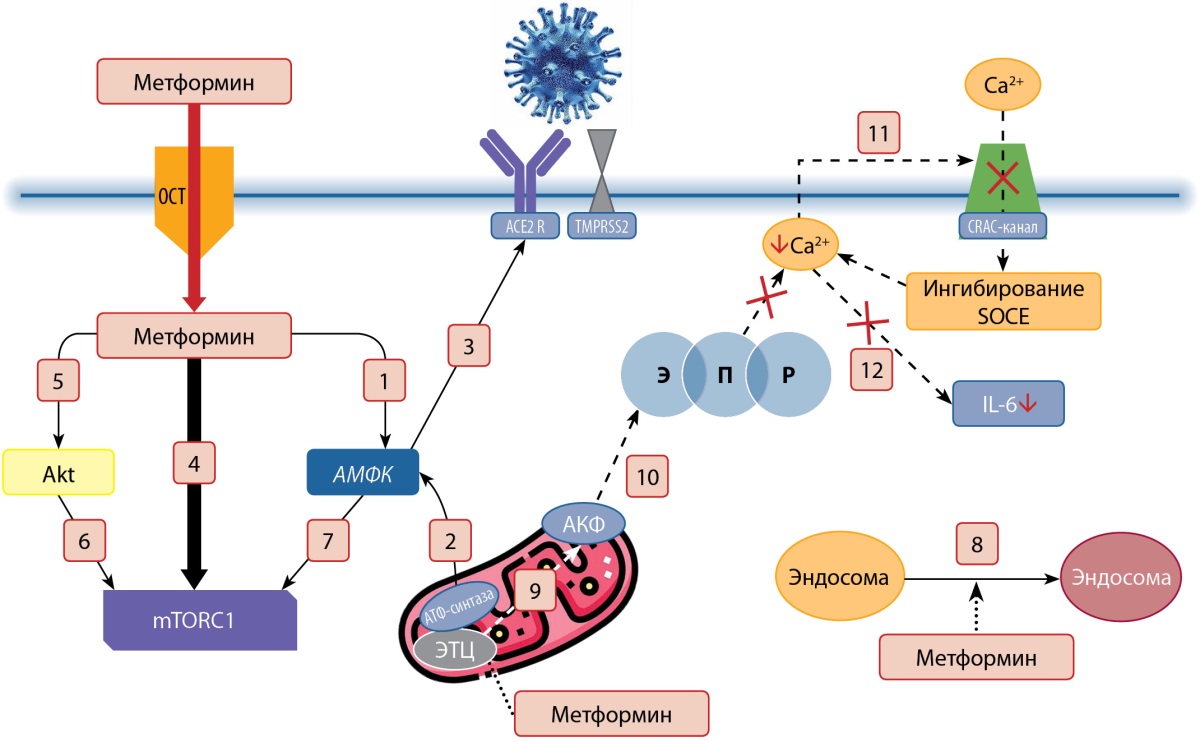
Рисунок 3. Противовирусное действие метформина.
Адаптировано из [4].
Примечание.
1. Активация АМФК;
2. Активация АМФК за счет ингибирования дыхательного комплекса 1 ЭТЦ;
3. Ингибирование связывания вируса с АПФ2;
4. Прямое ингибирование mTORC1;
5. Ингибирование Akt;
6, 7. Ингибирование mTORC1;
8. Увеличивает рН эндосомы и снижает репликацию и созревание вируса;
9. Ингибирование митохондриальной генерации АФК;
10. Предотвращение выхода Са2+ из ЭПР под действием АФК;
11. Ингибирование поступления Са2+ через CRAC-канал;
12. Предотвращение Са2+-опосредованного высвобождения IL-6.
Примечание:
ЭТЦ — электрон-транспортная цепь,
АПФ2 (ACE2) — ангиотензинпревращающий фермент 2,
ACE2 R — рецептор АПФ2,
mTORC1 — мишень рапамицинового комплекса 1,
АФК — активные формы кислорода,
ЭПР — эндоплазматический ретикулум,
IL-6 — интерлейкин-6,
SOCE — депо-управляемый вход кальция,
Akt — протеинкиназа В,
OCT — органические катионные транспортеры,
TMPRSS2 — мембраносвязанная сериновая протеаза,
CRAC-канал — кальциевый канал, активируемый высвобождением кальция.
Изучается роль метформина в лечении других инфекционных заболеваний. Доказано, что данный препарат играет роль адъюванта при элиминации HBV: прием в комбинации с интерфероном-α2b или ламивудином усиливает противовирусное действие последних. Важно отметить, что этот эффект также обусловлен запуском АМФК, который приводит к снижению экспрессии маркеров активации клеток иммунной системы (CD69, CD71, CD80, CD86) и активации В-клеток, уменьшению экспрессии поверхностного антигена HBV и репликации HBV in vitro [37][40].
Кроме того, метформин оказывает положительное влияние у пациентов с инсулинорезистентностью, которые получают специфическую терапию по поводу вирусного гепатита С. Известно, что резистентность к инсулину является независимым фактором, обусловливающим неполный ответ на лечение пегинтерфероном в сочетании с рибавирином, что снижает чувствительность к интерферону, индуцирует секрецию провоспалительных цитокинов и способствует прогрессированию стеатоза и фиброза печени, что еще больше снижает доступность препаратов против вируса гепатита С (HCV). В одном из РКИ (TRIC-1) изучалась роль метформина как адъювантного агента при лечении гепатита C в дополнение к стандартной терапии. Так, доказано, что у женщин, инфицированных HCV (генотип 1) и имеющих индекс инсулинорезистентности (HOMA-IR) >2, которые получали метформин, наблюдалось большее снижение вирусной нагрузки в течение первых 12 недель терапии и устойчивый противовирусный ответ по сравнению с женщинами, получавшими плацебо [38][39][59].
В дополнение к вышесказанному стоит отметить, что метформин показал противомикробное действие в отношении Trypanosomasis cruzi [60]. In vitro препарат проявляет активность против Trichinella spiralis, Staphylococcus aureus и Pseudomonas aeruginosa [42], вирусов Денге и Зика [56].
Таким образом, на сегодня не вызывает сомнения, что метформин обладает как противовирусным, так и иммуномодулирующим эффектом, что приводит к более легкому течению вирусных заболеваний и лучшему ответу на специфическую терапию.
АНТИВОЗРАСТНОЕ ДЕЙСТВИЕ МЕТФОРМИНА
За последние 70 лет практически во всех странах увеличивается продолжительность жизни населения. По данным ВОЗ ожидается, что к 2050 году число лиц старше 60 лет удвоится, старше 80 лет — утроится [61]. В связи с чем увеличивается интерес к препаратам, обладающим геропротективными свойствами. В настоящее время существует значительное количество исследований по антивозрастному действию метформина, которые проводились в основном на различных видах животных: нематодах (C. elegans), насекомых (Drosophila melanogaster) и грызунах. Результаты данных исследований противоречивы, зависели от доз метформина, а также от вида и возраста животного, на котором проводилось исследование. Например, при изучении anti-age эффекта у нематод вида C. Elegans выявили, что метформин увеличивал продолжительность жизни посредством изменения метаболизма фолата и метионина, что биохимически имитирует ограничение калорий. Однако при отсутствии микробиоты метформин оказывал токсическое действие [62].
Известно, что одним из факторов старения клеток является повышение АФК в тканях, что снижает продолжительность жизни организма [63]. Механизм недостаточно изучен, но предполагается, что под действием метформина увеличивается количество фермента пероксиредоксина-2 (PRDX-2) что приводит к активации фактора транскрипции антиоксиданта (SKN-1), как продемонстрировано на рис. 4. Кроме того, в результате повышения уровня SIRT-3 (митохондриальной деацетилазы) происходит снижение АФК, в результате чего отмечается увеличение продолжительности жизни [64]. Исследования по антивозрастному эффекту проводились также на Drosophila melanogaster, у которых метформин приводил к активации АМФК, но продолжительность жизни ни самцов, ни самок не увеличивалась. Более того, метформин в высоких дозах оказался токсичным для данного вида животных [65]. Противоречивыми оказались результаты работы А. Martin-Montalvo и соавт., проводимой на грызунах. Самцам мышей средних лет добавляли в пищу 0,1% метформин, рассчитывая дозу по массе тела, что приводило к увеличению продолжительности жизни на 5,83% по сравнению с контрольной группой, но при увеличении дозы метформина до 1% наблюдалось токсическое действие и даже снижение продолжительности жизни на 14,4% [66].
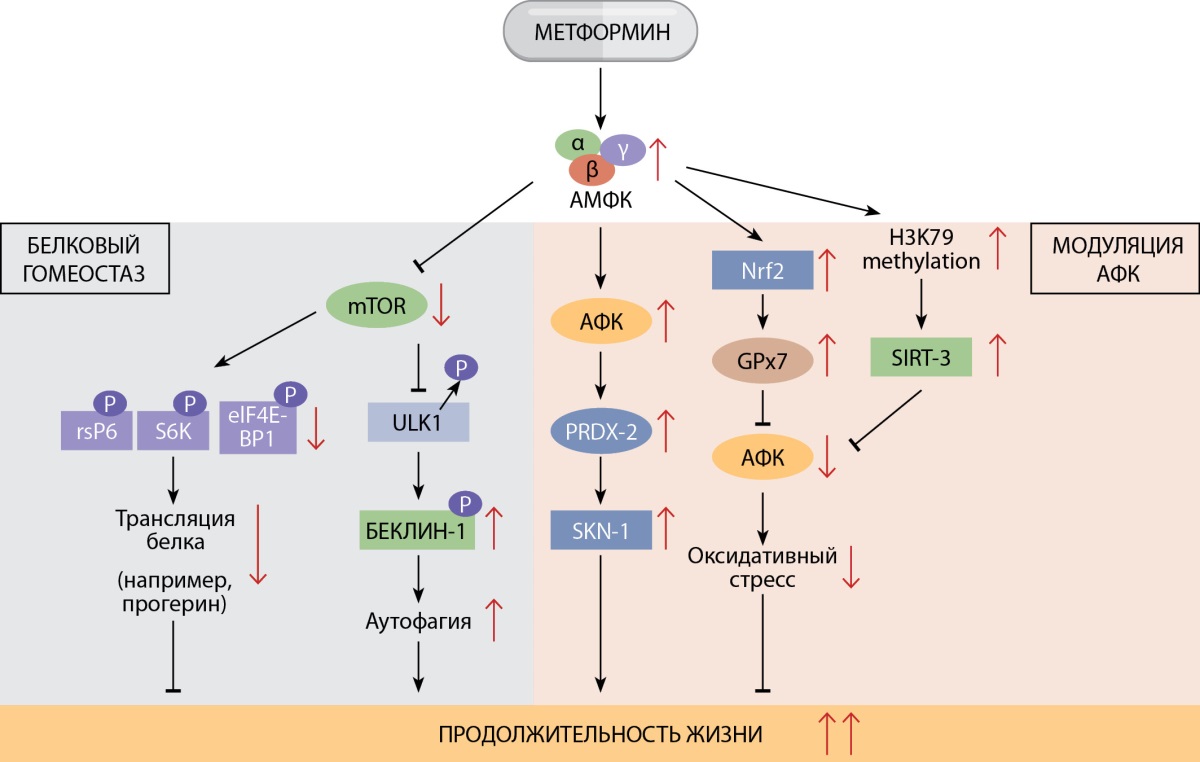
Рисунок 4. Внутриклеточные механизмы антивозрастного действия метформина.
Адаптировано из [68].
Примечание.
АМФК — 5’-аденозинмонофосфат-активируемая протеинкиназа,
АФК — активные формы кислорода,
mTOR — мишень рапамицина млекопитающих,
rsP6 — рибосомный белок S6,
S6K — киназа S6,
eIF4E-ВР1 — эукариотический фактор
инициации трансляции 4E-связывающий белок 1,
ULK1 — киназа, активирующая аутофагию,
PRDX-2 — пероксиредоксина-2,
SKN-1 — фактор транскрипции антиоксиданта,
Nrf2 — ядерный фактор 2-родственный эритроидному фактору 2,
GPx7 — глутатионпероксидаза 7,
H3K79 methylation — метилирования лизина 79 гистона H3,
SIRT-3 — сиртуин 3,
α — альфа, β — бета, γ — гамма.
Как отмечалось ранее, влияние метформина опосредовано через mTOR, что в случае anti-age эффекта приводит к подавлению фосфорилирования рибосомного белка S6 (rsP6), киназы S6 (S6K) и эукариотического фактора инициации трансляции 4E-связывающего белка 1 (eIF4E-ВР1). В результате снижается трансляция белка, в т.ч. прогерина, участвующего в патогенезе синдрома Хатчинсона–Гилфорда (прогерии), который клинически проявляется преждевременным старением [67]. Также ингибирование mTOR усиливает аутофагию за счет активации киназы (ULK1) [68]. Антивозрастной эффект метформина активно изучается и на людях, в частности предложены следующие биомаркеры репликативного клеточного старения: активность теломеразы (АТ) и длина теломера (ДТ). Известно, что ДТ при каждом делении клетки уменьшается, запуская клеточное старение, а теломераза способствует восстановлению ДТ. В исследовании Е.Н. Дудинской и соавт. доказано, что терапия метформином в комбинации с вилдаглиптином на протяжении 12 месяцев привела к повышению АТ на 45,5% в сравнении с монотерапией метформином [5].
Помимо этого, изучалось влияние метформина на развитие заболеваний, сокращающих продолжительность жизни. Еще 1998 г. британское проспективное исследование UKPDS (United Kingdom Prospective Diabetes Study) представило данные о снижении сердечно-сосудистой и общей смертности у пациентов с СД2, получавших метформин, что свидетельствует в пользу геропротективного действия препарата [69]. Спустя 44 года наблюдения за пациентами в исследовании UKPDS метформин продолжает демонстрировать значительное снижение риска микрососудистых осложнений, инфаркта миокарда и смерти от любой причины, в то время как комбинированная терапия препаратами сульфонилмочевины и инсулина показала снижение вышеуказанных рисков только на протяжении первых 10 лет лечения, впоследствии не отмечено уменьшения вероятности развития инфаркта миокарда и смерти от любой причины [70]. C.A. Bannister и соавт. использовали ретроспективные данные наблюдений из UK CPRD (United Kingdom Clinical Practice Research Datalink) за 2000 г. и доказали, что пациенты с СД2, получавшие монотерапию метформином, имели показатели выживаемости выше, чем лица без СД2 в контрольной группе, а продолжительность жизни пациентов, которые получали препараты сульфонилмочевины, напротив, оказалась меньше [71]. В ближайшем будущем планируется проведение РКИ, посвященного борьбе со старением при помощи метформина (Targeting age with Metformin, TAME). Цель данного исследования, в котором примут участие 3 000 человек в возрасте от 65 до 79 лет, заключается в установлении роли метформина как препарата, замедляющего развитие заболеваний, сокращающих продолжительность жизни [72].
ЗАКЛЮЧЕНИЕ
К настоящему времени установлено, что метформин обладает доказанным сахароснижающим, фибринолитическим, гиполипидемическим, антионкогенным, иммуномодулирующим, антивозрастным и, возможно, рядом других положительных эффектов. Центральным механизмом действия этого препарата, благодаря которому реализуются почти все вышеперечисленные благоприятные свойства, является активация АМФК. С учетом актуальных научных данных о фармакодинамике, а также патогенетической неопределенности термина «бигуанид» представляется оправданным использование в отношении метформина такой дефиниции, как «активатор АМФК».
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Мкртумян А.М. — финальное редактирование статьи; Маркова Т.Н. — концепция, дизайн и редактирование статьи; Овчинникова М.А., Иванова И.А., Кузьменко К.В. — написание текста, сбор и обработка иллюстративного материала. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Государственный реестр лекарственных средств Министерства здравоохранения РФ. Инструкция по медицинскому применению лекарственного препарата: Метформин, 2023. Доступно по: https://grls.rosminzdrav.ru/InstrImg/2023/03/27/1492167/d01f3b18-84c7-444c-bb64-83f117b4d1b1.pdf
2. Nagi DK, Yudkin JS. Effects of metformin on insulin resistance, risk factors for cardiovascular disease, and plasminogen activator inhibitor in NIDDM subjects. A study of two ethnic groups. Diabetes Care. 1993;16(4):621-629. doi: https://doi.org/10.2337/diacare.16.4.621
3. Evans JM, Donnelly LA, Emslie-Smith AM, et al. Metformin and reduced risk of cancer in diabetic patients. BMJ. 2005;330(7503):1304-1305. doi: https://doi.org/10.1136/bmj.38415.708634.F7
4. Varghese E, Samuel SM, Liskova A, et al. Diabetes and coronavirus (SARS-CoV-2): Molecular mechanism of Metformin intervention and the scientific basis of drug repurposing. PLoS Pathog. 2021;17(6):e1009634. doi: https://doi.org/10.1371/journal.ppat.1009634
5. Дудинская Е.Н., Ткачева О.Н., Браилова Н.В., и др. Биология теломер и метаболические нарушения: роль инсулинорезистентности и сахарного диабета 2 типа // Проблемы Эндокринологии. — 2020. — Т. 66. — №4. — С. 35-44. doi: https://doi.org/10.14341/probl12510
6. Song Y, Wu Z, Zhao P. The Function of Metformin in aging-related musculoskeletal disorders. Front Pharmacol. 2022;(13):865524. doi: https://doi.org/10.3389/fphar.2022.865524
7. Dziubak A, Wójcicka G, Wojtak A, Bełtowski J. Metabolic effects of Metformin in the failing Heart. Int J Mol Sci. 2018;19(10):2869. doi: https://doi.org/10.3390/ijms19102869
8. Sutter A, Landis D, Nugent K. The potential role for Metformin in the prevention and treatment of tuberculosis. J Thorac Dis. 2022;14(6):1758-1765. doi: https://doi.org/10.21037/jtd-22-39
9. Notaro ALG, Neto FTL. The use of metformin in women with polycystic ovary syndrome: an updated review. J Assist Reprod Genet. 2022;39(3):573-579. doi: https://doi.org/10.1007/s10815-022-02429-9
10. Casarella A, Nicotera R, Zicarelli MT, et al. Autosomic dominant polycystic kidney disease and metformin: Old knowledge and new insights on retarding progression of chronic kidney disease. Med Res Rev. 2022;42(1):629-640. doi: https://doi.org/10.1002/med.21850
11. Faubert B, Boily G, Izreig S, et al. AMPK is a negative regulator of the Warburg effect and suppresses tumor growth in vivo. Cell Metab. 2013;17(1):113-124. doi: https://doi.org/10.1016/j.cmet.2012.12.001
12. Buzzai M, Jones RG, Amaravadi RK, et al. Systemic treatment with the antidiabetic drug metformin selectively impairs p53deficient tumor cell growth. Cancer Res. 2007;67(14):6745-6752. doi: https://doi.org/10.1158/0008-5472.CAN-06-4447
13. Clark CG, Mitchell PE. Diabetes mellitus and primary carcinoma of the pancreas. Br Med J. 1961;2(5262):1259-1262. doi: https://doi.org/10.1136/bmj.2.5262.1259
14. Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer: a consensus report. Diabetes Care. 2010;33(7):1674-1685. doi: https://doi.org/10.2337/dc10-0666
15. Chlebowski RT, McTiernan A, Wactawski-Wende J, et al. Diabetes, metformin, and breast cancer in postmenopausal women. J Clin Oncol. 2012;30(23):2844-2852. doi: https://doi.org/10.1200/JCO.2011.39.7505
16. Goodwin PJ, Chen BE, Gelmon KA, et al. Effect of Metformin vs Placebo on invasive disease-free survival in patients with breast cancer: The MA.32 randomized clinical trial. JAMA. 2022;327(20):1963-1973. doi: https://doi.org/10.1001/jama.2022.6147
17. Kim HJ, Kwon H, Lee JW, et al. Metformin increases survival in hormone receptor-positive, HER2-positive breast cancer patients with diabetes. Breast Cancer Res. 2015;17(1):64. doi: https://doi.org/10.1186/s13058-015-0574-3
18. Zhang ZJ, Zheng ZJ, Kan H, et al. Reduced risk of colorectal cancer with metformin therapy in patients with type 2 diabetes: a meta-analysis. Diabetes Care. 2011;34(10):2323-2328. doi: https://doi.org/10.2337/dc11-0512
19. Singh S, Singh PP, Singh AG, et al. Anti-diabetic medications and the risk of hepatocellular cancer: a systematic review and meta-analysis. Am J Gastroenterol. 2013;108(6):881-892. doi: https://doi.org/10.1038/ajg.2013.5
20. Ko EM, Walter P, Jackson A, et al. Metformin is associated with improved survival in endometrial cancer. Gynecol Oncol. 2014;132(2):438-442. doi: https://doi.org/10.1016/j.ygyno.2013.11.021
21. Scherbakov AM, Sorokin DV, Tatarskiy VV Jr, et al. The phenomenon of acquired resistance to metformin in breast cancer cells: The interaction of growth pathways and estrogen receptor signaling. IUBMB Life. 2016;68(4):281-292. doi: https://doi.org/10.1002/iub.1481
22. Berstein LM, Iyevleva AG, Vasilyev D, et al. Genetic polymorphisms potentially associated with response to metformin in postmenopausal diabetics suffering and not suffering with cancer. Cell Cycle. 2013;12(23):3681-3688. doi: https://doi.org/10.4161/cc.26868
23. Cejuela M, Martin-Castillo B, Menendez JA, Pernas S. Metformin and breast cancer: Where are we now? Int J Mol Sci. 2022;23(5):2705. doi: https://doi.org/10.3390/ijms23052705
24. Samuel SM, Varghese E, Varghese S, Büsselberg D. Challenges and perspectives in the treatment of diabetes associated breast cancer. Cancer Treat Rev. 2018;(70):98-111. doi: https://doi.org/10.1016/j.ctrv.2018.08.004
25. Gonzalez-Angulo AM, Meric-Bernstam F. Metformin: a therapeutic opportunity in breast cancer. Clin Cancer Res. 2010;16(6):1695-1700. doi: https://doi.org/10.1158/1078-0432.CCR-09-1805
26. Zou Z, Tao T, Li H, Zhu X. mTOR signaling pathway and mTOR inhibitors in cancer: progress and challenges. Cell Biosci. 2020;10(1):31. doi: https://doi.org/10.1186/s13578-020-00396-1
27. Bost F, Decoux-Poullot AG, Tanti JF, Clavel S. Energy disruptors: rising stars in anticancer therapy? Oncogenesis. 2016;5(1):e188. doi: https://doi.org/10.1038/oncsis.2015.46
28. Chomanicova N, Gazova A, Adamickova A, et al. The role of AMPK/mTOR signaling pathway in anticancer activity of metformin. Physiol Res. 2021;70(4):501-508. doi: https://doi.org/10.33549/physiolres.934618
29. Buzzai M, Jones RG, Amaravadi RK, et al. Systemic treatment with the antidiabetic drug metformin selectively impairs p53deficient tumor cell growth. Cancer Res. 2007;67(14):6745-6752. doi: https://doi.org/10.1158/0008-5472.CAN-06-4447
30. Faubert B, Boily G, Izreig S, et al. AMPK is a negative regulator of the Warburg effect and suppresses tumor growth in vivo. Cell Metab. 2013;17(1):113-124. doi: https://doi.org/10.1016/j.cmet.2012.12.001
31. Wheaton WW, Weinberg SE, Hamanaka RB, et al. Metformin inhibits mitochondrial complex I of cancer cells to reduce tumorigenesis. Elife. 2014;(3):e02242. doi: https://doi.org/10.7554/eLife.02242
32. Куликов В.А., Беляева Л.Е. Метаболизм раковой клетки как терапевтическая мишень. // Вестник Витебского государственного медицинского университета. — 2016. —Т. 15. — №6 — С. 7-20.
33. Hardie DG. AMPK: a target for drugs and natural products with effects on both diabetes and cancer. Diabetes. 2013;62(7):2164-2172. doi: https://doi.org/10.2337/db13-0368
34. Zheng Z, Bian Y, Zhang Y, et al. Metformin activates AMPK/SIRT1/NF-κB pathway and induces mitochondrial dysfunction to drive caspase3/GSDME-mediated cancer cell pyroptosis. Cell Cycle. 2020;19(10):1089-1104. doi: https://doi.org/10.1080/15384101.2020.1743911
35. Triggle CR, Mohammed I, Bshesh K, et al. Metformin: Is it a drug for all reasons and diseases? Metabolism. 2022;(133):155223. doi: https://doi.org/10.1016/j.metabol.2022.155223
36. Garcia EY. Flumamine, a new synthetic analgesic and anti-flu drug. J Philipp Med Assoc. 1950;26(7):287-293.
37. Xun YH, Zhang YJ, Pan QC, et al. Metformin inhibits hepatitis B virus protein production and replication in human hepatoma cells. J Viral Hepat. 2014;21(8):597-603. doi: https://doi.org/10.1111/jvh.12187
38. del Campo JA, López RA, Romero-Gómez M. Insulin resistance and response to antiviral therapy in chronic hepatitis C: mechanisms and management. Dig Dis. 2010;28(1):285-293. doi: https://doi.org/10.1159/000282104
39. Yu JW, Sun LJ, Zhao YH, et al. The effect of metformin on the efficacy of antiviral therapy in patients with genotype 1 chronic hepatitis C and insulin resistance. Int J Infect Dis. 2012;16(6):e436-e441. doi: https://doi.org/10.1016/j.ijid.2012.02.004
40. Zhou SN, Zhang N, Liu HH, et al. Skewed CD39/CD73/adenosine pathway contributes to B-cell hyperactivation and disease progression in patients with chronic hepatitis B. Gastroenterol Rep (Oxf ). 2020;9(1):49-58. doi: https://doi.org/10.1093/gastro/goaa048
41. Sheth SH, Larson RJ. The efficacy and safety of insulin-sensitizing drugs in HIV-associated lipodystrophy syndrome: a metaanalysis of randomized trials. BMC Infect Dis. 2010;10(1):183. doi: https://doi.org/10.1186/1471-2334-10-183
42. Kapoor Y, Sharma R, Kumar A. Repurposing of Existing Drugs for the Bacterial Infections: An In silico and In vitro Study. Infect Disord Drug Targets. 2020;20(2):182-197. doi: https://doi.org/10.2174/1871526519666181126094244
43. Espinosa OA, Zanetti ADS, Antunes EF, et al. Prevalence of comorbidities in patients and mortality cases affected by SARS-CoV2: a systematic review and meta-analysis. Rev Inst Med Trop Sao Paulo. 2020;(62):e43. doi: https://doi.org/10.1590/s1678-9946202062043
44. Дедов И.И., Мокрышева Н.Г., Шестакова М.В., и др. Контроль гликемии и выбор антигипергликемической терапии у пациентов с сахарным диабетом 2 типа и COVID-19: консенсусное решение совета экспертов Российской ассоциации эндокринологов // Сахарный диабет. — 2022. — Т. 25. — №1. — С. 27-49. doi: https://doi.org/10.14341/DM12873
45. Han T, Ma S, Sun C, et al. Association between antidiabetic agents and clinical outcomes of COVID-19 in patients with diabetes: A systematic review and meta-analysis. Arch Med Res. 2022;53(2):186-195. doi: https://doi.org/10.1016/j.arcmed.2021.08.002
46. Bramante CT, Buse J, Tamaritz L, et al. Outpatient metformin use is associated with reduced severity of COVID-19 disease in adults with overweight or obesity. J Med Virol. 2021;93(7):4273-4279. doi: https://doi.org/10.1002/jmv.26873
47. Bramante CT, Huling JD, Tignanelli CJ, et al. Randomized trial of Metformin, Ivermectin, and Fluvoxamine for Covid-19. N Engl J Med. 2022;387(7):599-610. doi: https://doi.org/10.1056/NEJMoa2201662
48. Шестакова М.В., Викулова О.К., Исаков М.А., Дедов И.И. Сахарный диабет и COVID-19: анализ клинических исходов по данным регистра сахарного диабета Российской Федерации // Проблемы эндокринологии. — 2020. — Т. 66. —№1. — С. 35-46. doi: https://doi.org/10.14341/probl12458
49. Маркова Т.Н., Пономарева А.А., Самсонова И.В., и др. Факторы риска летального исхода у больных сахарным диабетом 2 типа и новой коронавирусной инфекцией // Эндокринология: новости, мнения, обучение. — 2022. — Т. 11. — №1. — С. 8-16. doi: https://doi.org/10.33029/2304-9529-2022-11-1-8-16
50. Kan C, Zhang Y, Han F, et al. Mortality risk of antidiabetic agents for type 2 diabetes with COVID-19: A systematic review and meta-analysis. Front Endocrinol (Lausanne). 2021;(12):708494. doi: https://doi.org/10.3389/fendo.2021.708494
51. Lukito AA, Pranata R, Henrina J, et al. The effect of Metformin consumption on mortality in hospitalized COVID-19 patients: a systematic review and meta-analysis. Diabetes Metab Syndr. 2020;14(6):2177-2183. doi: https://doi.org/10.1016/j.dsx.2020.11.006
52. Kow CS, Hasan SS. Mortality risk with preadmission metformin use in patients with COVID-19 and diabetes: A meta-analysis. J Med Virol. 2021;93(2):695-697. doi: https://doi.org/10.1002/jmv.26498
53. Li Y, Yang X, Yan P, et al.. Metformin in patients with COVID-19: A systematic review and meta-analysis. Front Med. 2021;(8). doi: https://doi.org/10.3389/fmed.2021.704666
54. Yang W, Sun X, Zhang J, Zhang K. The effect of metformin on mortality and severity in COVID-19 patients with diabetes mellitus. Diabetes Res Clin Pract. 2021;(178):108977. doi: https://doi.org/10.1016/j.diabres.2021.108977
55. Tanner JE, Alfi i C. The Fatty Acid Lipid Metabolism Nexus in COVID-19. Viruses. 2021;13(1):90. doi: https://doi.org/10.3390/v13010090
56. Farfan-Morales CN, Cordero-Rivera CD, Osuna-Ramos JF, et al. The antiviral effect of metformin on zika and dengue virus infection. Sci Rep. 2021;11(1):8743. doi: https://doi.org/10.1038/s41598-021-87707-9
57. Xie W, Wang L, Dai Q, et al. Activation of AMPK restricts coxsackievirus B3 replication by inhibiting lipid accumulation. J Mol Cell Cardiol. 2015;(85):155-167. doi: https://doi.org/10.1016/j.yjmcc.2015.05.021
58. Kifle ZD, Woldeyohanis AE, Demeke CA. A review on protective roles and potential mechanisms of metformin in diabetic patients diagnosed with COVID-19. Metab Open. 2021;(12):100137. doi: https://doi.org/10.1016/j.metop.2021.100137
59. Romero-Gómez M, Del Mar Viloria M, Andrade RJ, et al. Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patients. Gastroenterology. 2005;128(3):636-641. doi: https://doi.org/10.1053/j.gastro.2004.12.049
60. Brima W, Eden DJ, Mehdi SF, et al. The brighter (and evolutionarily older) face of the metabolic syndrome: evidence from Trypanosoma cruzi infection in CD-1 mice. Diabetes Metab Res Rev. 2015;31(4):346-359. doi: https://doi.org/10.1002/dmrr.2636
61. Всемирная организация здравоохранения [Интернет]. Доступно по: https://www.who.int/ru
62. Cabreiro F, Au C, Leung KY, et al. Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism. Cell. 2013;153(1):228-239. doi: https://doi.org/10.1016/j.cell.2013.02.035
63. De Haes W, Frooninckx L, Van Assche R, et al. Metformin promotes lifespan through mitohormesis via the peroxiredoxin PRDX-2. Proc Natl Acad Sci U S A. 2014;111(24):E2501-E2509. doi: https://doi.org/10.1073/pnas.1321776111
64. Karnewar S, Neeli PK, Panuganti D, et al. Metformin regulates mitochondrial biogenesis and senescence through AMPK mediated H3K79 methylation: Relevance in age-associated vascular dysfunction. Biochim Biophys Acta Mol Basis Dis. 2018;1864(4 Pt A):1115-1128. doi: https://doi.org/10.1016/j.bbadis.2018.01.018
65. Slack C, Foley A, Partridge L. Activation of AMPK by the putative dietary restriction mimetic metformin is insufficient to extend lifespan in Drosophila. PLoS One. 2012;7(10):e47699. doi: https://doi.org/10.1371/journal.pone.0047699
66. Martin-Montalvo A, Mercken EM, Mitchell SJ, et al. Metformin improves healthspan and lifespan in mice. Nat Commun. 2013;4(1):2192. doi: https://doi.org/10.1038/ncomms3192
67. Novelle MG, Ali A, Diéguez C, Bernier M, de Cabo R. Metformin: A Hopeful Promise in Aging Research. Cold Spring Harb Perspect Med. 2016;6(3):a025932. doi: https://doi.org/10.1101/cshperspect.a025932
68. Hsu SK, Cheng KC, Mgbeahuruike MO, et al. New insight into the effects of metformin on diabetic retinopathy, aging and cancer: Nonapoptotic cell death, immunosuppression, and effects beyond the AMPK pathway. Int J Mol Sci. 2021;22(17):9453. doi: https://doi.org/10.3390/ijms22179453
69. Turner R. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) [published correction appears in Lancet 1998;352(9139):1558]. Lancet. 1998;352(9131):854-865. doi: https://doi.org/10.1016/S0140-6736(98)07037-8
70. Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008;359(15):1577-1589. doi: https://doi.org/10.1056/NEJMoa0806470
71. Bannister CA, Holden SE, Jenkins-Jones S, et al. Can people with type 2 diabetes live longer than those without? A comparison of mortality in people initiated with metformin or sulphonylurea monotherapy and matched, non-diabetic controls. Diabetes Obes Metab. 2014;16(11):1165-1173. doi: https://doi.org/10.1111/dom.12354
72. Barzilai N, Crandall JP, Kritchevsky SB, Espeland MA. Metformin as a tool to target aging. Cell Metab. 2016;23(6):1060-1065. doi: https://doi.org/10.1016/j.cmet.2016.05.011
Об авторах
А. М. МкртумянРоссия
Мкртумян Ашот Мусаелович, д.м.н., профессор
г. Москва
Т. Н. Маркова
Россия
Маркова Татьяна Николаевна, д.м.н., профессор
г. Москва
М. А. Овчинникова
Россия
Овчинникова Маргарита Александровна, клинический ординатор
127473, г. Москва, ул. Делегатская, д. 20, стр. 1
И. А. Иванова
Россия
Иванова Ирина Александровна, клинический ординатор
г. Москва
К. В. Кузьменко
Россия
Кузьменко Ксения Витальевна, клинический ординатор
г. Москва
Дополнительные файлы
|
|
1. Рисунок 1. Противоопухолевые эффекты метформина. Адаптировано из [23]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(307KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Внутриклеточные пути противоопухолевого действия метформина. Адаптировано из [23]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(328KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Противовирусное действие метформина. Адаптировано из [4]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(346KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Внутриклеточные механизмы антивозрастного действия метформина. Адаптировано из [68]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(259KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мкртумян А.М., Маркова Т.Н., Овчинникова М.А., Иванова И.А., Кузьменко К.В. Метформин — активатор АМФ-зависимой протеинкиназы. Известные и новые механизмы действия. Сахарный диабет. 2023;26(6):585-595. https://doi.org/10.14341/DM13044
For citation:
Mkrtumyan A.M., Markova T.N., Ovchinnikova M.A., Ivanova I.A., Kuzmenko K.V. Metformin as an activator of AMP-activated protein kinase. Known and new mechanisms of action. Diabetes mellitus. 2023;26(6):585-595. (In Russ.) https://doi.org/10.14341/DM13044
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































