Перейти к:
Сочетанное атеросклеротическое поражение сонных артерий и артерий нижних конечностей у больных сахарным диабетом 2 типа: факторы риска и биомаркеры
https://doi.org/10.14341/DM12915
Аннотация
ОБОСНОВАНИЕ. Атеросклероз сонных артерий (СА) и артерий нижних конечностей (АНК) — распространенные и потенциально жизнеугрожающие коморбидные состояния при сахарном диабете (СД).
ЦЕЛЬ. Определить факторы риска и биомаркеры сочетанного атеросклеротического поражения СА и АНК у больных СД 2 типа (СД2).
МАТЕРИАЛЫ И МЕТОДЫ. Проведено одноцентровое поперечное сравнительное исследование. В исследование включен 391 больной. Всем пациентам выполнены ультразвуковое дуплексное сканирование СА и АНК, скрининг/мониторинг осложнений диабета и ассоциированных состояний, исследованы параметры гликемического контроля, биохимические параметры, показатели гемостаза. В сыворотке крови с помощью иммуноферментного анализа определяли факторы, вовлеченные в ремоделирование сосудистой стенки: кальпонин-1, релаксин, L-цитруллин, матриксные металлопротеиназы-2 и -3.
РЕЗУЛЬТАТЫ. Признаки атеросклероза СА и АНК выявлены у 330 и 187 больных соответственно. У 178 пациентов выявлено сочетание атеросклероза СА и АНК. Риск сочетанного поражения СА и АНК был выше у больных с диабетической ретинопатией (ОШ=2,57; р<0,001), хронической болезнью почек (ОШ=4,48; р<0,001), инфарктом миокарда (ОШ=5,09; р<0,001), коронарной реваскуляризацией (ОШ=4,31; р<0,001) или острым нарушением мозгового кровообращения (ОШ=3,07; р<0,001) в анамнезе. В ROC-анализе факторами риска сочетанного атеросклероза СА и АНК являлись: возраст ≥65,5 года (ОШ=3,43; р<0,001), соотношение окружность талии/окружность бедер (ОТ/ОБ) ≥0,967 (ОШ=3,01; р=0,001), длительность СД ≥12,5 года (ОШ=3,7; р<0,001), длительность инсулинотерапии ≥4,5 года (ОШ=3,05; р<0,001), длительность артериальной гипертензии ≥16,5 года (ОШ=1,98; р=0,002), уровень L-цитруллина сыворотки ≥68 мкмоль/л (ОШ=3,82; р=0,003), средняя амплитуда колебаний гликемии (MAGE) ≥3,72 ммоль/л (ОШ=1,79; р=0,006). В многофакторном логистическом регрессионном анализе независимыми факторами риска атеросклероза СА и АНК были возраст (р=0,005), длительность СД (р=0,0003) и ОТ/ОБ (р=0,004).
ЗАКЛЮЧЕНИЕ. Сочетанное поражение СА и АНК у больных СД2 ассоциировано с возрастом, длительностью СД, абдоминальным ожирением, микрососудистыми и макрососудистыми осложнениями, вариабельностью гликемии, высоким уровнем L-цитруллина.
Ключевые слова
Для цитирования:
Королева Е.А., Хапаев Р.С., Лыков А.П., Корбут А.И., Климонтов В.В. Сочетанное атеросклеротическое поражение сонных артерий и артерий нижних конечностей у больных сахарным диабетом 2 типа: факторы риска и биомаркеры. Сахарный диабет. 2023;26(2):172-181. https://doi.org/10.14341/DM12915
For citation:
Koroleva E.A., Khapaev R.S., Lykov A.P., Korbut A.I., Klimontov V.V. Association of carotid atherosclerosis and peripheral artery disease in patients with type 2 diabetes: risk factors and biomarkers. Diabetes mellitus. 2023;26(2):172-181. https://doi.org/10.14341/DM12915
ОБОСНОВАНИЕ
Поражения артерий нижних конечностей (АНК) и сонных артерий (СА) входят в число наиболее распространенных и социально значимых проявлений атеросклероза при сахарном диабете (СД). Поражение АНК является фактором риска развития синдрома диабетической стопы и ампутаций конечностей — осложнений, которые в значительной степени определяют снижение качества жизни и инвалидизацию больных СД. Пятилетний риск смерти у больных с критической ишемией нижних конечностей превосходит смертность от рака молочной железы и толстого кишечника [1]. Атеросклероз СА ассоциирован с риском инсульта [2]. Пациенты с СД и гемодинамически значимым стенозом СА имеют чрезвычайно высокий риск смерти от сердечно-сосудистых причин [3].
Известно, что частота развития атеросклероза у больных СД в 2–4 раза превышает популяционную [1]. Повышению риска атеросклероза при СД 2 типа (СД2) способствует большое количество патологических процессов: накопление и изменение структуры коллагена и эластина, изменение сократительной способности сосудистой стенки, увеличение концентрации и накопление конечных продуктов гликирования [4], усиление экспрессии молекул адгезии, окислительный стресс, активация воспалительных сигнальных путей, дислипидемия, артериальная гипертензия, повышение жесткости стенки артерий [5].
Несмотря на то что традиционные факторы риска атеросклероза, такие как артериальная гипертензия, курение, дислипидемия, гипергликемия и прочие, хорошо известны, они далеко не всегда могут объяснить преимущественное развитие поражений того или иного сосудистого бассейна у конкретного пациента с СД. Это определяет необходимость дальнейшего изучения механизмов развития, идентификации медиаторов и биомаркеров сосудистых поражений разных локализаций. Отдельной задачей является установление факторов риска и биомаркеров сочетанных атеросклеротических поражений.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определить факторы риска и биомаркеры сочетанного атеросклеротического поражения СА и АНК у больных СД2.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Набор пациентов в исследование осуществлялся в клинике НИИКЭЛ — филиал ИЦиГ СО РАН (медицинская организация 3-го уровня) в период с января 2016 г. по декабрь 2019 г.
Изучаемые популяции
Основную группу обследованных составили пациенты мужского и женского пола старше 30 лет, с СД2, диагностированным не менее года назад, получавшие сахароснижающую терапию. Контрольная группа формировалась из числа лиц без атеросклеротических заболеваний, с нормальным уровнем глюкозы.
Критерии исключения: диабетический кетоацидоз, гиперосмолярный синдром на момент включения в исследование; злокачественные новообразования в анамнезе; диффузные болезни соединительной ткани; терминальная стадия хронической болезни почек (ХБП) или заместительная почечная терапия.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборка исследуемых пациентов формировалась сплошным способом из числа пациентов, госпитализированных в клинику для проведения плановой специализированной и высокотехнологичной медицинской помощи.
Дизайн исследования
Проведено одноцентровое сравнительное одномоментное исследование. Обследование больных проводилось в соответствии с актуальной версией «Алгоритмов оказания специализированной медицинской помощи больным сахарным диабетом» [6] и включало скрининг/мониторинг осложнений СД и ассоциированных состояний, оценку качества гликемического контроля, биохимических параметров, показателей гемостаза. Всего в исследование включен 391 больной с СД2.
Всем пациентам выполнено ультразвуковое дуплексное сканирование СА и АНК. На основании результатов этих исследований участники были распределены на 3 группы. У больных 1-й группы не выявлено признаков атеросклеротического поражения исследованных артерий (группа CA-АНК-). У больных 2-й группы выявлено поражение только СА (группа СА+АНК-). Больные 3-й группы имели поражение двух сосудистых бассейнов (CA+АНК+).
Возраст, пол, курение, длительность СД, индекс массы тела (ИМТ), отношение «окружность талии/окружность бедер» (ОТ/ОБ), осложнения СД и ассоциированные состояния, характеристики сахароснижающей, гиполипидемической и антигипертензивной терапии, параметры гликемического контроля и вариабельности гликемии (ВГ), панель липидных показателей, функция почек, альбуминурия, параметры гемограммы и параметры гемостаза оценивались как потенциальные факторы риска сочетанного поражения CA и АНК в моделях многофакторного логистического регрессионного анализа и анализа ROC-кривых.
В субисследование биомаркеров были включены 152 пациента с СД (не менее 40 человек из каждой группы) и 30 лиц без СД и сердечно-сосудистых заболеваний (группа сравнения). Группу сравнения составили 6 мужчин и 24 женщины в возрасте от 41 до 65 лет (медиана 46 лет). Среди этих лиц было 6 активных курильщиков, 24 человека не имели анамнеза курения. В сыворотке крови определяли факторы, вовлеченные в ремоделирование сосудистой стенки: кальпонин-1, релаксин, L-цитруллин, матриксные металлопротеиназы 2 и 3 (MMP-2 и MMP-3). В ряду этих молекул кальпонин-1 является маркером целостности гладкомышечных клеток [7], релаксин — важным регулятором сосудистого тонуса [8], L-цитруллин участвует в продукции оксида азота (NO) и в нитрозаминовом стрессе [9], ММР-2 и ММР-3 играют важную роль в атерогенезе и нестабильности атеросклеротических бляшек [10].
Методы
Исследование СА и АНК
Ультразвуковое дуплексное сканирование СА проводилось сертифицированным специалистом на экспертных ультразвуковых диагностических системах Vivid 7™ Dimension (GE Healthcare, США) и RS85-RUS (Samsung Medison, Корея) с использованием широкополосных датчиков с частотой сканирования 7–10 МГц. При сканировании руководствовались рекомендациями Мангеймского консенсуса [11]. Исследование проводили с обеих сторон на всем протяжении общей, внутренней и наружной СА, доступном для сканирования. В дистальном сантиметре общей сонной артерии измеряли максимальную толщину комплекса интима-медиа (ТКИМ). Значение ТКИМ ≥1,1 мм рассматривали как увеличение [12]. Очаговое утолщение ТКИМ >50% толщины прилежащей сосудистой стенки или локальный участок с ТКИМ >1,5 мм и протрузией в просвет артерии расценивали как атеросклеротическую бляшку.
Сканирование АНК выполнялось сертифицированным специалистом на аппарате высокого разрешения Vivid 7™ Dimension (GE Healthcare, США) с линейным детектором 7–12 МГц. Сканирование выполняли с уровня начала общей бедренной артерии; при регистрации в просвете данной артерии времени ускорения потока более 100 мс в исследование включались общая и наружная подвздошные артерии. Далее выполняли сканирование общей, глубокой и наружной бедренных артерий, подколенной артерии, тибио-перонеального ствола, задней и передней большеберцовых, малоберцовой артерий и тыльной артерии стопы. Оценка эхоструктуры комплекса интима-медиа осуществлялась на всем протяжении указанных артерий, измерение ТКИМ проводили на уровне артерий бедра и подколенной артерии. Увеличение ТКИМ более 50% относительно прилежащей сосудистой стенки считали патологическим. Локальное утолщение комплекса интима-медиа более 2 мм расценивали как атеросклеротическую бляшку. Выраженность стеноза оценивали по величине соотношения пиковой систолической скорости в зоне стеноза и престенотическом сегменте артерии; соотношение >2 расценивали как признак гемодинамической значимости стеноза [13].
Лабораторные исследования
Уровень гликированного гемоглобина A1c (HbA1c) измеряли турбидиметрическим методом на биохимическом анализаторе AU480 (Beckman Coulter, США). Для расчета показателей ВГ использовали три ежедневных значения уровня глюкозы крови натощак и три ежедневных значения уровня глюкозы в крови через 2 ч после приема пищи в течение 5 дней. Измерения проводились с помощью глюкометра One Touch Verio® (Johnson & Johnson / LifeScan, США). На основании полученных значений с помощью калькулятора EasyGV (версия 9.0.R2) [14] рассчитывали средний уровень глюкозы, среднюю амплитуду колебаний гликемии (MAGE: Mean Amplitude of Glycemic Excursions), индекс риска гипогликемии (LBGI: Low Blood Glucose Index).
Биохимические параметры, включая глюкозу, общий холестерин, холестерин липопротеинов низкой плотности (ЛПНП), холестерин липопротеинов высокой плотности (ЛПВП), триглицериды, креатинин и мочевую кислоту, а также креатинин в моче, измеряли на биохимическом анализаторе AU480 (Beckman Coulter, США). Расчетную скорость клубочковой фильтрации (рСКФ) рассчитывали по формуле CKD-EPI (2009). Альбумин в моче определяли иммунотурбидиметрическим методом на биохимическом анализаторе AU480 (Beckman Coulter, США). Концентрацию фибриногена, растворимых фибрин-мономерных комплексов (РФМК), D-димера в плазме крови определяли на автоматическом анализаторе гемостаза ACL Elite Pro (Instrumentation Laboratory, США). Общий анализ крови выполняли на гематологическом анализаторе ВС-5300 (Mindray Medical International Limited, Китай).
Концентрацию факторов, вовлеченных в сосудистое ремоделирование, определяли в сыворотке крови методом ИФА. Уровень кальпонина-1 определяли с помощью тест-систем CUSABIO Technology (США), релаксина и L-цитруллина — Immundiagnostik AG (Германия), MMP-2 — Abcam (Великобритания), MMP-3 — BCM Diagnostics (США).
Статистический анализ
Для проверки нормальности распределения применялся критерий Колмогорова–Смирнова. Для сравнения двух или нескольких групп использовали критерий Стьюдента или дисперсионный анализ (ANOVA) соответственно, если количественные параметры распределялись нормально; в противном случае применялся непараметрический U-критерий Манна–Уитни или H-критерий Крускала–Уоллиса. Различия в категориальных параметрах оценивали с помощью критерия χ2. Значения p ниже 0,05 считались значимыми. Для проверки связи между переменными применялся ранговый корреляционный анализ Спирмена. Для большинства применяемых статистических процедур использовался пакет программного обеспечения Statistica 13.0 (Dell, США). Размер выборки был рассчитан с заранее определенной частотой ошибок I рода α=0,05 и мощностью 1–β=90%. Количественные данные представлены как медианы и межквартильные интервалы.
Для оценки факторов риска атеросклероза был проведен ROC-анализ с помощью программного пакета IBM SPSS Statistics 26.0 (IBM, США). Была рассчитана площадь под ROC-кривой (AUC) с 95% доверительными интервалами (ДИ) и p-значениями. Результаты считались значимыми, если AUC с нижней границей 95% ДИ была выше 0,5, а значение p было ниже 0,05. Значения отрезной точки были выбраны с чувствительностью (Se) и специфичностью (Sp) выше 0,55. Оценка лабораторных параметров с распределением, отличным от нормального (кальпонин-1, релаксин, L-цитруллин и ММР-2), проводилась в виде логарифмических значений (десятичный логарифм, Lg).
Оценка значимости клинических и лабораторных факторов проводилась с помощью логистического регрессионного анализа с прямым отбором переменных. Значения биомаркеров и основных лабораторных показателей как возможных факторов риска атеросклероза СА и АНК оценивали с поправкой на демографические факторы и клинические параметры. Были выбраны модели с меньшим количеством некоррелирующих параметров, более низкими значениями p и наибольшими AUC, Se и Sp. Для параметров, включенных в модели, были рассчитаны нескорректированные и скорректированные отношения шансов (ОШ), 95% ДИ и значения p. Представлены характеристики моделей (значение свободного члена, значение p, Se, Sp) и точки отсечки логистической функции (Lр).
Этическая экспертиза
Проведение исследования одобрено Этическим комитетом НИИКЭЛ — филиала ИЦиГ СО РАН (протокол №115 от 24.12.2015 г.). Все больные давали письменное информированное согласие на участие в исследовании.
РЕЗУЛЬТАТЫ
Общая характеристика больных, включенных в исследование
В исследование включен 391 пациент с СД2, 113 мужчин и 278 женщин, от 36 до 88 лет (медиана — 65 лет). Длительность заболевания с момента постановки диагноза составила в среднем 13 лет (от 1 года до 38 лет), средний уровень HbA1c — 8,5% (диапазон: 4,9–15,8%). Пациенты получали комбинированную сахароснижающую терапию, включавшую метформин (n=321), препараты сульфонилмочевины (n=128), ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2, n=53), ингибиторы дипептидилпептидазы-4 (иДПП-4, n=50), инсулин (n=293). Большинство больных имели хронические осложнения СД и ассоциированные состояния: периферическую полинейропатию (n=336, 88%), автономную нейропатию (n=270, 69%), диабетическую ретинопатию (ДР, n=197, 52%), ХБП (n=123, 32%), артериальную гипертензию (АГ, n=377, 92%), ишемическую болезнь сердца (ИБС, n=151, 37%). Синдром диабетической стопы был диагностирован у 27 пациентов (7%), при этом у 10 человек была нейропатическая форма синдрома, у 17 — смешанная. Дислипидемия зарегистрирована у 356 обследованных пациентов (91%); регулярную гиполипидемическую терапию получали 173 человека (44%): 154 пациента принимали статины, 19 человек — статины и фенофибрат. О наличии кровных родственников с СД сообщили 179 человек, 154 имели кровных родственников с сердечно-сосудистыми заболеваниями.
Характеристика групп больных СД2 с атеросклерозом СА и АНК
У 52 (13,3%) пациентов не обнаружено атеросклеротических поражений СА и АНК; эти пациенты составили первую группу обследованных (СА-АНК-). Ультразвуковые признаки атеросклероза СА выявлены у 330 человек (84%), из них у 131 отмечено утолщение ТКИМ, у 199 — атеросклеротические бляшки. Количество больных со стенозирующим поражением СА составляло 134 человека (29,5% от всех включенных в исследование, или 40% пациентов с атеросклерозом СА), при этом гемодинамически значимый стеноз регистрировался у 39 пациентов. У 152 (40%) человек поражение СА не сочеталось с поражением АНК, эти пациенты вошли во вторую группу (СА+АНК-). Атеросклероз АНК диагностирован у 187 (47,8%) обследованных, из них 58 человек имели стеноз как минимум одной артерии (гемодинамически значимый — у 7 пациентов), 64 — окклюзию как минимум одной артерии. Хроническая ишемия нижних конечностей выявлена у 82 пациентов, ампутации в анамнезе — у 8 человек, из них 7 пациентам были выполнены малые ампутации (один или несколько пальцев стопы), 1 больному была проведена ампутация на уровне верхней трети голени по поводу флегмоны стопы. Больных с критической ишемией нижних конечностей в нашей выборке не было. У 9 пациентов атеросклероз АНК не сочетался с изменениями СА. В связи с малым числом наблюдений эти пациенты не включались в дальнейший анализ. Пациенты с сочетанием атеросклеротического поражения СА и АНК (178 человек, 46,5%) сформировали третью группу (СА+АНК+).
Клиническая характеристика групп пациентов представлена в табл. 1. Больные с поражением двух сосудистых бассейнов были старше и имели большую длительность СД и меньший ИМТ, в сравнении с пациентами с атеросклерозом СА, но без поражения АНК, а также с пациентами без признаков атеросклероза. Обе группы пациентов с атеросклерозом имели меньший ИМТ по сравнению с пациентами без поражений СА и АНК, но не различались между собой. Соотношение ОТ/ОБ оказалось больше у больных СА+АНК+ в сравнении с пациентами СА+АНК-. Кроме того, больные с поражением двух сосудистых бассейнов имели большую длительность АГ, чаще имели ДР и ИБС, в их анамнезе чаще имелись инфаркт миокарда (ИМ), коронарная реваскуляризация (КР) и острое нарушение мозгового кровообращения (ОНМК). У пациентов с сочетанным атеросклерозом определялись более высокие значения ТКИМ СА.
Пациенты группы СА+АНК+ чаще получали инсулин по сравнению с другими группами обследованных (табл. 2). Длительность инсулинотерапии также была больше в этой группе больных. Частота применения остальных групп сахароснижающих препаратов не различалась между группами. Больные с сочетанным поражением СА и АНК чаще получали бета-блокаторы, статины и аспирин.
Медиана уровня HbA1c была выше на 0,9% у больных с изолированным и сочетанным атеросклерозом СА по сравнению с пациентами без атеросклероза, хотя различия между группами оказались статистически не значимыми (табл. 3). Вместе с тем величины MAGE и LBGI были значимо выше у больных с поражением двух бассейнов. Уровни общего холестерина и холестерина ЛПНП были ниже в группе пациентов с сочетанным атеросклерозом. Значимых межгрупповых различий по уровню триглицеридов, мочевой кислоты и альбуминурии выявлено не было. Уровень рСКФ был ниже у больных с поражением двух бассейнов. Концентрации РФМК и фибриногена в группах больных с атеросклерозом были значимо выше, чем у пациентов без атеросклероза, при этом уровень фибриногена был значимо выше у пациентов с сочетанным атеросклеротическим поражением по сравнению с другими группами больных. Не выявлено различий между группами по уровню D-димера (табл. 3), а также по параметрам гемограммы (данные не представлены).
Концентрация факторов, вовлеченных в сосудистое ремоделирование, у больных СД2 с атеросклерозом СА и АНК
В целом у пациентов с СД2 наблюдалось повышение уровня кальпонина-1 и прослеживалась тенденция к снижению уровня релаксина в сравнении с группой лиц без СД: 7,7 [ 4,4; 12,9] и 6,5 [ 5,6; 8;2] нг/мл; р=0,03, и 90 [ 26; 182] и 146 [ 57; 166] пг/мл; р=0,13 соответственно. Уровень L-цитруллина у лиц с СД в целом не отличался от группы сравнения: 34,5 [ 0; 153] и 20,2 [ 15; 48] мкмоль/л; р=0,48, при этом уровень данного показателя был значимо выше у лиц с поражением СА и АНК по сравнению с другими группами больных (табл. 3). Выявлены корреляции между концентрацией L-цитруллина и количеством атеросклеротических бляшек в СА (r=0,22; p=0,005), уровнем гемоглобина (r=-0,5; p<0,0001) и отношением альбумин/креатинин мочи (r=0,57; p<0,0001).
Прослеживалась тенденция к повышению уровня MMP-2 у больных СД2 в сравнении с группой сравнения: 314,4 [ 208,4; 429,6] и 254 [ 167,8; 341,3] нг/мл; р=0,06, однако значимые различия между группами пациентов не выявлены. Уровень MMP-3 в основной группе и у лиц без СД не различался: 14,8 [ 10,5; 24,5] и 13,5 [ 8,9; 20,2] нг/мл; р=0,63. При этом концентрация MMP-3 у больных в группах СА+АНК- и СА+АНК+ была выше, чем у пациентов без поражения СА и АНК (табл. 3). Уровень MMP-3 не различался у больных с изолированным поражением СА и поражением СА и АНК.
Значимых различий в уровне биомаркеров у пациентов с гемодинамически незначимыми и гемодинамически значимыми стенозами не было (все р>0,05).
Факторы риска сочетанного поражения СА и АНК у больных СД2
Вероятность одновременного поражения СА и АНК была выше у больных с ДР, ХБП, ИМ, коронарной реваскуляризацией или ОНМК в анамнезе (рис. 1).
Согласно результатам ROC-анализа, факторами риска сочетанного атеросклероза СА и АНК являлись: возраст ≥65,5 года, соотношение ОТ/ОБ ≥0,967, длительность СД ≥12,5 года, длительность инсулинотерапии ≥4,5 года, длительность АГ ≥16,5 года, уровень L-цитруллина сыворотки ≥68 мкмоль/л, MAGE ≥3,72 ммоль/л (табл. 4).
В многофакторном логистическом регрессионном анализе (табл. 5) значимыми факторами, ассоциированными с развитием атеросклероза СА и АНК, были возраст (+8% на каждый год), длительность СД (+11% на каждый год болезни) и ОТ/ОБ (+6% на каждые 0,01 ед. отношения).
Нежелательные явления
В ходе исследования не зафиксировано каких-либо нежелательных явлений.
Таблица 1. Клиническая характеристика групп пациентов с сахарным диабетом 2 типа с различной выраженностью атеросклероза сонных артерий и артерий нижних конечностей
Параметр | Группы больных | ||
СА-АНК- (n=52) | СА+АНК- (n=152) | СА+АНК+ (n=178) | |
Пол, м/ж, n (%) | 9/43 (21/79) | 49/103 (32/68) | 52/126 (29/71) |
Возраст, годы | 56 [ 50; 62] | 64 [ 57; 69]** | 68 [ 62,5; 71]***### |
Длительность СД, годы | 7 [ 4; 13] | 10 [ 6; 15] | 15,5 [ 10; 22]***### |
ИМТ, кг/м2 | 37,7 [ 32,7; 42,8] | 32,8 [ 29,4; 36,8]* | 32,1 [ 28,9; 37,2]** |
ОТ/ОБ | 0,97 [ 0,9; 1,04] | 0,94 [ 0,91; 0,99] | 0,98 [ 0,93; 1,07]### |
Курение, n (%) | 6 (11,5) | 18 (11,8) | 19 (10,7) |
ДР, n (%) | 20 (38,5) | 64 (43) | 113 (63)**## |
ХБП, n (%) | 12 (23,1) | 45 (30) | 66 (37) |
АГ, n (%) | 48 (92,3) | 147 (97) | 177 (99,4) |
Длительность АГ, годы | 11 [ 7; 17] | 15 [ 6; 22] | 18 [ 10; 28]**## |
ИБС, n (%) | 8 (15,4) | 36 (23,4) | 105 (58,7)***### |
ИМ, n (%) | 1 (1,9) | 9 (7) | 37 (21) **### |
КР, n (%) | 3 (5,8) | 8 (6) | 36 (21) *### |
ОНМК, n (%) | 0 | 8 (6) | 27 (16) ** ## |
ТКИМ СА слева, мм | 0,7 [ 0,6; 0,8] | 1,4 [ 1,2; 1,9]*** | 1,7 [ 1,2; 2,5]***# |
ТКИМ СА справа, мм | 0,7 [ 0,6; 0,8] | 1,4 [ 1,1; 2,2]*** | 1,8 [1,2; 2,8]***### |
Примечания. Здесь и в табл. 2,3: данные представлены как медианы [Q1; Q3].
СА — сонные артерии; АНК — артерии нижних конечностей; СД — сахарный диабет; ИМТ — индекс массы тела; ОТ — окружность талии; ОБ — окружность бедер; ДР — диабетическая ретинопатия; ХБП — хроническая болезнь почек; АГ — артериальная гипертензия; ИБС — ишемическая болезнь сердца; ИМ — инфаркт миокарда; КР — коронарная реваскуляризация; ОНМК — острое нарушение мозгового кровообращения; ТКИМ — толщина комплекса интима-медиа.
* p<0,05, ** p<0,01, *** p<0,001 по сравнению с группой СА-АНК-; # p<0,05, ## p<0,01, ### p<0,001 по сравнению с группой СА+АНК-.
Таблица 2. Терапия в группах пациентов с сахарным диабетом 2 типа с различной выраженностью атеросклероза сонных артерий и артерий нижних конечностей
Параметр | Группы больных | ||
СА-АНК- (n=52) | СА+АНК- (n=152) | СА+АНК+ (n=178) | |
Метформин, n (%) | 36 (69,2) | 128 (84,2) | 155 (86,3) |
Сульфонилмочевина, n (%) | 19 (36,5) | 52 (34,2) | 55 (30,9) |
иДПП-4, n (%) | 6 (11,5) | 22 (14,5) | 21 (11,8) |
иНГЛТ-2, n (%) | 4 (7,7) | 23 (15,1) | 26 (14,8) |
Инсулин, n (%) | 30 (57,7) | 108 (71) | 154 (87)***### |
Длительность инсулинотерапии, годы | 2 [ 0,1; 6] | 4 [ 1; 7] | 8 [ 3; 12]***### |
Доза инсулина, Ед/сут | 37 [ 22; 76] | 50 [ 32; 64] | 50 [ 32; 68] |
Доза инсулина, Ед/кг/сут | 0,47 [ 0,26; 0,7] | 0,54 [ 0,32; 0,71] | 0,58 [ 0,36; 0,8] |
иАПФ, n (%) | 16 (30,8) | 58 (37,7) | 66 (36,9) |
БРА, n (%) | 21 (40,4) | 60 (39) | 86 (48) |
Диуретики, n (%) | 19 (36,5) | 68 (44,2) | 95 (53,1) |
Антагонисты кальция, n (%) | 17 (32,7) | 51 (33,1) | 69 (38,5) |
Бета-блокаторы, n (%) | 19 (36,5) | 60 (39) | 96 (53,6)**## |
Препараты центрального действия, n (%) | 6 (11,5) | 16 (10,4) | 31 (17,9) |
Статины, n (%) | 17 (32,7) | 47 (32) | 109 (61)***### |
Аспирин, n (%) | 12 (23) | 80 (52,6)*** | 129 (72,5)***### |
Примечания. СА — сонные артерии; АНК — артерии нижних конечностей; иДПП-4 — ингибиторы дипептидилпептидазы-4; иНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера-2; иАПФ — ингибиторы ангиотензинпревращающего фермента; БРА — блокаторы рецепторов ангиотензина.
Таблица 3. Лабораторные параметры больных сахарным диабетом 2 типа с различной выраженностью атеросклероза сонных артерий и артерий нижних конечностей
Параметр | Группы больных | ||
СА-АНК- (n=52) | СА+АНК- (n=152) | СА+АНК+ (n=178) | |
HbA1c, % | 7,4 [ 6,2; 10,3] | 8,3 [ 7,1; 9,5] | 8,3 [ 7,1; 10,1] |
MAGE, ммоль/л | 3,0 [ 1,8; 4,0] | 3,5 [ 2,5; 4,6] | 4,0 [ 2,8; 5,2]*# |
LBGI, усл. ед. | 0 [ 0; 0,22] | 0,06 [ 0; 0,65]* | 0,31 [ 0; 1,28]*** ## |
Общий холестерин, ммоль/л | 5,1 [ 4,4; 6,0] | 5,3 [ 4,6; 6,3] | 4,8 [ 4,0; 5,9]### |
Холестерин ЛПНП, ммоль/л | 3,3 [ 2,9; 3,9] | 3,4 [ 2,7; 4,1] | 3,0 [ 2,4; 3,9]## |
Холестерин ЛПВП, ммоль/л | 1,2 [ 1,0; 1,4] | 1,2 [ 1,0; 1,4] | 1,1 [ 1,0; 1,4] |
Триглицериды, ммоль/л | 2,5 [ 1,6; 3,1] | 2,1 [ 1,4; 3,2] | 1,8 [ 1,2; 2,4]## |
Мочевая кислота, мкмоль/л | 340 [ 263; 389] | 331 [ 282; 393] | 313 [ 251; 395] |
рСКФ, мл/мин/1,73 м2 | 74 [ 63; 90] | 68 [ 56; 82] | 64 [ 54; 76]*# |
Альбумин/креатинин мочи, мг/ммоль | 1 [ 0,5; 2,5] | 1 [ 0,4; 4,3] | 1,4 [ 0,5; 4,8] |
Фибриноген, ммоль/л | 3,9 [ 3,3; 4,4] | 4,3 [ 3,6; 4,9]* | 4,4 [ 3,6; 5,3]***# |
РФМК, мг/дл | 7,25 [ 3,5; 14] | 11 [ 4,75; 17]** | 12 [ 4,5; 19]** |
D-димер, нг/мл | 265 [ 229; 336] | 276 [ 237; 321] | 273 [ 244; 330] |
Кальпонин-1, нг/мл | 6,4 [ 5,7; 7,8] | 6,3 [ 5,7; 7] | 6,7 [ 5,6; 8,7] |
Релаксин, пг/мл | 140 [ 59; 159] | 152 [ 93; 167] | 136 [ 44; 167] |
L-цитруллин, мкмоль/л | 48 [ 0; 153] | 9 [ 0; 50]* | 134 [ 18; 345]### |
ММР-2, нг/мл | 319 [ 220; 414] | 353 [ 207; 469] | 318 [ 203; 400] |
ММР-3, нг/мл | 9,7 [ 7,9; 14,5] | 15,9 [ 7,4; 22,8]* | 15,3 [ 9,9; 21,8]** |
Примечания. СА — сонные артерии; АНК — артерии нижних конечностей; HbA1c — гликированный гемоглобин; ЛПНП — липопротеины низкой плотности; ЛПВП — липопротеины высокой плотности; рСКФ — расчетная скорость клубочковой фильтрации; РФМК — растворимые фибрин-мономерные комплексы; ММР — матриксные металлопротеиназы.
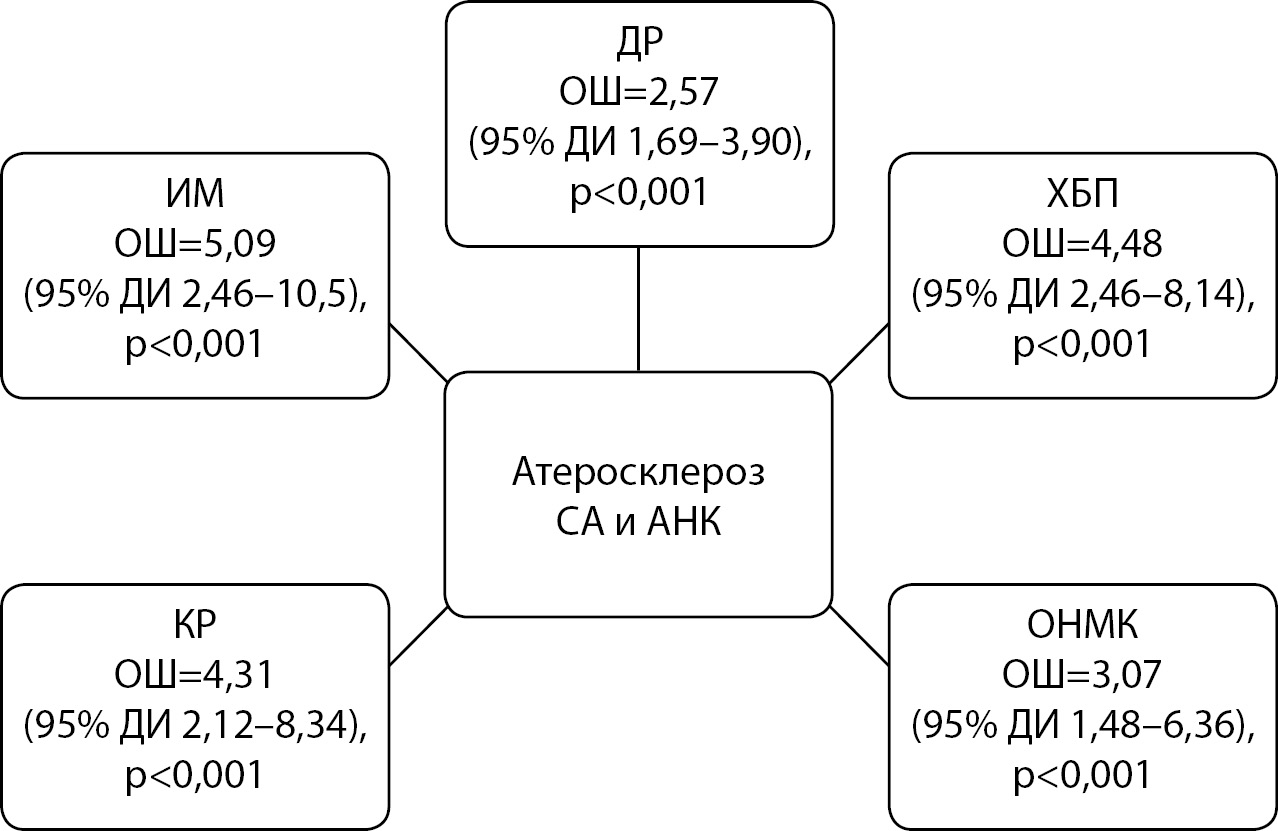
Рисунок 1. Ассоциации атеросклероза сонных артерий и артерий нижних конечностей с иными микро- и макрососудистыми осложнениями у больных сахарным диабетом 2 типа.
Примечание. СА — сонные артерии; АНК — артерии нижних конечностей; ДР — диабетическая ретинопатия; ХБП — хроническая болезнь почек; ИМ — инфаркт миокарда; КР — коронарная реваскуляризация; ОНМК — острое нарушение мозгового кровообращения.
Таблица 4. Факторы риска атеросклероза сонных артерий и артерий нижних конечностей у больных сахарным диабетом 2 типа. Результаты ROC-анализа
Фактор | Отрезная точка | AUC±SE, 95% ДИ, значение p | Se, % | Sp, % | ОШ, 95% ДИ, значение р |
Возраст | ≥65,5 года | 0,69±0,03 (0,63–0,74), p<0,001 | 62,8 | 67,0 | 3,43 (2,24–5,24), p<0,001 |
ОТ/ОБ | ≥0,967 | 0,64±0,05 (0,55–0,73), p=0,004 | 62,8 | 64,1 | 3,01 (1,54–5,89), p=0,001 |
Длительность СД | ≥12,5 года | 0,70±0,03 (0,64–0,75), p<0,001 | 66,1 | 65,5 | 3,70 (2,41–5,67), p<0,001 |
Длительность инсулинотерапии | ≥4,5 года | 0,68±0,03 (0,61–0,74), p<0,001 | 67,3 | 59,7 | 3,05 (1,84–5,04), p<0,001 |
Длительность АГ | ≥16,5 года | 0,61±0,03 (0,55–0,67), p<0,001 | 58,4 | 58,5 | 1,98 (1,29–3,05), p=0,002 |
L-цитруллин плазмы | ≥68 мкмоль/л | 0,68±0,06 (0,56–0,80), p=0,004 | 65,6 | 66,7 | 3,82 (1,57–9,31), p=0,003 |
MAGE | ≥3,7 ммоль/л | 0,58±0,03 (0,52–0,64), p=0,006 | 56,7 | 57,7 | 1,79 (1,19–2,69), p=0,006 |
ОШ — отношение шансов; ДИ — доверительный интервал; СД — сахарный диабет; АГ — артериальная гипертензия; ОТ — окружность талии; ОБ — окружность бедер.
Таблица 5. Факторы риска атеросклероза сонных артерий и артерий нижних конечностей у больных сахарным диабетом 2 типа. Результаты многофакторного регрессионного анализа
Параметр | Скорригированное ОШ | 95% ДИ | Значение p |
Возраст, годы | 1,08 | 1,02–1,14 | 0,005 |
Длительность СД, годы | 1,11 | 1,05–1,17 | 0,0003 |
ОТ/ОБ, 0,01 ед. | 1,06 | 1,02–1,10 | 0,004 |
Параметры модели: Свободный член =–11,9, значение p для KS-статистики <0,001, площадь под кривой ROC=0,78, Se=69,9%, Sp=70,3% для LP=0,61. ОШ — отношение шансов; ДИ — доверительный интервал; СД — сахарный диабет; АГ — артериальная гипертензия; ОТ — окружность талии; ОБ — окружность бедер.
ОБСУЖДЕНИЕ
В данном исследовании мы оценили факторы риска и провели поиск возможных биомаркеров сочетанного поражения СА и АНК у больных СД2.
Репрезентативность выборок
Большое число пациентов, включенных в исследование (391 человек), отбор пациентов сплошным методом, с минимальным набором критериев исключения, позволяют считать, что выборка пациентов в целом является репрезентативной в отношении популяции больных СД2, получающих плановую специализированную и высокотехнологичную медицинскую помощь в стационарных условиях.
Сопоставление с другими публикациями
Доля пациентов с атеросклерозом СА в нашей выборке пациентов оказалась довольно высокой (84%). Отчасти это может объясняться тем, что исследование проведено среди госпитальной выборки пациентов с достаточно длительным СД2. Распространенность поражений АНК оказалась почти в 2 раза ниже (48%). Интересно, что почти все пациенты с изменениями АНК имели признаки атеросклероза СА. Отличия в распространенности поражений сосудов двух областей могут быть связаны как с различиями в диагностических критериях, так и более ранним развитием изменений в СА, чем в АНК.
В предыдущих исследованиях установлено, что развитие атеросклероза СА у больных СД2 определяется сочетанием общепопуляционных (возраст, АГ, дислипидемия, курение и др.) и характерных для СД (гипергликемия, инсулинорезистентность) факторов риска [15–18]. В целом наши результаты согласуются с этими данными. В нашем исследовании установлены значения «отрезных точек» следующих факторов риска сочетанного поражения СА и АНК: возраст ≥65,5 года, соотношение ОТ/ОБ ≥0,967, длительность СД ≥12,5 года, длительность инсулинотерапии ≥4,5 года, длительность АГ ≥16,5 года. Независимыми факторами риска в модели многофакторного пошагового логистического анализа оказались возраст, длительность СД и соотношение ОТ/ОБ.
Некоторые из широко обсуждаемых факторов риска не нашли подтверждения в нашем исследовании. В частности, не была подтверждена связь атеросклероза с мужским полом. Это может объясняться преобладанием женщин в нашей выборке, что отражает особенность российской популяции больных СД2 [19]. Кроме того, женщины были несколько старше мужчин*, что могло нивелировать влияние пола как фактора риска. В нашем исследовании больные с поражением СА и АНК имели более низкий уровень холестерина ЛПНП и триглицеридов по сравнению с другими группами больных, что, очевидно, объясняется более высокой частотой применения гиполипидемической терапии в этой группе. Мы также не выявили значимости курения как фактора риска. В целом количество курильщиков среди обследованных нами пациентов было невелико (44 человека, 11,3%). К сожалению, мы не учитывали статус курения в прошлом и интенсивность курения.
В нашей когорте продолжительность диабета ≥12,5 года оказалась независимым фактором атеросклероза СА и АНК. При этом зависимости от уровня HbA1c не выявлено. Возможно, для развития атеросклероза большее значение имеет продолжительность воздействия гипергликемии, чем степень ее повышения. В ROC-анализе ВГ (MAGE ≥3,72 ммоль/л) оказалась ассоциирована с сочетанным атеросклерозом. В предыдущих исследованиях описана связь ВГ с ТКИМ СА и стенозом СА у больных СД2 [18][20]. Накапливаются данные о связи ВГ с сердечно-сосудистым риском [21]. Влияние ВГ на сосудистую стенку может быть опосредовано через окислительный стресс, неферментативное гликирование, хроническое воспаление, эндотелиальную дисфункцию, активацию тромбоцитов, нарушения ангиогенеза и почечный фиброз [22].
Проведенное исследование показало более высокую частоту других микрососудистых (ДР, ХБП) и макрососудистых (ИБС, ОНМК) поражений у больных СД с атеросклерозом СА и АНК. Тесная связь сосудистых осложнений может объясняться как общностью факторов риска, так и взаимоотягощающим течением. В частности, промотором прогрессирования атеросклероза признана ХБП [16, 17]. В нашем исследовании рСКФ была статически значимо ниже у больных с сочетанным атеросклерозом по сравнению с больными с изолированным поражением СА. При этом нам не удалось установить значимость ХБП как фактора риска в ROC-анализе и многофакторном анализе, что, вероятно, связано с относительно небольшой долей больных со снижением функции почек в нашей когорте.
В дополнение к «традиционным» факторам риска, мы оценили значение некоторых молекул, участвующих в ремоделировании сосудов и атерогенезе (кальпонин-1, релаксин, L-цитруллин, MMP-2, MMP-3) в качестве потенциальных биомаркеров атеросклероза. Выбор этих регуляторов был основан на их физиологических эффектах. Кальпонин-1 — белок, ассоциированный с тонкими миофиламентами, экспрессируется в гладкомышечных клетках и играет роль в сократимости гладкой мускулатуры [7]. Релаксин — пептидный гормон, регулирующий тонус сосудов [8]. L-цитруллин — заменимая альфа-аминокислота с антиоксидантными и сосудорасширяющими свойствами [9]. Ферменты-металлопротеиназы (MMP-2, MMP-3) участвуют в обмене коллагена, ремоделировании сосудов, репарации и ангиогенезе [10]. У больных СД2 нами зафиксировано повышение уровня кальпонина-1 и MMP-3, связь с развитием атеросклероза СА и АНК показал L-цитруллин. Ранее показана ассоциация между уровнем L-цитруллина в сыворотке крови и стенозом СА у больных СД2 [18]. Установлена значимость L-цитруллина как фактора сердечно-сосудистого риска у лиц без сердечно-сосудистых заболеваний [23]. Показано, что нарушения L-аргинин-NO-L-цитруллинового пути при СД связаны с воспалением и окислительным стрессом [24].
Клиническая значимость результатов
Полученные данные свидетельствуют о более частом развитии поражений СА по сравнению с АНК у больных СД2. Это свидетельствует о необходимости проведения ультразвукового исследования СА у всех больных СД2 с атеросклерозом АНК. Отрезные точки ряда факторов риска, найденные нами с помощью ROC-анализа, могут использоваться в клинической практике.
Ограничения исследования
К числу ограничений исследования следует отнести набор больных в одном клиническом центре и одномоментный дизайн, который не позволяет судить о причинно-следственных связях между признаками. Несбалансированность выборки по ряду параметров могла способствовать появлению ошибки 2-го рода, когда значимость ряда факторов риска осталась неучтенной. Так, например, отсутствие данных о статусе курения в прошлом могло быть причиной недооценки курения как фактора риска атеросклероза. Протяженность стенозов/окклюзий не оценивалась специально в данном исследовании. Группа сравнения без СД была в целом моложе основной группы, так как у всех скринированных лиц старше 65 лет были обнаружены либо сердечно-сосудистые заболевания, либо субклиническое поражение СА.
Направления дальнейших исследований
В будущих исследованиях с клинико-экономическим обоснованием необходимо определить целесообразность включения ультразвукового сканирования СА в стандарты оказания помощи больным СД. Актуальной задачей остается разработка программ вторичной и третичной профилактики атеросклероза СА и АНК у больных СД. Нарушения метаболизма L-цитруллина при СД, их патогенетическая и прогностическая значимость также заслуживают дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Результаты исследования демонстрируют высокую распространенность субклинического атеросклероза СА у больных СД2. Почти в половине случаев признаки поражения СА сочетаются с макроангиопатией нижних конечностей. Атеросклероз СА и АНК ассоциирован с микрососудистыми (ДР, ХБП) и макрососудистыми (ИБС, ИМ, ОНМК) осложнениями. Риск мультифокального атеросклероза у больных СД2 возрастает с возрастом, увеличением длительности СД и, вероятно, инсулинорезистентности и ВГ. Уровень L-цитруллина в сыворотке крови может рассматриваться как перспективный маркер атеросклероза.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено за счет средств государственного задания НИИКЭЛ — филиал ИЦиГ СО РАН.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Королева Е.А. — сбор клинического материала, статистический анализ данных, написание текста; Хапаев Р.С. — дуплексное сканирование артерий, написание текста; Лыков А.П. — специальные лабораторные исследования, написание текста; Корбут А.И. — статистический анализ, написание текста; Климонтов В.В. — концепция и дизайн исследования, анализ результатов, написание текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
* Средний возраст женщин и мужчин 66 (60–70) и 61,5 (55–68) лет соответственно, p=0,0004.
Список литературы
1. Barnes JA, Eid MA, Creager MA, Goodney PP. Epidemiology and Risk of Amputation in Patients With Diabetes Mellitus and Peripheral Artery Disease. Arterioscler Thromb Vasc Biol. 2020;40(8):1808-1817. doi: https://doi.org/10.1161/ATVBAHA.120.314595
2. Roger VL, Go AS, Lloyd-Jones DM, et al.; American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics — 2011 update: a report from the American Heart Association. Circulation. 2011;123(4):e18-e209. doi: https://doi.org/10.1161/CIR.0b013e3182009701 Erratum in: Circulation. 2011;123(6):e240. Erratum in: Circulation. 2011;124(16):e426.
3. Hoke, M., Schillinger, M., Minar, E. et al. Carotid ultrasound investigation as a prognostic tool for patients with diabetes mellitus. Cardiovasc Diabetol. 2019;18:90. doi: https://doi.org/10.1186/s12933-019-0895-0
4. Malmstedt J, Kärvestedt L, Swedenborg J, Brismar K. The receptor for advanced glycation end products and risk of peripheral arterial disease, amputation or death in type 2 diabetes: a population-based cohort study. Cardiovasc Diabetol. 2015;14:93. doi: https://doi.org/10.1186/s12933-015-0257-5
5. Nativel M, Potier L, Alexandre L, et al. Lower extremity arterial disease in patients with diabetes: a contemporary narrative review. Cardiovasc Diabetol. 2018;17(1):138. doi: https://doi.org/10.1186/s12933-018-0781-1
6. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 9-й вып. // Сахарный диабет. — 2019. — Т. 22. — Прил. 1S1. — С. 1-144. doi: https://doi.org/10.14341/DM221S1
7. Liu R, Jin J.-P. Calponin Isoforms CNN 1, CNN 2 and CNN 3: Regulators for Actin Cytoskeleton Functions in Smooth Muscle and Non-Muscle Cells. Gene 2016;585:143-153. doi: https://doi.org/10.1016/j.gene.2016.02.040
8. Teichman SL, Unemori E, Teerlink JR, et al. Relaxin: Review of Biology and Potential Role in Treating Heart Failure. Curr. Heart Fail. Rep. 2010;7:75-82. doi: https://doi.org/10.1007/s11897-010-0010-z
9. Allerton T, Proctor D, Stephens J, et al. L-Citrulline Supplementation: Impact on Cardiometabolic Health. Nutrients 2018;10:921. doi: https://doi.org/10.3390/nu10070921
10. Vacek T, Rahman S, Yu S, et al. Matrix Metalloproteinases in Atherosclerosis: Role of Nitric Oxide, Hydrogen Sulfide, Homocysteine, and Polymorphisms. Vasc. Health Risk Manag. 2015;11:173. doi: https://doi.org/10.2147/VHRM.S68415
11. Touboul PJ, Hennerici MG, Meairs S, et al. Mannheim carotid intimamedia thickness and plaque consensus (2004-2006-2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011. Cerebrovasc Dis. 2012;34(4):290-6. doi: https://doi.org/10.1159/000343145
12. Lim TK, Lim E, Dwivedi G, et al. Normal value of carotid intima-media thickness--a surrogate marker of atherosclerosis: quantitative assessment by B-mode carotid ultrasound. J Am Soc Echocardiogr. 2008;21(2):112-6. doi: https://doi.org/10.1016/j.echo.2007.05.002
13. Kim ES, Sharma AM, Scissons R, et al. Interpretation of peripheral arterial and venous Doppler waveforms: A consensus statement from the Society for Vascular Medicine and Society for Vascular Ultrasound. Vasc Med. 2020;25(5):484-506. doi: https://doi.org/10.1177/1358863X20937665
14. Hill N, Nick S, Choudhary P, et al. Normal Reference Range For Mean Tissue Glucose And Glycemic Variability Derived From Continuous Glucose Monitoring For Subjects Without Diabetes In Different Ethnic Groups. Diabetes Technol Ther. 2011;13(9):921-928. doi: https://doi.org/10.1089/Dia.2010.0247
15. Cardoso CRL, Marques CEC, Leite NC, Salles GF. Factors Associated with Carotid Intima-Media Thickness and Carotid Plaques in Type 2 Diabetic Patients. J Hypertens. 2012;30(5):940–947. doi: https://doi.org/10.1097/HJH.0b013e328352aba6
16. Yuan C, Lai CWK, Chan LWC, Chow M, Law HKW, Ying M. Cumulative Effects of Hypertension, Dyslipidemia, and Chronic Kidney Disease on Carotid Atherosclerosis in Chinese Patients with Type 2 Diabetes Mellitus. J Diabetes Res. 2014;2014:179686. doi: https://doi.org/10.1155/2014/179686
17. Zhou Y-Y, Qiu H.-M, Yang Y, Han Y.-Y. Analysis of Risk Factors for Carotid Intima-Media Thickness in Patients with Type 2 Diabetes Mellitus in Western China Assessed by Logistic Regression Combined with a Decision Tree Model. Diabetol Metab Syndr. 2020;12:8. doi: https://doi.org/10.1186/s13098-020-0517-8
18. Klimontov VV, Koroleva EA, Khapaev RS, Korbut AI, Lykov AP. Carotid Artery Disease in Subjects with Type 2 Diabetes: Risk Factors and Biomarkers. J Clin Med. 2021;11(1):72. doi: https://doi.org/10.3390/jcm11010072
19. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Атлас регистра сахарного диабета Российской Федерации. Статус 2018 г. // Сахарный диабет. — 2019. — T. 22. — 2S. — P. 4-61. doi: https://doi.org/10.14341/DM12208
20. Eto F, Washida K, Matsubara M, et al. Glucose Fluctuation and Severe Internal Carotid Artery Siphon Stenosis in Type 2 Diabetes Patients. Nutrients. 2021;13(7):2379. doi: https://doi.org/10.3390/nu13072379
21. Климонтов В.В. Влияние вариабельности гликемии на риск развития сердечно-сосудистых осложнений при сахарном диабете // Кардиология. — 2018. — Т. 58. — №10. — С. 80-87. doi: https://doi.org/10.18087/cardio.2018.10.10152
22. Klimontov VV, Saik OV, Korbut AI. Glucose Variability: How Does It Work? Int J Mol Sci. 2021;22(15):7783. doi: https://doi.org/10.3390/ijms22157783
23. Magnusson M, Wang T, Hedblad B, et al. High Levels of Arginine, Citrulline and ADMA Are Independent Predictors of Cardiovascular Disease. Eur Heart J. 2013;34:P5687–P5687. doi: https://doi.org/10.1093/eurheartj/eht310.P5687
24. Aguayo E, Martínez-Sánchez A, Fernández-Lobato B, Alacid F. L-Citrulline: A Non-Essential Amino Acid with Important Roles in Human Health. Appl. Sci. 2021;11:3293. doi: https://doi.org/10.3390/app11073293
Об авторах
Е. А. КоролеваРоссия
Королева Елена Анатольевна - кандидат медицинских наук, старший научный струдник ; Scopus Author ID: 55522435000.
Новосибирск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Р. С. Хапаев
Россия
Хапаев Рустам Сагитович - кандидат медицинских наук, старший научный струдник
Новосибирск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
А. П. Лыков
Россия
Лыков Александр Петрович, кандидат медицинских наук, ведущий научный струдник; Scopus Author ID: 7005078523
Новосибирск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
А. И. Корбут
Россия
Корбут Антон Иванович - кандидат медицинских наук, старший научный струдник; Scopus Author ID: 57151138800.
Новосибирск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
В. В. Климонтов
Россия
Климонтов Вадим Валерьевич - доктор медицинских наук, профессор; Researcher ID: R-7689-2017; Scopus Author ID: 8295977000.
630060, Новосибирск, ул. Тимакова, д. 2
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Ассоциации атеросклероза сонных артерий и артерий нижних конечностей с иными микро- и макрососудистыми осложнениями у больных сахарным диабетом 2 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(137KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Королева Е.А., Хапаев Р.С., Лыков А.П., Корбут А.И., Климонтов В.В. Сочетанное атеросклеротическое поражение сонных артерий и артерий нижних конечностей у больных сахарным диабетом 2 типа: факторы риска и биомаркеры. Сахарный диабет. 2023;26(2):172-181. https://doi.org/10.14341/DM12915
For citation:
Koroleva E.A., Khapaev R.S., Lykov A.P., Korbut A.I., Klimontov V.V. Association of carotid atherosclerosis and peripheral artery disease in patients with type 2 diabetes: risk factors and biomarkers. Diabetes mellitus. 2023;26(2):172-181. https://doi.org/10.14341/DM12915

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































