Перейти к:
Эффективность использования фиксированной комбинации инсулина гларгин 100 ЕД/мл и ликсисенатида у пациентов с сахарным диабетом 2 типа в условиях реальной амбулаторной практики: ретроспективное когортное исследование SOLO
https://doi.org/10.14341/DM12809
Аннотация
Актуальность. Эффективность и безопасность фиксированной комбинации (ФК) инсулина гларгин 100 Ед/мл и ликсисенатида для лечения пациентов с сахарным диабетом 2 типа (СД2) продемонстрирована в рамках обширной программы рандомизированных клинических исследований. Однако до сих пор отсутствовали данные о результатах применения препарата в реальной клинической практике в Российской Федерации.
Цель. Описать исходные характеристики больных с СД2, которые начали получать ФК инсулина гларгин 100 Ед/мл и ликсисенатида в период с ноября 2018 г. по июль 2020 г., и оценить эффективность использования ФК инсулина гларгин 100 Ед/мл и ликсисенатида (Соликва СолоСтар®) на протяжении 6–12 мес терапии в условиях реальной амбулаторной практики.
Материалы и методы. SOLO — ретроспективное когортное исследование, проведенное на территории Российской Федерации, в Москве. В исследование включались взрослые (≥18 лет) пациенты с СД2, с уровнем HbA1c ≥7% при наличии доступной ретроспективной медицинской информации за период ≥180 дней до старта терапии ФК инсулина гларгин 100 Ед/мл и ликсисенатида и при наличии одного или более результата HbA1c в течение 150–210 дней после начала терапии.
Результаты. В исследование были включены 383 человека. Средний возраст составил 59,9±8,3 года; ИМТ — 36,4±6,3 кг/м2; доля пациентов с ИМТ≥35 кг/м2 — 52,2%. Начальный уровень HbA1c — 9,14±1,08%. 65,0% пациентов исходно получали пероральные сахароснижающие препараты (ПССП); 31,3% — ПССП в сочетании с базальным инсулином (БИ), 1,0% — другую терапию (агонисты рецепторов глюкагоноподобного пептида 1, базис-болюсную инсулинотерапию, монотерапию базальным инсулином), без сахароснижающей терапии на момент индексного события находились 2,6% пациентов. Средний уровень HbA1c через 6 мес терапии составил 7,78±0,80%, через 12 мес — 7,40±0,61%. Отмечено статистически значимое снижение массы тела (101,62±20,64 кг) на 1,96±4,03 кг за 6 мес и на 3,13±4,71 кг за 12 мес наблюдения (p<0,001). В течение 12 мес терапии у 4 пациентов (1,04%) были отмечены подтвержденные симптоматические гипогликемии (гликемия ≤3,9 ммоль/л). Тяжелых гипогликемий не зарегистрировано.
Заключение. В реальной амбулаторной практике назначение ФК инсулина гларгин 100 Ед/мл и ликсисенатида пациентам с СД2, не достигшим целевых значений гликемического контроля на ПССП или ПССП в комбинации с БИ, приводило к улучшению показателей гликемического контроля и снижению массы тела, c низким риском гипогликемий.
Ключевые слова
Для цитирования:
Анциферов М.Б., Демидов Н.А., Балберова М.А., Сафронова Т.И., Мишра О.А., Магомедова С.Г. Эффективность использования фиксированной комбинации инсулина гларгин 100 ЕД/мл и ликсисенатида у пациентов с сахарным диабетом 2 типа в условиях реальной амбулаторной практики: ретроспективное когортное исследование SOLO. Сахарный диабет. 2022;25(2):112-119. https://doi.org/10.14341/DM12809
For citation:
Antsiferov M.B., Demidov N.A., Balberova M.A., Safronova T.I., Mishra O.A., Magomedova S.G. Real World Effectiveness of fixed combination of glargine 100 U/ml and lixisenatide therapy in outpatients with Type 2 Diabetes: A Retrospective Cohort Study SOLO. Diabetes mellitus. 2022;25(2):112-119. (In Russ.) https://doi.org/10.14341/DM12809
АКТУАЛЬНОСТЬ
Достижение целей гликемического контроля играет ключевую роль в профилактике развития микро- и макрососудистых осложнений при сахарном диабете 2 типа (СД2). Согласно современным российским и международным рекомендациям, при недостижении индивидуальных целевых значений гликемического контроля необходима своевременная интенсификация терапии [1][2]. В «Алгоритмах специализированной медицинской помощи больным сахарным диабетом» (10-е издание, 2021 г.) фиксированная комбинация (ФК) агониста рецепторов глюкагоноподобного пептида 1 (арГПП-1) и базального инсулина (БИ) рассматривается в качестве опции для интенсификации терапии у пациентов, не достигших целевых значений гликемического контроля как на терапии пероральными сахароснижающими препаратами (ПССП), так и на ПССП в сочетании с БИ [3].
Учитывая прогрессирующее течение СД2, многим пациентам со временем требуется назначение инъекционной терапии. Нередко такая терапия начинается с БИ [4], который обеспечивает эффективное снижение уровня глюкозы плазмы натощак (ГПН). Однако сохраняющаяся постпрандиальная гипергликемия (ППГ) обусловливает недостижение целевого уровня гликированного гемоглобина (НbА1с) [5]. При этом ФК арГПП-1 и БИ позволяют контролировать как ГПН, так и ППГ без увеличения риска развития побочных эффектов и массы тела. На сегодняшний день в РФ доступны ФК инсулина деглудек 100 Ед/мл с лираглутидом и инсулина гларгин 100 Ед/мл с ликсисенатидом (иГларЛикси). ФК иГларЛикси показана для использования как в монотерапии, так и в комбинации с метформином и/или препаратами из группы ингибиторов натрий-глюкозного котранспортера 2 типа при лечении взрослых пациентов с СД2 для улучшения показателей гликемического контроля. ФК арГПП-1 и БИ подходят большинству пациентов с СД2 и могут повысить приверженность пациента терапии за счет удобного режима введения (1 раз в день) и дозирования.
Исследование SOLO — это ретроспективное когортное исследование, проведенное в Москве (РФ) с использованием данных больных СД2, которые начали получать терапию ФК иГларЛикси в период с ноября 2018 г. по июль 2020 г. для оценки эффективности ее использования на протяжении 6 и 12 мес в условиях реальной амбулаторной практики.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
В ретроспективное когортное исследование реальной амбулаторной практики были включены пациенты с СД2, которые в период с ноября 2018 г. до июля 2020 г. начали получать ФК иГларЛикси (индексное событие). В исследовании были проанализированы медицинские данные пациентов, длительность приема иГларЛикси у которых составляла не менее 6 мес.
Основным критерием включения медицинской документации пациентов в исследование было наличие данных о непрерывном приеме иГларЛикси как минимум в течение 6 мес. При этом в амбулаторных картах пациентов должна была содержаться информация не менее чем за 180 дней (6 мес) до индексного события. Данные получали из медицинских карт и историй болезни пациентов. В рамках данного исследования не проводились вмешательства в принятые методы оказания медицинской помощи. Включение в исследование не влияло на терапию пациентов.
Исследуемые параметры: социально-демографические показатели (возраст, пол, расовая принадлежность), анамнез СД2, общий медицинский анамнез (данные о наличии сопутствующих заболеваний), уровень HbA1c (методом высокоэффективной жидкостной хроматографии под высоким давлением (метод HPLC), сертифицированным в соответствии с National Glycohemoglobin Standardization Program (NGSP) или International Federation of Clinical Chemists (IFCC) и стандартизованным в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT)), ГПН (глюкозооксидазным методом), масса тела, индекс массы тела (ИМТ), параметры терапии ФК иГларЛикси (дата начала лечения, тип используемой шприц-ручки, доза и ее титрация, окончание терапии), другие препараты, применяемые в терапии СД2, терапия сопутствующих заболеваний, объемы получения медицинской помощи (количество амбулаторных приемов, госпитализации, вызовов скорой и неотложной помощи), эпизоды гипогликемии.
Полностью ретроспективный сбор основан на дате индексного события (даты начала терапии ФК иГларЛикси в период набора пациентов). Дизайн исследования представлен на рис. 1.
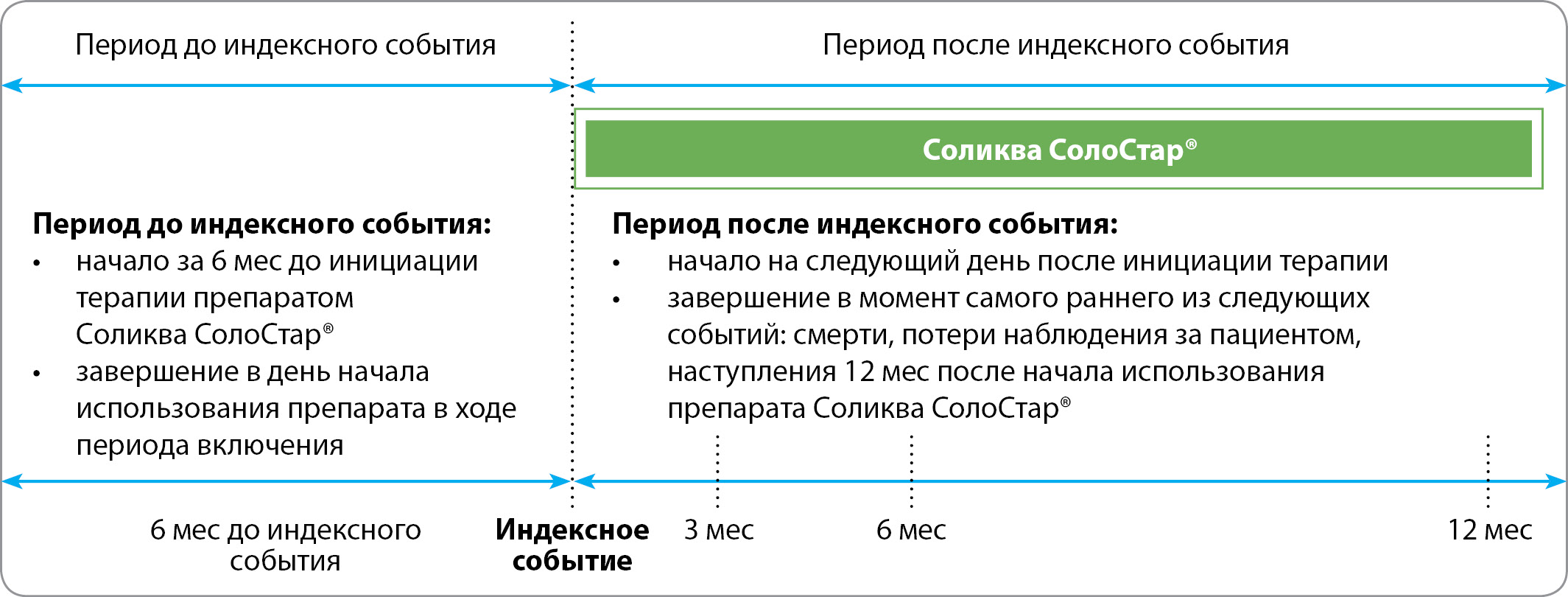
Рисунок 1. Дизайн исследования.
Индексное событие — начало терапии ФК иГларЛикси.
Критерии включения в исследование: СД2, возраст ≥18 лет; терапия ФК иГларЛикси, начатая в период с ноября 2018 г. по июль 2020 г.; наличие доступной ретроспективной медицинской информации за период ≥180 дней до старта терапии ФК иГларЛикси; уровень HbA1c≥7% в течение 90 дней до и/или в течение 14 дней после начала терапии ФК иГларЛикси; наличие одного или более результатов HbA1c в течение 150–210 дней после старта указанной терапии (6±1 мес).
Критерии исключения: ранее проводимая терапия ФК инсулина деглудек 100 Ед/мл с лираглутидом или иГларЛикси; СД1 или другие формы диабета (кроме СД2); гестационный сахарный диабет.
Определение размеров популяции исследования
Расчет размера выборки проводился с учетом основной цели исследования, которая состоит в оценке динамики уровня HbA1c через 6 мес после назначения ФК иГларЛикси в сравнении с исходным показателем. Расчет основан на двустороннем 95% доверительном интервале (ДИ) для изменения среднего (рассчитанного методом наименьших квадратов) HbA1c между исходным значением и показателем, полученным через 6 мес (или в любой определенный момент). Размер выборки составил 383 пациента при предположительном стандартном отклонении, равном 2, для изменения HbA1c в сравнении с исходным показателем, а также точности (ширины 95% ДИ), равной 0,2.
Первичная и дополнительные конечные точки
Первичная конечная точка: динамика уровня НbА1с и ГПН через 6 мес после старта терапии ФК иГларЛикси.
Вторичные конечные точки в исследовании: динамика уровня НbА1с и ГПН через 12 мес после старта терапии; время до достижения контроля гликемии (HbA1c<7%, снижение уровня HbA1c≥1%); динамика массы тела через 6 и 12 мес; особенности титрации дозы ФК иГларЛикси и использование других ПССП; данные об обращении за медицинской помощью и эпизодах гипогликемии.
Оценка безопасности проводимой терапии включала учет всех эпизодов гипогликемии, внесенных в электронную историю болезни. Проводился анализ зафиксированных симптоматических гипогликемий (уровень глюкозы крови ≤3,9 ммоль/л), а также тяжелых гипогликемий.
Статистический анализ
Категориальные признаки представлены в виде числа случаев (n) и частот (%). Непрерывные переменные представлены с использованием средних значений, стандартного отклонения (СО), медианы, квартилей и диапазонов значений. Выполнены статистические тесты — парный и непарный t-тесты. Для оценки эпизодов гипогликемии и получения медицинской помощи применены модели счетных данных. Статистический анализ выполнен с использованием R: языка и среды программирования для статистических расчетов (R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/) версии 4.0.2. Порогом статистической значимости различий считается значение р<0,05.
В статистический анализ включены следующие популяции пациентов: основной анализ данных основан на полной популяции анализа (Full Analysis Set, FAS); анализ популяции (Per protocol) — пациенты, не имеющие отклонений от критериев включения.
РЕЗУЛЬТАТЫ
Участники исследования
В исследование включены 383 пациента с СД2 (Full Analysis Set). Популяция пациентов, не имеющих отклонений от критериев включения (Per protocol), составила 361 чел. У 22 чел. (5,74%) выявлены отклонения от протокола исследования: у 7 чел. (1,8%) отсутствовали данные об уровне HbA1c в течение 90 дней до и/или 14 дней после начала терапии ФК иГларЛикси; у 15 чел. (3,9%) отсутствовали данные об уровне HbA1c в течение 150–210 дней с момента индексного события.
Средний возраст пациентов составил 59,9±8,3 года. Соотношение пациентов моложе и старше 65 лет составило 72,3/27,7%, мужчин и женщин 32,6/67,4%. Из сопутствующих заболеваний и осложнений СД на момент включения у 70,8% пациентов имелся подтвержденный диагноз артериальной гипертензии, у 37,9% — дислипидемии, у 33,2% — диабетической нефропатии, у 73,9% — нейропатии, у 6,3% — хронической сердечной недостаточности. Медиана длительности СД2 составила 10 лет, средний ИМТ — 36,4±6,3 кг/м2, доля пациентов с ИМТ≥35 кг/м2 — 52,2%, средний уровень HbA1c при включении в исследование — 9,14%, доля пациентов с HbA1c≥9% — 47,8%.
Большинство пациентов (249 чел., 65,0%) первично получали ПССП. Средний ИМТ в данной группе составил 36,46±6,43 кг/м2, средний возраст 59,67±8,3 года, средняя продолжительность заболевания 107,47±67,48 мес. Средний уровень HbA1c в этой группе исходно составлял 9,15±1,16%. ПССП в сочетании с базальным инсулином получали 31,3% (120) пациентов, средний исходный уровень HbA1c в этой группе составлял 9,13±0,95%. Средний ИМТ в данной группе составил 36,05±6,28 кг/м2, средний возраст — 60,20±8,42 года, средняя продолжительность заболевания СД2 — 146,75±87,06 мес. Другие виды терапии получали 4 (1%) пациента: 2 пациента находились на базисно-болюсной терапии, 1 пациент — на терапии инсулином гларгин 300 Ед/мл, 1 пациент — на терапии арГПП-1 в сочетании с производными сульфонилмочевины и метформином. Средний исходный уровень HbA1c в этой группе составлял 8,55±1,08%. Без терапии на момент назначения ФК иГларЛикси находились 10 (2,6%) пациентов со средним исходным HbA1c 9,53±0,57%.
Первичная конечная точка: эффективность терапии ФК инсулина гларгин 100 Ед/мл и ликсисенатида
Средние уровни HbA1c и ГПН у пациентов с СД2 на момент включения в исследование составили 9,14±1,08% и 9,52±1,83 ммоль/л соответственно. Через 6 мес терапии отмечено статистически значимое снижение обоих показателей. Среднее снижение HbA1c от исходного составило 1,38 и 1,74% через 6 и 12 мес соответственно. Среднее снижение ГПН — 2,09 и 2,47 ммоль/л через 6 и 12 мес. Данные представлены на рис. 2.
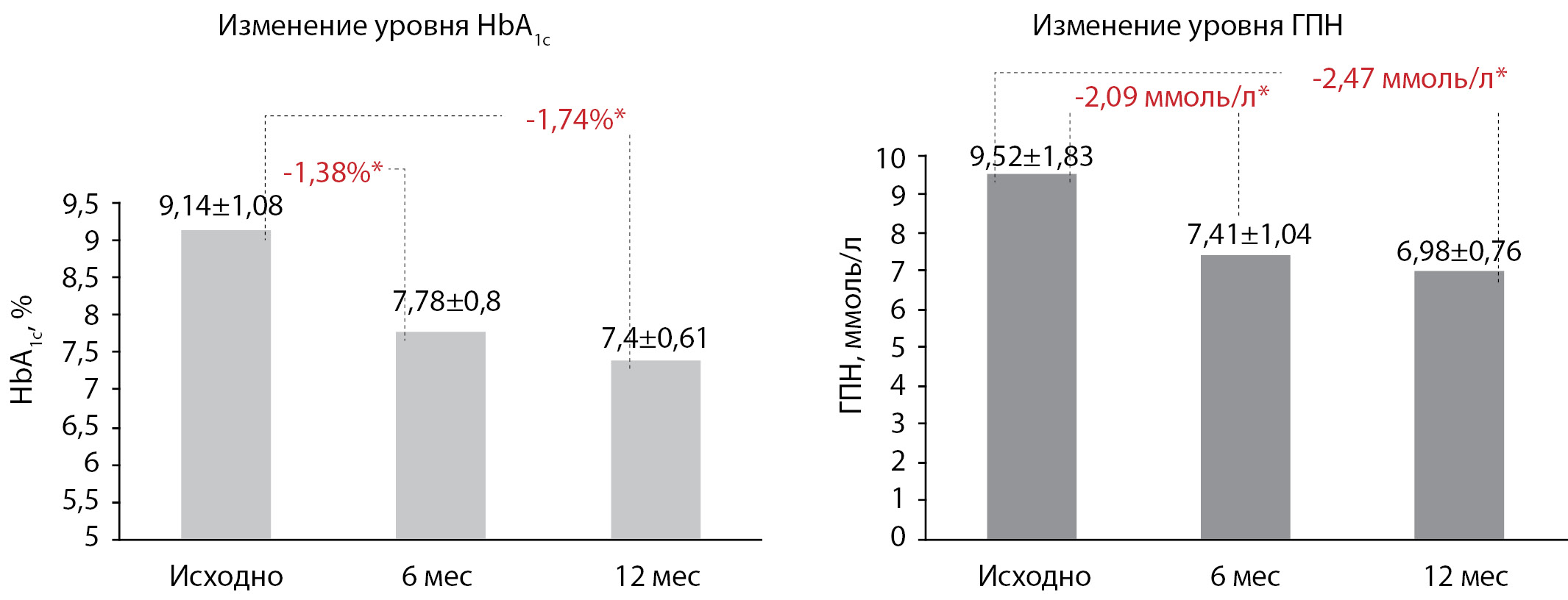
Рисунок 2. Уровни гликированного гемоглобина и глюкозы плазмы натощак исходно, через 6 и 12 мес терапии.
Примечание. *p<0,001.
В общей популяции пациентов через 12 мес терапии 18,3% больных достигли уровня HbA1c<7,0%, 55,6% — уровня HbA1c<7,5%. Также через 12 мес снижение уровня HbA1c≥1,0% отмечено у 85%, на ≥1,5% — у 61% пациентов.
При анализе динамики HbA1c после старта терапии было продемонстрировано его снижение в группе пациентов на ПССП на 1,47 и 1,82% через 6 и 12 мес соответственно (p<0,001 для обоих значений). В группе пациентов, исходно получавших ПССП+БИ, уровень HbA1c снизился в среднем на 1,2 и 1,59% через 6 и 12 мес соответственно.
Динамика массы тела
На протяжении исследования отмечено статистически значимое снижение массы тела от исходных значений (101,62±20,64 кг) на 2,0 кг за 6 мес и на 3,1 кг за 12 мес терапии (p<0,001). На момент индексного события медиана массы тела составила 98,00 [ 87,00–112,00] кг, спустя 6 мес — 96,00 [ 87,00–110,00] кг, спустя 12 мес — 95,00 [ 85,00–110,00] кг. Также была проанализирована динамика массы тела в зависимости от исходной сахароснижающей терапии. Снижение массы тела в группе исходной терапии ПССП составило 1,72 (-2,25; -1,19) кг и 2,95 (-3,57; -2,33) кг через 6 и 12 мес наблюдения соответственно, в группе исходной терапии ПССП+БИ — 2,23 (-3,0; -1,46) кг и 3,26 (-4,17; -2,36) кг через 6 и 12 мес наблюдения соответственно.
Динамика доз препарата
Медиана стартовой дозы препарата составила 20 Ед [ 10; 30], медиана поддерживающей дозы — 40 Ед [ 32; 46], длительность периода титрации (медиана) — 131 день [ 100; 184]. Шприц-ручку 10–40 использовали 269 (70,2%) пациентов, шприц-ручку 30–60 — 113 (29,5%). Большинство пациентов — 244 (63,7%) вводили препарат перед завтраком.
В группе пациентов на терапии ПССП медиана стартовой дозы ФК иГларЛикси 14 [ 10;30] Ед, в группе пациентов, исходно получавших ПССП+БИ, — 25 [ 10; 30] Ед. Поддерживающие дозы были сходными в обеих группах: 40 [ 30; 44] и 42 [ 36;52] Ед в сутки соответственно.
Гипогликемии
В медицинской документации 4 (1,04%) пациентов были зафиксированы подтвержденные симптоматические гипогликемии (уровень гликемии ≤3,9 ммоль/л) на фоне терапии иГларЛикси. Тяжелых гипогликемий зарегистрировано не было (рис. 3).
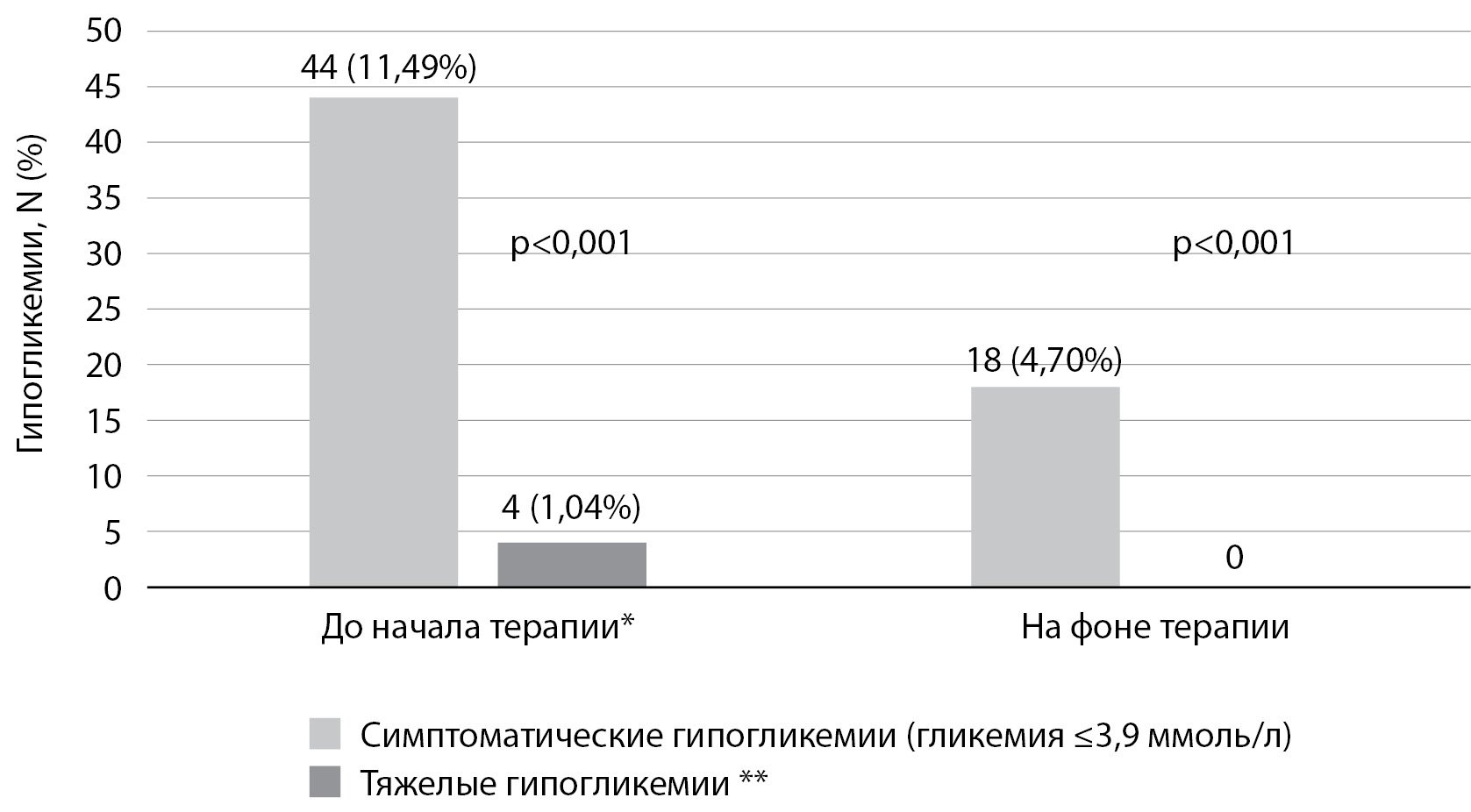
Рисунок 3. Количество пациентов с подтвержденными гипогликемиями на протяжении исследования.
Примечание. n (%) = количество и процент пациентов, у которых развился как минимум один эпизод гипогликемии.
* Период до начала терапии — период начинается за 180 дней до назначения ФК инсулина гларгин 100 Ед/мл и ликсисенатида и заканчивается в момент инициации терапии; период после начала терапии — период начинается на следующий день после инициации терапии ФК инсулина гларгин 100 Ед/мл и ликсисенатида и завершается при наступлении самого раннего из следующих событий: смерти, потери наблюдения за пациентом или истечения 12 мес после начала получения ФК инсулина гларгин 100 Ед/мл и ликсисенатида.
** Тяжелая гипогликемия регистрируется при выявлении уровня глюкозы в плазме крови <3 ммоль/л, или гипогликемия привела к госпитализации/обращению за скорой и/или неотложной медицинской помощью.
Частота гипогликемий также оценена в зависимости от проводимой сахароснижающей терапии. В группе исходной терапии ПССП эпизоды гипогликемии до индексного события зафиксированы у 22 (8,84%) пациентов, после начала терапии иГларЛикси эпизоды легкой гипогликемии были зарегистрированы у 2 пациентов (0,8%). В группе исходной терапии ПССП+БИ эпизоды гипогликемии до индексного события были зарегистрированы у 17 (14,17%) пациентов, после старта терапии ФК иГларЛикси — у 2 (1,7%) пациентов. В группах пациентов, не получавших лечения или находившихся на другой сахароснижающей терапии до индексного события, 1 (25%) и 4 (40%) пациента испытывали гипогликемию. После индексного события в этих группах гипогликемии не отмечалось (0%).
Обращение за медицинской помощью
Были изучены данные об обращении пациентов за медицинской помощью (амбулаторно или стационарно). Амбулаторно пациенты обращались в 91,1% в первые 6 мес терапии и в 92,2% случаев— с 6-го по 12-й месяцы терапии. В подавляющем большинстве случаев (89,0 и 90,3% соответственно) это были обращения к эндокринологу. В 21,7 и 21,1% случаев в первые и последующие 6 мес терапии — обращения к врачу общей практики. Наиболее часто пациенты обращались для коррекции сахароснижающей терапии (85,6% в первые 6 мес и 81,22% — с 7-го по 12-й месяцы наблюдения).
ОБСУЖДЕНИЕ
Эффективность и безопасность ФК иГларЛикси были продемонстрированы в рамках обширной программы клинических исследований, а также в ряде объединенных анализов результатов рандомизированных контролируемых исследований (РКИ) LixiLan-O, LixiLan-L, LixiLan-G и Solimix [6][7]. В проведенных исследованиях ФК иГларЛикси показала более высокую сахароснижающую эффективность по сравнению с БИ (инсулин гларгин), арГПП-1 (ликсисенатидом), смешанным инсулином (двухфазный аспарт 30) в отношении снижения уровня HbA1c. Кроме того, отмечено положительное влияние на массу тела и отсутствие дополнительного риска развития гипогликемии [8]. На основании данных РКИ было продемонстрировано, что перевод на терапию ФК иГларЛикси приводил к улучшению показателей гликемического контроля у пациентов, не достигших целевых значений на терапии арГПП-1 и/или ПССП либо ПССП в сочетании с БИ [9].
Выбор ретроспективного дизайна исследования SOLO обусловлен потребностью в получении данных реальной практики оказания амбулаторной медицинской помощи. Выбранный дизайн соответствует основной цели исследования, поскольку информация об исходных характеристиках пациентов и ключевых конечных точках доступна для получения из первичной медицинской документации.
В нашем исследовании продемонстрировано статистически значимое улучшение показателей гликемического контроля (HbA1c и ГПН) после перевода на терапию (либо добавления к терапии) ФК иГларЛикси. При этом основное улучшение гликемического контроля произошло в первые 6 мес терапии [медиана периода титрации дозы препарата составила 131 день (19 нед)]. За период титрации дозировка ФК иГларЛикси была увеличена в среднем в 2 раза: стартовая доза 20 [ 10; 30], поддерживающая доза — 40 [ 32;46] Ед. Важно отметить, что в исследовании Lixilan-L доза препарата 41,4 Ед была достигнута уже к 12-й неделе терапии. Данный факт закономерно отражает отличия процесса титрации, осуществляемого в рамках РКИ и в реальной клинической практике.
Отдельно была проанализирована динамика уровня HbA1c после старта терапии ФК иГларЛикси в группах пациентов, исходно получавших разную сахароснижающую терапию. В группе пациентов, исходно получавших ПССП, среднее снижение HbA1c превышало снижение уровня HbA1c в группе ПССП+БИ. Также в группе исходной терапии ПССП медиана стартовой дозы ФК иГларЛикси была закономерно меньше, чем в группе ПССП+БИ. При этом к окончанию периода титрации дозы ФК иГларЛикси в обеих группах были сходными.
Более выраженное улучшение показателей гликемического контроля в группе пациентов на исходной терапии ПССП ожидаемо, т.к. пациентам сразу назначается комбинированный препарат, воздействующий на разные звенья патогенеза СД2 и влияющий одновременно на уровень ГПН и ППГ.
Современные подходы к инициации инъекционной терапии СД2 предполагают выбор из нескольких опций. Это могут быть старт с БИ, аГПП-1 или их фиксированной комбинации, базис-болюсная инсулинотерапия либо смешанный инсулин. Наиболее простыми и часто используемыми вариантами старта инъекционной терапии являются использование базального инсулина или арГПП-1. Вместе с тем, по данным реальной клинической практики, менее 25% пациентов с СД2 достигают уровня HbA1c<7% в течение 12 мес с момента инициации терапии базальным инсулином или аГПП-1, имея исходный уровень HbA1c≥9% [10].
Обращает на себя внимание, что в группе пациентов, исходно получавших ПССП и БИ, была также отмечена выраженная динамика снижения уровня HbA1c. Высокий исходный уровень HbA1c в данной группе мог быть обусловлен недостаточной дозой БИ вследствие его неэффективно проведенной титрации. Это является часто встречающейся проблемой инсулинотерапии в реальной клинической практике. Подтверждением служит тот факт, что стартовая доза ФК иГларЛикси составила всего 25 единиц препарата и в процессе титрации была увеличена до 42 единиц.
С другой стороны, достижение целевых значений ГПН с помощью титрации дозы БИ не гарантирует достижения целевых значений HbA1c, так как рост дозы БИ существенно не влияет на контроль ППГ. Пациенты с высоким уровнем ППГ при хорошем контроле ГПН могут быть целевой группой для назначения ФК арГПП1 и БИ. Так, в post hoc анализе исследования LixiLan-L было показано, что у пациентов с уровнем HbA1c≥7,0% и ГПН менее 7,8 ммоль/л на фоне БИ перевод на ФК иГларЛикси сопровождался значимым улучшением гликемического контроля [11]. При этом назначение ФК иГларЛикси, по данным исследований LixiLan-O и LixiLan-L, обеспечивает улучшение параметров вариабельности гликемии (глюкозы плазмы по данным самоконтроля, индексов риска гипергликемии и гипогликемии, площади под кривой гликемии по данным самоконтроля, средней амплитуды колебаний гликемии) в сравнении с исходными значениями. Это происходило без увеличения риска гипогликемии [12].
Поскольку препарат ФК иГларЛикси представляет комбинацию арГПП-1 и БИ, то в зоне особого интереса находится динамика массы тела. В проведенном исследовании на фоне терапии ФК иГларЛикси отмечено статистически значимое снижение массы тела в сравнении с исходными значениями: на 2,0 кг за 6 мес и 3,1 кг за 12 мес терапии. При этом в группе пациентов, изначально получавших ПССП, снижение массы тела было менее выраженным, чем в группе пациентов, исходно получавших БИ и ПССП.
В исследование вошли небольшое количество пациентов, исходно не получавших сахароснижающую терапию (n=10). Исходный уровень HbA1c в этой группе был достаточно высоким и составлял 9,53±0,57%. Для этих пациентов назначение ФК иГларЛикси было стартом сахароснижающей терапии. Масса тела у этих пациентов снизилась в среднем на 3,5 и 5,25 кг через 6 и 12 мес соответственно.
Таким образом, снижение массы тела отмечено во всех группах терапии. Более выраженной динамика была в группах пациентов, исходно не получавших сахароснижающих препаратов или переведенных с терапии ПССП и БИ.
К вторичным конечным точкам исследования относилась также оценка безопасности терапии, в частности риск гипогликемических состояний, который фиксировали ретроспективно из медицинской документации за период 6 мес до старта терапии ФК иГларЛикси, а также в течение первых и последующих 6 мес после старта терапии. За 12 мес наблюдения было отмечено 4 подтвержденных симптоматических гипогликемии (уровень гликемии ≤3,9 ммоль/л). Тяжелых гипогликемий зарегистрировано не было. Вероятно, снижение частоты гипогликемических состояний при переводе на терапию иГларЛикси обусловлено отменой препаратов сульфонилмочевины.
Зафиксированы несколько случаев госпитализации (9 (2,3%) и 7 (1,8%) за первые 6 и последующие 6 мес терапии препаратом), все случаи госпитализации были плановыми.
Следует отметить, что ретроспективный дизайн исследования не дает возможности всесторонней оценки частоты гипогликемических состояний. Кроме того, определенный интерес могло бы представлять изучение вариабельности гликемии в процессе терапии.
ЗАКЛЮЧЕНИЕ
В реальной амбулаторной практике назначение ФК иГларЛикси пациентам с СД2, не достигшим целевых значений гликемического контроля на ПССП или ПССП в комбинации с БИ, приводило к улучшению показателей гликемического контроля и снижению массы тела. При этом отмечался низкий риск гипогликемий в сравнении с исходным уровнем.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Информация о конфликте интересов
М.Б. Анциферов входил в состав экспертных советов, организованных компаниями Boehringer Ingelheim, Eli Lilly, Novo Nordisk, Sanofi, Takeda, Lifescan, Novartis, MSD, Astellas, Merck, Abbott, AstraZeneca; участвовал в клинических исследованиях компаний Boehringer Ingelheim, AstraZeneca, Novartis, MSD, Takeda, «Герофарм», Bristol-Мауеrs Squibb; выступал в качестве председателя мероприятий в рамках конференций, съездов, конгрессов, организованных при участии компаний Eli Lilly, AstraZeneca, Novartis, Novo Nordisk, MSD, Sanofi, Boehringer Ingelheim, Eli Lilly, Abbott, Lifescan, Ascensia, Roche, Astellas, Takeda, Mersk, Ipsen, Stada, Promomed.
Н.A. Демидов входил в состав экспертных советов, организованных Boehringer Ingelheim, Novo Nordisk, Sanofi, Novartis, Astra Zeneca и читал лекции для компаний: Boehringer Ingelheim, Eli Lilly, Novo Nordisk, Sanofi, Novartis, Astra Zeneca, «Герофарм», MSD, Abbot, Medtronic, «Элта».
Сафронова Татьяна Ильдаровна сотрудничала как лектор с компаниями Boerhinger Ingelheim, Eli Lilly, Novo Nordisk, Sanofi.
Балберова Мария Александровна, Магомедова Саадат Гаджиевна, Мишра Ольга Александровна сообщили об отсутствии конфликта интересов.
Информация о финансировании. Исследование спонсировалось компанией Sanofi, Париж, Франция. Спонсор принимал участие в разработке протокола. Первый черновой вариант рукописи был подготовлен ООО «Лиганд Ресерч» при поддержке компании Sanofi.
Участие авторов. Анциферов М.Б. — главный исследователь SOLO, участвовал в создании концепции и планировании исследования, также осуществлял редактирование и финальное утверждение рукописи; Демидов Н.А. — создание концепции и планирование исследования, редактирование и финальное утверждение рукописи; Балберова М.А. — сбор данных, редактирование и финальное утверждение рукописи; Сафронова Т.И. — сбор данных, редактирование и финальное утверждение рукописи; Мишра О.А. — сбор данных, редактирование и финальное утверждение рукописи; Магомедова Саадат Гаджиевна — сбор данных, редактирование и финальное утверждение рукописи.
Список литературы
1. American Diabetes Association. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes — 2021. Diabetes Care. 2021;44(S1):S111-S124. doi: https://doi.org/10.2337/dc21-S009
2. Davies MJ, D’Alessio DA, Fradkin J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018;41(12):2669-2701. doi: https://doi.org/10.2337/dci18-0033
3. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (10-й выпуск) // Сахарный диабет. — 2021. — 24 (S1). doi: https://doi.org/10.14341/DM12802
4. Khunti K, Giorgino F, Berard L, et al. The importance of the initial period of basal insulin titration in people with diabetes. Diabetes Obes Metab. 2020;22(5):722-733. doi: https://doi.org/10.1111/dom.13946
5. Arnolds S, Kuglin B, Kapitza C, Heise T. How pharmacokinetic and pharmacodynamic principles pave the way for optimal basal insulin therapy in type 2 diabetes. Int J Clin Pract. 2010;64(10):1415-1424. doi: https://doi.org/10.1111/j.1742-1241.2010.02470.x
6. Lixisenatide and iGlarLixi (insulin glargine/lixisenatide fixed-ratio combination) for the treatment of type2 diabetes mellitus [Internet]. Food and Drug Administration. 2016 [cited 2020 Oct 29]. Available from: https://www.fda.gov/media/97767/download
7. Rosenstock J, Emral R, Sauque-Reyna L, et al. Advancing Therapy in Suboptimally Controlled Basal Insulin–Treated Type 2 Diabetes: Clinical Outcomes With iGlarLixi Versus Premix BIAsp 30 in the SoliMix Randomized Controlled Trial. Diabetes Care. 2021;44(10):2361-2370. doi: https://doi.org/10.2337/dc21-0393
8. Aroda VR, Rosenstock J, Wysham C, et al. Efficacy and Safety of LixiLan, a Titratable Fixed-Ratio Combination of Insulin Glargine Plus Lixisenatide in Type 2 Diabetes Inadequately Controlled on Basal Insulin and Metformin: The LixiLan-L Randomized Trial. Diabetes Care. 2016;39(11):1972-1280. doi: https://doi.org/10.2337/dc16-1495
9. Blonde L, Rosenstock J, Del Prato S, et al. Switching to iGlarLixi Versus Continuing Daily or Weekly GLP-1 RA in Type 2 Diabetes Inadequately Controlled by GLP-1 RA and Oral Antihyperglycemic Therapy: The LixiLan-G Randomized Clinical Trial. Diabetes Care. 2019;42(11):2108-2116. doi: https://doi.org/10.2337/dc19-1357
10. Peng XV, McCrimmon RJ, Shepherd L, et al. Glycemic control following GLP-1 RA or basal insulin initiation in real-world practice: a retrospective, observational, longitudinal cohort study. Diabetes Ther. 2020;11(11):2629-2645. doi: https://doi.org/10.1007/s13300-020-00905-y
11. Morea N, Retnakaran R, Vidal J, et al. iGlarLixi effectively reduces residual hyperglycaemia in patients with type 2 diabetes on basal insulin: A post hoc analysis from the LixiLan-L study. Diabetes Obes Metab. 2020;22(9):1683-1689. doi: https://doi.org/10.1111/dom.14077
12. Aronson R, Umpierrez G, Stager W, Kovatchev B. Insulin glargine/lixisenatide fixed-ratio combination improves glycaemic variability and control without increasing hypoglycaemia. Diabetes Obes Metab. 2019;21(3):726-731. doi: https://doi.org/10.1111/dom.13580
Об авторах
М. Б. АнциферовАнциферов Михаил Борисович, доктор медицинских наук, профессор
Москва
eLibrary SPIN: 1035-4773
Конфликт интересов:
М.Б. Анциферов входил в состав экспертных советов, организованных компаниями Boehringer Ingelheim, Eli Lilly, Novo Nordisk, Sanofi, Takeda, Lifescan, Novartis, MSD, Astellas, Merck, Abbott, AstraZeneca; участвовал в клинических исследованиях компаний Boehringer Ingelheim, AstraZeneca, Novartis, MSD, Takeda, Герофарм, Bristol - Мауеrs Squibb; выступал в качестве председателя мероприятий в рамках конференций, съездов, конгрессов, организованных при участии компаний Eli Lilly, AstraZeneca, Novartis, Novo Nordisk, MSD, Sanofi, Boehringer Ingelheim, Eli Lilly, Abbott, Lifescan, Ascensia, Roche, Astellas, Takeda, Mersk, Ipsen, Stada, Promomed.
Н. А. Демидов
Россия
Демидов Николай Александрович, кандидат медицинских наук, врач-эндокринолог
108811, г.Москва, Московский, мкр. 3, стр 7
eLibrary SPIN: 7715-4508
Конфликт интересов:
Н.A. Демидов входил в состав экспертных советов, организованных Boehringer Ingelheim, Novo Nordisk, Sanofi, Novartis, Astra Zeneca и читал лекции для компаний: Boehringer Ingelheim, Eli Lilly, Novo Nordisk, Sanofi, Novartis, Astra Zeneca, Герофарм, MSD, Abbot, Medtronic, Элта
М. А. Балберова
Балберова Мария Александровна, врач-эндокринолог
Москва
Конфликт интересов:
Отсутствие конфликта интересов
Т. И. Сафронова
Россия
Сафронова Татьяна Ильдаровна, врач-эндокринолог
Москва
Конфликт интересов:
Сафронова Татьяна Ильдаровна сотрудничала как лектор с компаниями Boerhinger Ingelheim, Eli Lilly, Novo Nordisk, Sanofi.
О. А. Мишра
Россия
Мишра Ольга Александровна, врач-эндокринолог
Москва
Конфликт интересов:
Отсутствие конфликта интересов
С. Г. Магомедова
Россия
Магомедова Саадат Гаджиевна, врач-эндокринолог
Москва
Конфликт интересов:
Отсутствие конфликта интересов
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(285KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Уровни гликированного гемоглобина и глюкозы плазмы натощак исходно, через 6 и 12 мес терапии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(153KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Количество пациентов с подтвержденными гипогликемиями на протяжении исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(144KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Анциферов М.Б., Демидов Н.А., Балберова М.А., Сафронова Т.И., Мишра О.А., Магомедова С.Г. Эффективность использования фиксированной комбинации инсулина гларгин 100 ЕД/мл и ликсисенатида у пациентов с сахарным диабетом 2 типа в условиях реальной амбулаторной практики: ретроспективное когортное исследование SOLO. Сахарный диабет. 2022;25(2):112-119. https://doi.org/10.14341/DM12809
For citation:
Antsiferov M.B., Demidov N.A., Balberova M.A., Safronova T.I., Mishra O.A., Magomedova S.G. Real World Effectiveness of fixed combination of glargine 100 U/ml and lixisenatide therapy in outpatients with Type 2 Diabetes: A Retrospective Cohort Study SOLO. Diabetes mellitus. 2022;25(2):112-119. (In Russ.) https://doi.org/10.14341/DM12809

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































