Перейти к:
Ретроспективное исследование применения аналогов инсулина продленного действия детемир и деглудек у детей и подростков для преодоления вариабельности гликемии, обусловленной феноменами «утренней и вечерней зари»
https://doi.org/10.14341/DM12431
Аннотация
Обоснование. Детям с сахарным диабетом 1 типа (СД1) требуется больше инсулина в поздние вечерние часы (феномен «вечерней зари» (ФВЗ)), а подросткам — в ранние утренние часы (феномен «утренней зари» (ФУЗ)), что является причиной вариабельности гликемии. Современные аналоги инсулина пролонгированного действия позволяют добиваться удовлетворительного гликемического контроля.
Цель. Изучение особенностей инсулинотерапии у детей и подростков с СД1 с использованием аналогов инсулина детемир и деглудек для преодоления вариабельности гликемии, обусловленной ФУЗ и ФВЗ, в различные возрастные периоды.
Методы. Проанализированы медицинские карты 200 пациентов, госпитализированных в 2013–2019 гг., применявших детемир, средний возраст которых составил 9,0 года (5,4; 13,0), с СД1 средней длительностью 1,3 года (0,5; 3,0); а также медицинские карты 50 пациентов, переведенных на деглудек, в 2018–2019 гг. в среднем возрасте 12,0 года (10,5; 14,5) со средней длительностью СД1 3,0 года (1,5; 6,0). До перевода на деглудек пациенты были на интенсифицированной инсулинотерапии с применением гларгина (22), детемира (26) или на помповой инсулинотерапии (2); у 16 (32%) были клинические проявления ФУЗ, у 5 (10%) — ФВЗ.
Результаты. У 67 из 108 (62%) детей в возрасте 1–9 лет было выявлено перераспределение доз детемира на дневное время; у 58 из 92 (63%) в возрасте 10–17 лет — на ночное. В группе пациентов, переведенных на деглудек, отмечено снижение уровня HbA1с с 8,7% (7,8; 9,9) до 8,0% (7,4; 9,0) (р<0,001); гликемии натощак с 9,8 ммоль/л (7,4; 11,7) до 7,7 ммоль/л (6,4; 8,6) (р<0,001); вариабельности гликемии в течение дня с 35,2% (31,6; 40,9) до 23,5% (19,7; 28,6) (р<0,001); суточной дозы инсулина с 0,98 Ед/кг/сут (0,82; 1,14) до 0,87 Ед/кг/сут (0,75; 1,07) (р=0,002). В подгруппах пациентов с ФУЗ и ФВЗ отмечено снижение гликемии натощак (с 11,5 ммоль/л (9,8; 13,8) до 7,5 ммоль/л (6,6; 9,1; р<0,001) и гликемии в поздние вечерние часы (с 11,0 ммоль/л (10,2; 11,2) до 8,0 ммоль/л (6,7; 9,5; р=0,03) соответственно. Достигнутые показатели гликемического контроля не различались между подгруппами пациентов, исходно использовавших детемир или гларгин.
Заключение. Достижение компенсации углеводного обмена при СД1 может быть затруднено в связи с ФУЗ и ФВЗ. Перевод на деглудек обеспечивал улучшение гликемического контроля и уменьшение вариабельности гликемии, обусловленной ФУЗ и ФВЗ.
Ключевые слова
Для цитирования:
Витебская А.В., Шрёдер Е.В., Попович А.В., Писарева Е.А. Ретроспективное исследование применения аналогов инсулина продленного действия детемир и деглудек у детей и подростков для преодоления вариабельности гликемии, обусловленной феноменами «утренней и вечерней зари». Сахарный диабет. 2021;24(4):315-324. https://doi.org/10.14341/DM12431
For citation:
Vitebskaya A.V., Shreder E.V., Popovich A.V., Pisareva E.A. Retrospective trial of long acting analogues detemir and degludec usage in children and adolescents to overcome glucose variability caused by dawn phenomenon and reverse dawn phenomenon. Diabetes mellitus. 2021;24(4):315-324. (In Russ.) https://doi.org/10.14341/DM12431
Основным критерием компенсации сахарного диабета 1 типа (СД1) традиционно считается показатель гликированного гемоглобина (HbA1c), отражающий средние значения гликемии за предшествующие анализу 3 мес [1]. Однако в последние годы появляется все больше данных, свидетельствующих о важности вариабельности гликемии как одного из показателей компенсации углеводного обмена [1–3].
Для пациентов с СД1 характерна различная потребность в инсулине — относительно небольшая в детском возрасте и достигающая максимума в период полового созревания [1]. Кроме этого, потребность в инсулине значительно колеблется в течение суток, и ее пики фиксируются в различное время днем и ночью, что также зависит от возраста пациента [4, 5]. Пики потребности в инсулине получили название феноменов «утренней зари» (ФУЗ) и «вечерней зари» (ФВЗ) [5–7]. При подборе схем инсулинотерапии для достижения оптимальной компенсации заболевания необходимо учитывать данные феномены [7–9]. Современные аналоги инсулина пролонгированного действия позволяют добиваться удовлетворительного гликемического контроля, обеспечивая снижение вариабельности гликемии [10].
ЦЕЛЬ
Изучение особенностей инсулинотерапии у детей и подростков с СД1 с использованием аналогов инсулина детемир и деглудек для преодоления вариабельности гликемии, обусловленной ФУЗ и ФВЗ, в различные возрастные периоды.
МЕТОДЫ
Дизайн исследования
Обсервационное одноцентровое ретроспективное сплошное неконтролируемое исследование.
Критерии соответствия
Критерии включения
- Истории болезни пациентов (1–18 лет) с СД1 на инсулинотерапии с использованием инсулина продленного действия детемир или переведенных в условиях стационара на инсулин сверхдлительного действия деглудек.
- Наличие данных о схемах и дозах инсулинотерапии на момент поступления в стационар и выписки из стационара.
- В случае перевода в условиях стационара на использование инсулина сверхдлительного действия деглудек — наличие результата исследования HbA1cи не менее 5 суточных профилей гликемии (не менее 9 измерений в сутки) до и аналогичные показатели после перевода на деглудек.
Критерии невключения
Отсутствие данных о дозах инсулина, отсутствие результатов исследования HbA1c, необходимого количества гликемических профилей до и после перевода на деглудек.
Условия проведения
Все данные получены из медицинской документации (медицинских карт) пациентов, находившихся на госпитализации в детском эндокринологическом отделении Университетской детской клинической больницы Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова».
Продолжительность исследования
С августа 2019 г. по февраль 2020 г. проведен ретроспективный анализ данных, полученных из медицинских карт пациентов, применявших детемир, госпитализированных в 2013–2019 гг., и медицинских карт пациентов, переведенных на деглудек в период госпитализации в 2018–2019 гг.
Описание медицинского вмешательства
При изучении медицинских карт пациентов на терапии аналогом инсулина продленного действия детемир анализировались: возраст, пол, длительность заболевания, суммарная суточная доза инсулина, утренняя и вечерняя дозы детемира и время их введения, потребность в дополнительных инъекциях инсулина ультракороткого действия в ранние утренние и поздние вечерние часы.
При изучении медицинских карт пациентов, переведенных на аналог инсулина сверхдлительного действия деглудек, анализировались: возраст, пол, длительность заболевания, причина перевода на деглудек; показатели HbA1c, суммарная суточная доза инсулина, потребность в дополнительном введении инсулина ультракороткого действия в раннее утреннее и позднее вечернее время, 5–10 гликемических профилей с не менее чем 9 значениями гликемии до и после перевода на деглудек.
Основные исходы исследования
- Выявление особенностей потребности в аналоге инсулина продленного действия детемир в разное время суток и схем инсулинотерапии, типичных для ФУЗ и ФВЗ, в зависимости от возраста и длительности СД1.
- Оценка изменения уровня HbA1cи вариабельности гликемии после перевода на аналог инсулина сверхдлительного действия деглудек.
Дополнительные исходы исследования
- Выявление доли пациентов, использующих для преодоления ФУЗ и ФВЗ дополнительные инъекции ультракороткого инсулина на фоне терапии аналогом инсулина продленного действия детемир.
- Выявление доли пациентов, избавившихся от клинических проявлений ФУЗ и ФВЗ после перевода на инсулин сверхдлительного действия деглудек (отсутствие клинически значимого подъема гликемии и потребности в дополнительных инъекциях аналогов инсулина ультракороткого действия).
Анализ в подгруппах
Для выявления особенностей потребности в инсулине пролонгированного действия в разное время суток пациенты, получавшие детемир, были разделены на подгруппы в зависимости от возраста (1–9 лет и 10–17 лет) и количества инъекций детемира в сутки (1 или 2 введения).
Для оценки влияния аналога инсулина деглудек на ФУЗ и ФВЗ были выделены подгруппы пациентов с клиническими проявлениями (значимый подъем гликемии, потребность в дополнительных инъекциях инсулина ультракороткого действия) соответствующих феноменов до перевода на деглудек. Результаты перевода на деглудек анализировались также в подгруппах пациентов, исходно применявших детемир или гларгин.
Методы регистрации исходов
В подгруппах пациентов, применявших детемир, оценивались суточные дозы инсулина; процент пациентов, вводивших большую дозу детемира утром или вечером (больше утром / равная доза утром и вечером / меньше утром); процент пациентов, выполнявших вечернюю инъекцию детемира раньше (18–19 ч) или позже (22–23 ч); процент пациентов, использовавших дополнительные инъекции ультракороткого инсулина в поздние вечерние и ранние утренние часы.
В подгруппах пациентов, переведенных на деглудек, сравнивались до и после перевода на деглудек показатели HbA1c, коэффициенты вариации гликемии (по данным 9-точечных гликемических профилей за 5–10 дней), суточная доза инсулина, показатели средней гликемии натощак и перед сном.
Этическая экспертиза
Протокол исследования был одобрен Локальным этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России 17.07.2019 (протокол №10-19).
Статистический анализ
Принципы расчета размера выборки: размер выборки предварительно не рассчитывался.
Методы статистического анализа данных. Статистическая обработка данных проведена в программе RStudio (Version 1.1.463 — © 2009–2018 RStudio, Inc.) с использованием пакета R версии 3.5.3. Номинальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона. Нормальность распределения оценивали по тесту Шапиро–Уилка, гомогенность дисперсии — по тесту Бартлетта. Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение групп проводили с использованием U-критерия Манна–Уитни. Для проверки различий между двумя сравниваемыми парными выборками применялся W-критерий Уилкоксона. С целью изучения связи между явлениями, представленными количественными данными, распределение которых отличалось от нормального, использовался расчет коэффициента ранговой корреляции Спирмена. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Пациенты, применявшие детемир
Проанализированы медицинские карты 200 стационарных пациентов (94 мальчика, 106 девочек), госпитализированных в детское эндокринологическое отделение в период 2013–2019 гг. в возрасте от 1,0 до 17,5 года (Ме 9,0 (5,4; 13,0)) с длительностью СД1 от 0 до 11,5 года (Ме 1,3 (0,5; 3,0)). Все пациенты были на интенсифицированной инсулинотерапии в суточной дозе от 0,07 до 1,62 Ед/кг/сут (Ме 0,77 (0,53; 0,93)), детемир составлял от 10 до 86% (Ме 49 (38; 56)) от суточной дозы инсулина.
Пациенты, переведенные на деглудек
Проанализированы медицинские карты 50 пациентов (16 мальчиков, 34 девочки), переведенных на терапию аналогом инсулина сверхдлительного действия деглудек, в период нахождения в детском эндокринологическом отделении в 2018–2019 гг. в возрасте от 5,0 до 17,9 года (Ме 12,0 (10,5; 14,5)) с СД1 длительностью от 0,5 до 13,0 года (Ме 3,0 (1,5; 6,0)). До перевода на деглудек все пациенты находились на интенсифицированной инсулинотерапии с применением аналогов инсулина пролонгированного действия гларгин (22 пациента), детемир (26 детей) или на помповой инсулинотерапии (2 пациента). В качестве показаний для перевода на деглудек указывались ФУЗ, ФВЗ, вариабельность гликемии в течение дня, желание отказаться от помповой инсулинотерапии.
До перевода на деглудек у 16 пациентов (32%) были выраженные клинические проявления ФУЗ (нуждались в дополнительных инъекциях инсулина ультракороткого действия в ранее утреннее время), у 5 (10%) — ФВЗ (ежедневные подъемы гликемии в вечернее время выше 10 ммоль/л без предшествующей гипогликемии).
Основные результаты исследования
Пациенты, применявшие детемир
Суточная доза инсулина зависела от возраста пациента (r=0,319; p<0,0001) и длительности заболевания (r=0,529; p<0,0001). У большинства пациентов (172 (86%)) детемир вводился в 2 инъекции утром и вечером; у 19 (9,5%) — только утром, 9 (4,5%) — только вечером.
Пациенты, не нуждавшиеся во второй инъекции инсулина, были преимущественно допубертатного возраста, имели небольшую длительность заболевания и низкую потребность в инсулине. Чаще использовалось только утреннее введение инсулина по сравнению с только вечерним (табл. 1).
При изучении данных пациентов, выполнявших инъекции детемира 2 раза в сутки, корреляционный анализ не выявил статистически значимой связи между перераспределением дозы детемира на утро/вечер и возрастом или длительностью заболевания. Обращало на себя внимание большее число детей до 9 лет с преимущественным перераспределением дозы детемира на утро и, наоборот, с 10 лет и старше — на вечер; данное перераспределение также не было статистически значимым (табл. 2).
Таблица 1. Характеристики пациентов на инсулинотерапии, включающей введение детемира один раз в день
Группа детей | Количество (мальчики/ девочки) | Возраст, годы | Длительность СД1, годы | Суточная доза инсулина, Ед/кг/сут | Вводят детемир, число человек | |
только утром | только вечером | |||||
От 1 до 9 лет | 22 (11/11) | 5,0 (3,3; 6,0) | 0,5 (0,5; 1,0) | 0,37 (0,27; 0,46) | 15 | 7 |
От 10 до 18 лет | 6 (4/2) | 13,0 (11,5; 13,0) | 0,5 (0,5; 0,5) | 0,34 (0,13; 0,43) | 4 | 2 |
Таблица 2. Характеристики пациентов на инсулинотерапии, включающей введение детемира два раза в день
Группа детей | Количество (мальчики/ девочки) | Возраст, годы | Длительность СД1, годы | Суточная доза инсулина, Ед/кг/сут | Распределение дозы детемира, число пациентов | Смещено время введения вечерней дозы детемира, число пациентов | Дополнительно вводят ультракороткий инсулин, число пациентов | ||||
Утром больше, чем вечером | Равные дозы утром и вечером | Вечером больше, | Раннее, в 18–19 ч | Позднее, | Перед сном, | В раннее утреннее время, 5–6 ч | |||||
От 1 до 9 лет | 86 (40/46) | 6,0 (4,0; 8,0) | 1,0 (0,5; 2,5) | 0,75 (0,56; 0,90) | 38 (44%) | 26 (30%) | 22 (26%) | 21 (24%) | - | 3 (3%) | - |
От 10 до 18 лет | 86 (39/47) | 14,0 (11,1; 15,0) | 2,5 (1,0; 6,0) | 0,89 (0,72; 1,09) | 28 (33%) | 26 (30%) | 32 (37%) | - | 42 (51%) | - | 12 (14%) |
Раннее введение вечерней дозы детемира (перед ужином или в 18–19 ч) применялось у 21 ребенка от 1,0 до 9,7 года (Me 7,0 (3,3; 8,0)); у 14 из них утренняя доза детемира не превышала вечернюю.
Позднее введение вечерней дозы детемира (22–23 ч) применялось у 42 пациентов от 10,0 до 17,5 года (Ме 14,0 (11,9; 15,0)), у 24 из них вечерняя доза не превышала утреннюю.
Таким образом, в возрасте 1–9 лет у большинства пациентов (67 из 108 (62%)) выявлено перераспределение доз инсулина пролонгированного действия на дневное время, а в возрасте 10–17 лет — на ночное (58 из 92 (63%)).
Пациенты, переведенные на деглудек
В группе пациентов, переведенных на деглудек, отмечено статистически значимое снижение среднего уровня HbA1с с 8,7% (7,8; 9,9) до 8,0% (7,4; 9,0) (р<0,001) (рис. 1).
Перевод на деглудек обеспечил статистически значимое снижение средних показателей уровня гликемии натощак с 9,8 ммоль/л (7,4; 11,7) до 7,7 ммоль/л (6,4; 8,6) (р<0,001) (рис. 2) и вариабельности гликемии в течение дня — коэффициент вариации после перевода составил в среднем 23,5% (19,7; 28,6) по сравнению с 35,2% (31,6; 40,9) до перевода (р<0,001) (рис. 3).
После перевода на деглудек отмечено также снижение средней суточной дозы инсулина с 0,98 Ед/кг/сут (0,82; 1,14) до 0,87 (0,75; 1,07) Ед/кг/сут (р=0,002).
Дополнительные результаты исследования
Пациенты, применявшие детемир
Среди пациентов, применявших детемир, помимо переноса времени введения инсулина длительного действия, 3 пациента (1 мальчик, 2 девочки) в возрасте 3, 5 и 8 лет использовали дополнительные инъекции ультракороткого инсулина в вечернее время (21–22 ч); 12 пациентов (5 мальчиков, 7 девочек) в возрасте от 11 до 17 лет (Ме 14,3 года (13,8; 15,3) выполняли дополнительные инъекции в ранние утренние часы (5–6 ч).
Пациенты, переведенные на деглудек
Все 16 пациентов, ранее нуждавшиеся в дополнительных инъекциях инсулина ультракороткого действия в ранние утренние часы, избавились от такой необходимости. В данной подгруппе выявлено статистически значимое снижение среднего уровня гликемии натощак с 11,5 ммоль/л (9,8; 13,8) до 7,5 ммоль/л (6,6; 9,1) (р<0,001) (рис. 4).
У 5 пациентов, ежедневно фиксировавших подъем гликемии выше 10 ммоль/л перед сном, отмечено статистически значимое снижение среднего уровня гликемии в поздние вечерние часы с 11,0 ммоль/л (10,2; 11,2) до 8,0 ммоль/л (6,7; 9,5) (р=0,03) (рис. 5).
Между группами пациентов, исходно применявших детемир и гларгин, после перевода на деглудек не было выявлено статистически значимых различий результатов HbA1c (8,0% (7,3; 8,7) и 8,2% (7,5; 9,4) соответственно), гликемии натощак (7,1 ммоль/л (6,4; 8,2) и 8,0 ммоль/л (6,8; 8,6)) и вариабельности гликемии в течение дня (22,0% (17,4; 24,5) и 21,3% (18,1; 25,6)).
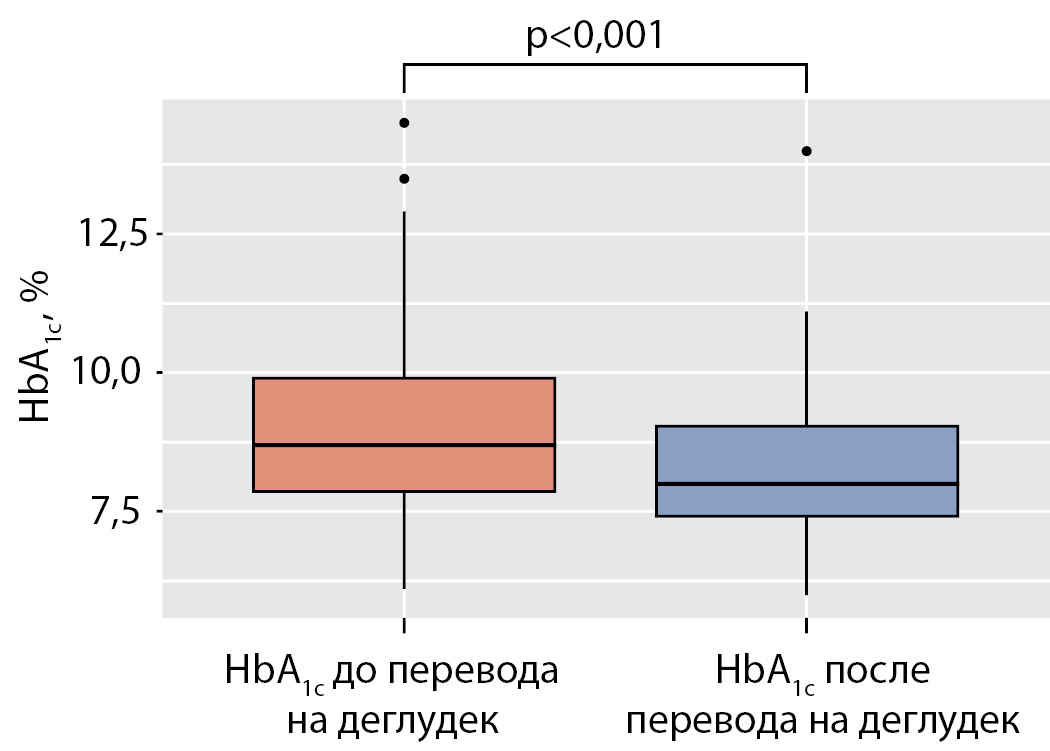
Рисунок 1. Уровень гликированного гемоглобина до и после перевода на деглудек.
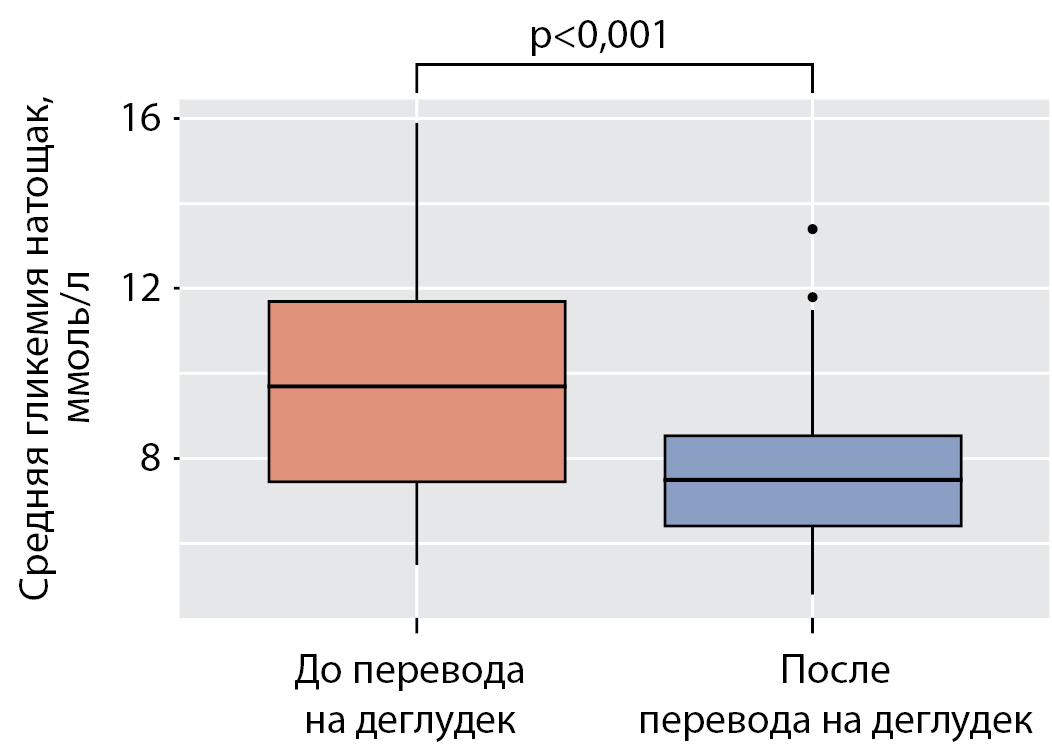
Рисунок 2. Гликемия натощак до и после перевода на деглудек.
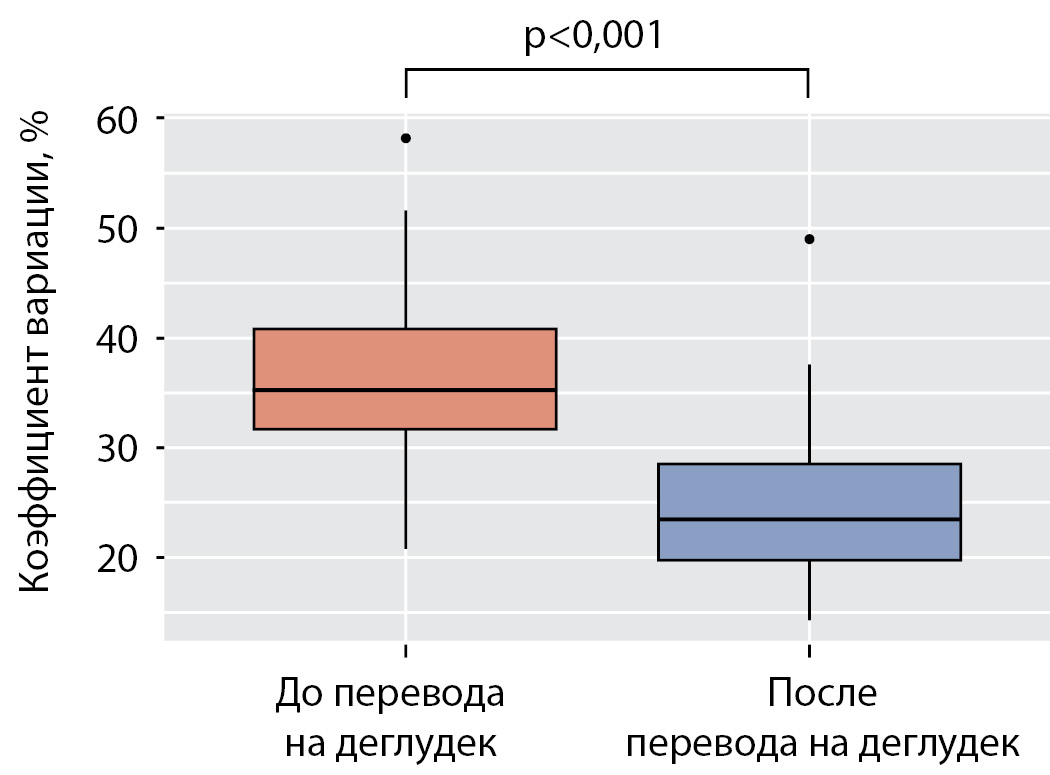
Рисунок 3. Вариабельность гликемии до и после перевода на деглудек.
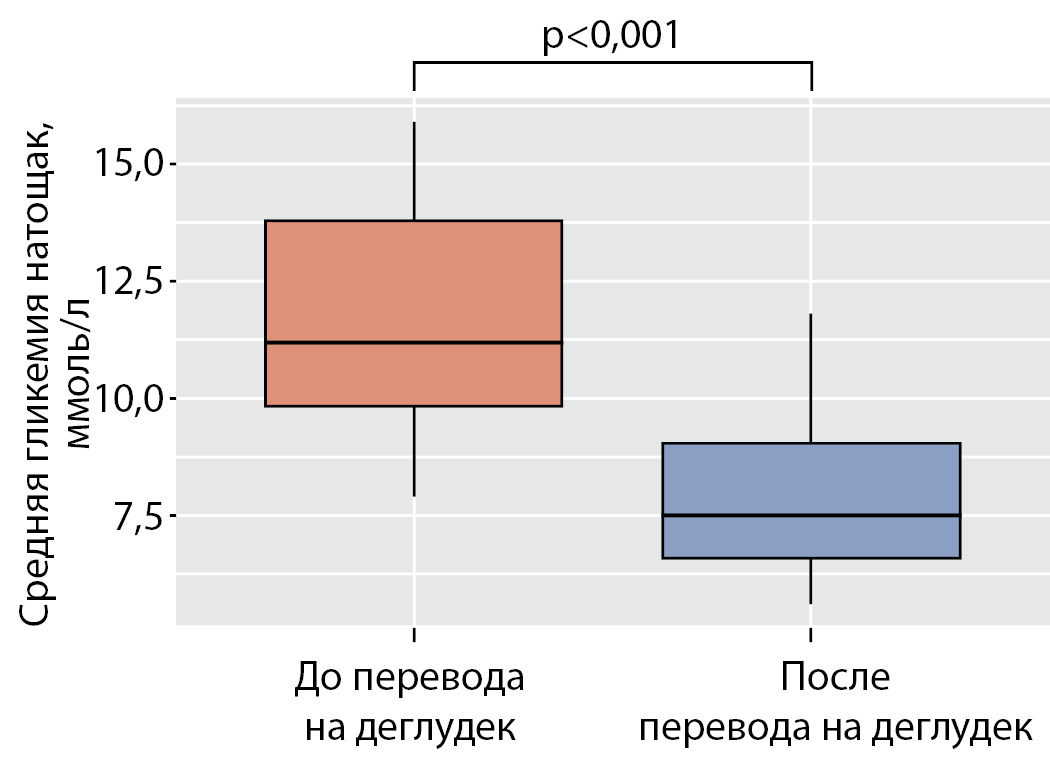
Рисунок 4. Средняя гликемия натощак в подгруппе пациентов с феноменом «утренней зари» до и после перевода на деглудек.
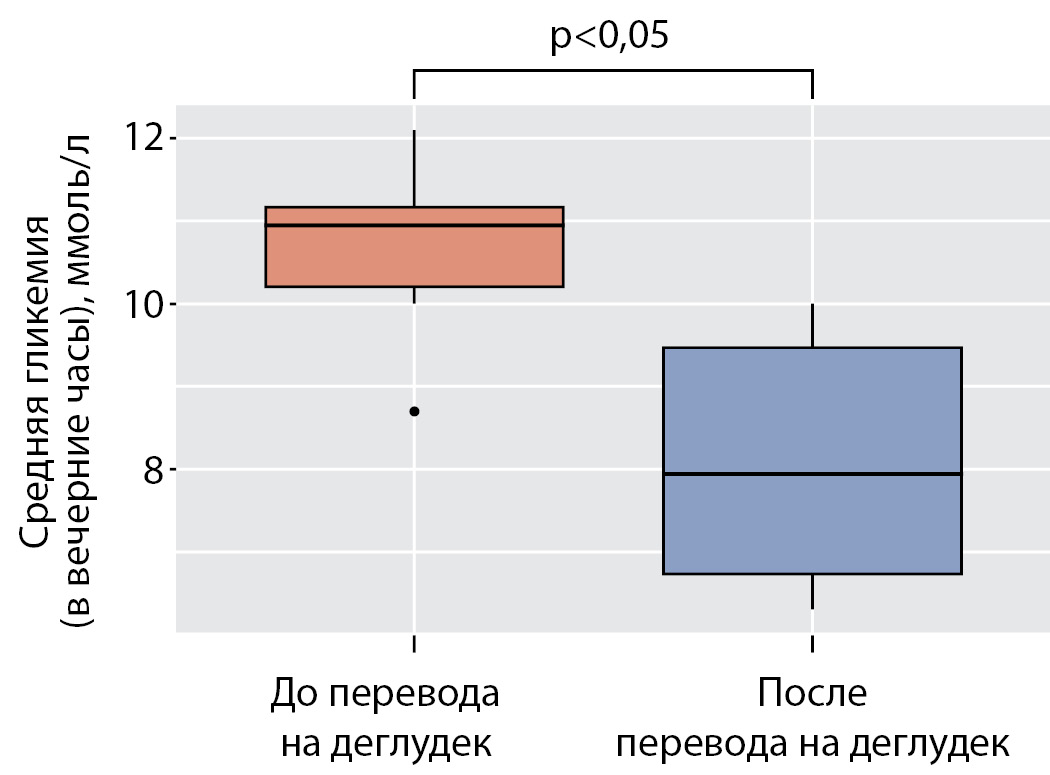
Рисунок 5. Средняя гликемия в вечерние часы в подгруппе пациентов с феноменом «вечерней зари» до и после перевода на деглудек.
НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ
Ретроспективный анализ данных медицинских карт не выявил нежелательных явлений.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У 62% детей младше 10 лет выявлены особенности инсулинотерапии, свидетельствующие о наличии ФВЗ, а у 63% детей и подростков 10 лет и старше — ФУЗ. Кроме изменения доз и времени введения инсулина пролонгированного действия детемир, 3 из 67 (4%) пациентов с ФВЗ и 12 из 58 (21%) пациентов с ФУЗ нуждались в дополнительном введении инсулина ультракороткого действия в вечерние и ранние утренние часы соответственно.
Перевод на инсулин сверхдлительного действия деглудек обеспечивал улучшение гликемического контроля — снижение уровня HbA1c и гликемии натощак, уменьшение вариабельности гликемии, преодоление гипергликемии, обусловленной ФУЗ и ФВЗ, независимо от предшествующей терапии.
Обсуждение основного результата исследования
Для детей и подростков с СД1 характерна различная потребность в инсулине. В первые месяцы после манифестации СД1 она минимальна, а через 1–2 года от начала заболевания достигает стандартных для возраста ребенка или подростка значений. В детском возрасте она составляет 0,7–1,0 Ед/кг/сут, а в период полового созревания может возрастать до 1,2–2,0 Ед/кг/сут [1]. В нашем исследовании потребность в инсулине зависела от возраста и длительности СД1 и в целом соответствовала стандартным значениям.
Потребность в инсулине, имитирующем фоновую секрецию, обычно составляет около 50% [1]. Известно, что при использовании инсулиновой помпы базальная скорость введения инсулина значительно варьирует в течение суток. Для пациентов разного возраста характерны различные временные интервалы, когда потребность в инсулине максимальна или минимальна. Наличие подобных «пиков» и «провалов» приводит к выраженным колебаниям гликемии и попыткам коррекции инсулинотерапии с перераспределением доз инсулина [4][5].
Термин ФУЗ был впервые предложен в 1981 г. для описания утренней гипергликемии натощак [11]. Позднее определение было уточнено: «гипергликемия или повышенная потребность в инсулине для поддержания нормогликемии в утренние часы, развившиеся без предшествующей гипогликемии или передозировки инсулина» [12]. ФУЗ наиболее выражен у подростков, а аналогичный феномен, наблюдаемый в вечернее время у детей младшего возраста, получил название «реверсивного» ФУЗ, или ФВЗ [5].
При изучении данных феноменов выяснилось, что у детей младшего возраста с ФВЗ наибольшая потребность в инсулине отмечается перед полночью [5][13–15], а наименьшая — ночью и в ранние утренние часы [5][13][16]. Для ФУЗ у подростков характерна высокая потребность в инсулине во второй половине ночи и в ранние утренние часы [4][5][13]. У взрослых также выявляется ФУЗ, но менее выраженный по сравнению с подростками [12][17][18]. После того как в качестве критериев ФУЗ у взрослых были предложены «повышение гликемии более чем на 10 мг/дл или увеличение дозы инсулина более чем на 20%», данный феномен был выявлен у 54% взрослых пациентов с СД1 [12].
В патогенезе ФУЗ и ФВЗ важную роль играет секреция контринсулярных гормонов. Было продемонстрировано, что ФУЗ обусловлен эндогенным глюконеогенезом, ассоциированным с ранним утренним пиком концентрации кортизола; также наблюдается постепенное, на протяжении всей ночи, увеличение концентраций дофамина, адреналина и норадреналина [17]. Наряду с глюконеогенезом активную роль играет гликогенолиз. Роль глюкагона в утренней гипергликемии была продемонстрирована при сравнении базальных доз инсулина при СД1 и при диабете, развившемся после панкреатэктомии. В отсутствие глюкагона потребность в инсулине значительно меньше, и увеличения потребности в ранние утренние часы не наблюдается [18]. Предполагается, что в патогенезе ФВЗ ведущую роль играет активная секреция гормона роста [5].
Согласно Консенсусу Международной организации по детскому и подростковому диабету (International Society for Pediatric and Adolescent diabetes (ISPAD)), для преодоления ФВЗ у детей дошкольного возраста следует применять индивидуальные схемы инсулинотерапии аналогами инсулина пролонгированного действия с особенным суточным режимом введения инсулина, учитывающим низкую потребность в инсулине, склонность к гипогликемиям в ночное время в период с 3 до 6 ч и высокую потребность в инсулине в поздние вечерние часы с 21 до 24 ч [8]. Среди пациентов младшего возраста, применяющих детемир, в нашем исследовании отмечена соответствующая данным рекомендациям тенденция к снижению потребности в базальном инсулине в ночное время, что выражалось как в отсутствии второй инъекции перед сном у части пациентов с небольшой длительностью заболевания, так и в более частом, по сравнению с подростками, перераспределении дозы инсулина длительного действия на утро. Еще один пример адаптации схемы инсулинотерапии под потребности в базальном инсулине при ФВЗ — перенос вечерней инъекции детемира на более раннее время.
Консенсус ISPAD для преодоления ФУЗ рекомендует также применять аналоги инсулина продленного действия, индивидуально изменять режим инсулинотерапии, используя позднее введение инсулина продленного действия [7]. Среди пациентов старше 10 лет, применявших детемир, в противоположность детям младшей группы отмечена тенденция к перераспределению доз базального инсулина на ночное время — вечерняя доза детемира чаще была больше утренней и/или вечерняя инъекция выполнялась в более позднее время, чтобы сместить период максимальной активности инсулина пролонгированного действия на середину и вторую половину ночи.
Интересно отметить, что в нашем исследовании схемы инсулинотерапии, косвенно свидетельствующие о наличии ФВЗ, в возрасте младше 10 лет встречались с такой же частотой, как схемы, типичные для ФУЗ, в группе 10 лет и старше.
ФУЗ и ФВЗ затрудняют достижение целевых значений гликемии у пациентов с СД1. В частности, в исследовании, изучавшем титрацию доз гларгина, целевые показатели легко достигались лишь в период с 14 до 4 ч, подбор доз был ограничен риском гипогликемий в дневной и ранний ночной период, а в утренние часы отмечалась тенденция к повышенным значениям, что могло требовать увеличения дозы инсулина короткого действия перед завтраком либо дополнительных инъекций [19].
Применение детемира пациентами, включенными в наше исследование, позволяло независимо изменять утреннюю и вечернюю дозы, а также использовать смещение времени инъекции в соответствии с потребностью в инсулине. Преимущества детемира в уменьшении вариабельности гликемии при ФУЗ и ФВЗ изучены недостаточно. Клинические исследования, сравнивавшие эффективность детемира и гларгина в достижении целевых значений гликемии в течение суток, не фокусировались на данных возрастных группах и имеют противоречивые результаты. В одном из исследований при переводе с гларгина на детемир взрослых с СД1 и СД2 были выявлены преимущества детемира в виде уменьшения числа гипогликемий [20], в другом исследовании в период пребывания в стационаре у аналогичной группы пациентов, применявших детемир, наоборот, отмечалась большая частота гипогликемий, чем на гларгине [21]. В двух ретроспективных и двух проспективных исследованиях взрослых, использовавших детемир и гларгин, различий не было выявлено [22–25].
Несмотря на применение схем введения инсулина, адаптированных с учетом ФУЗ и ФВЗ, достичь целевых значений гликемии удается не всегда [19]. В нашем исследовании дополнительные инъекции инсулина ультракороткого действия требовались 3 (4%) пациентам из 67 с ФВЗ и 12 (21%) из 58 с ФУЗ.
Потребность в нормализации гликемии в ночное время и высокие значения гликемии утром натощак — частые показания для перевода пациентов на деглудек [10]. Деглудек — аналог инсулина с длительностью действия более 42 ч, продемонстрировавший в клинических исследованиях с участием взрослых и детей с СД1 гликемический контроль, сравнимый с инсулинами детемир и гларгин, при меньшем количестве гипогликемий (в большинстве исследований — ночных гипогликемий) и более низком уровне гликемии натощак [26–30].
Увеличенная по сравнению с другими аналогами инсулина длительность действия и минимальный пик активности позволили добиться уменьшения вариабельности гликемии при применении деглудека [31]. С учетом уникальных фармакокинетических характеристик в качестве показаний для перевода детей и подростков на деглудек рекомендовано рассматривать необходимость уменьшения частоты гипогликемий или снижения целевых значений гликемии с меньшим риском гипогликемий, потребности в стабилизации гликемии в ночное время, повышения приверженности к терапии (при недостаточно гибкой предыдущей схеме инсулинотерапии), уменьшения числа инъекций, а также наличие аллергических реакций на другой аналог инсулина пролонгированного действия [10][32].
В нашем исследовании анализировались результаты перевода на деглудек пациентов, ранее применявших гларгин, детемир и помповую инсулинотерапию. С учетом исходных неудовлетворительных показателей HbA1c, гликемии натощак и вариабельности гликемии, а также доли пациентов с клиническими проявлениями ФУЗ и ФВЗ, наиболее актуальными целями перевода на деглудек были снижение целевых значений, стабилизация гликемии в ночное время и уменьшение числа инъекций (в частности, дополнительных инъекций инсулина ультракороткого действия).
Улучшение гликемического контроля было подтверждено результатами исследования HbA1c и вариабельности гликемии. Для оценки вариабельности гликемии могут быть использованы стандартное отклонение (standard deviation — SD), коэффициент вариации (coefficient of variation — CV), средняя амплитуда колебаний гликемии (mean amplitude of glycemic excursions — MAGE), площадь под кривой (area under the curve — AUC), индекс непрерывного частично перекрывающегося изменения гликемии (continuous overlapping net glycemic action — CONGA) и др. Часть этих показателей применяется для оценки вариабельности по результатам самоконтроля, другие — по данным непрерывного мониторинга гликемии. Возможна оценка вариабельности как в течение дня (within-day) по 9-точечным гликемическим профилям, так и «изо дня в день» (day-to-day) — по значениям, измеренным в одно и то же время в разные дни [2].
Коэффициент вариации, применявшийся в нашем исследовании, признан золотым стандартом для оценки вариабельности гликемии по данным самоконтроля, осуществляемого пациентами [2]. Девятиточечные суточные профили гликемии позволили оценить вариабельность гликемии в течение дня — показатель, который значимо коррелирует с общим риском гипогликемии и риском ночной гипогликемии [3].
Первоначально средний показатель вариабельности был пограничным (нестабильной считается гликемия при коэффициенте вариации 36% и выше) [28]. После перевода на деглудек отмечено значительное уменьшение вариабельности гликемии.
В свете настоящего исследования необходимо особенно подчеркнуть уменьшение проявлений ФУЗ и ФВЗ. Всем пациентам, чьи данные были доступны для ретроспективного анализа, удалось избавиться от проявлений этих феноменов. Из опубликованных ранее работ известно, что перевод на деглудек приводит к значительному снижению гликемии натощак [29][30]. Однако влияние на проявления ФУЗ у подростков, в частности потребность в дополнительных инъекциях инсулина в раннее утреннее время, а также на проявления ФВЗ у детей младшего возраста в них прицельно не изучались.
Известно, что применение инсулина деглудек у детей, аналогично взрослым, обеспечивает хороший гликемический контроль с уменьшением числа не только ночных гипогликемий, но и гипергликемий с кетозом. В то же время отмечена большая частота тяжелых гипогликемий [29][30][33]. Полученные нами результаты продемонстрировали значительное улучшение показателей гликемического контроля, в том числе снижение гликемии натощак, отмеченное в других исследованиях. Ретроспективный анализ данных, зафиксированных в медицинских картах, не выявил нежелательных явлений.
Согласно литературным источникам, перевод на инсулинотерапию с применением деглудека улучшает гликемический контроль и снижает риск гипогликемий у взрослых независимо от использовавшегося до этого аналога инсулина пролонгированного действия [32]. В нашем исследовании также не выявлено связи улучшения гликемического контроля с предшествовавшим инсулином.
При переводе детей на деглудек отмечено значительное уменьшение потребности в базальном инсулине, также продемонстрированное ранее другими авторами [30]. Этот факт, наряду со снижением частоты эпизодов гипергликемий с кетозом, свидетельствует об экономической эффективности применения деглудека [34].
Ограничения исследования
Несмотря на достаточно большую выборку медицинских карт пациентов, необходимо отметить существенные ограничения проведенного ретроспективного исследования.
Схемы инсулинотерапии анализировались только у детей и подростков, применяющих детемир. С одной стороны, это позволило выявить большее число пациентов, стремящихся к адаптации инсулинотерапии под потребности. С другой стороны, исключение из анализа пациентов, применяющих гларгин, могло уменьшить долю детей и подростков, не испытывающих проявлений ФУЗ и ФВЗ.
Для выявления пациентов с ФУЗ и ФВЗ мы рассматривали только особенности перераспределения доз базального инсулина и не анализировали гликемические профили, что могло существенно уменьшить процент пациентов с данными феноменами. Это демонстрирует актуальность проблемы, позволяет нам говорить о том, что данные феномены влияют на подбор инсулинотерапии более чем у половины пациентов соответствующего возраста, но не использовать полученный процент пациентов в качестве показателей распространенности ФУЗ и ФВЗ.
Использование для анализа данных детей и подростков, полученных в период нахождения в стационаре, может влиять на структуру участников исследования, увеличивая долю декомпенсированных пациентов с более выраженной вариабельностью гликемии. Невключение в исследование пациентов, переведенных на деглудек, у которых не были доступны результаты повторного исследования HbA1c и гликемических профилей, а также небольшой размер выборки пациентов, переведенных на деглудек, и ретроспективный характер исследования не позволяют с уверенностью говорить об отсутствии нежелательных явлений, выявленных в других исследованиях с участием детей [30].
ЗАКЛЮЧЕНИЕ
Достижение компенсации углеводного обмена при СД1 у детей и подростков может быть затруднено в связи с выраженной вариабельностью гликемии вследствие ФВЗ у детей младшего возраста и ФУЗ у подростков. Выявленные у большинства детей и подростков особенности инсулинотерапии, типичные для данных феноменов, свидетельствуют об актуальности изучения данной проблемы.
Перевод детей и подростков на инсулин сверхдлительного действия деглудек обеспечивал улучшение гликемического контроля и уменьшение вариабельности гликемии, обусловленной ФУЗ и ФВЗ. После перевода детей и подростков на деглудек впервые продемонстрированы не только снижение уровня HbA1c и гликемии натощак, свидетельствующее об уменьшении клинических проявлений ФУЗ, но и уменьшение вариабельности гликемии в течение дня и снижение средней гликемии в поздние вечерние часы у пациентов с ФВЗ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена за счет бюджетных средств учреждений.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Витебская А.В. — концепция и дизайн исследования, сбор и анализ полученных материалов, написание текста; Шрёдер Е.В. — сбор и анализ материалов; Попович А.В., Писарева Е.А. — сбор материалов. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
Список литературы
1. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С.1-144. [Dedov II, Shestakova MV, Mayorov AYu, et al. Standards of specialized diabetes care. Diabetes Mellitus. 2019;22(S1):1-144 (In Russ.)]. doi: https://doi.org/10.14341/DM221S1
2. Анциферов М.Б., Галстян Г.Р., Зилов А.В., и др. Резолюция по итогам первой рабочей встречи Научно-консультативного совета по вопросу «Актуальные проблемы вариабельности гликемии как нового критерия гликемического контроля и безопасности терапии сахарного диабета» // Сахарный диабет. — 2019. — Т. 22. — №3. — С. 281-288. [Antsiferov MB, Galstyan GR, Zilov AV, et al. Resolution on the results of the first working meeting of the Scientific Advisory Board «Actual problems of glycemic variability as a new criterion of glycemic control and safety of diabetes therapy». Diabetes Mellitus. 2019;22(3):281-288 (In Russ.)]. doi: https://doi.org/10.14341/DM10227
3. Bailey T, Bhargava A, Devries JH, et al. Within-day Variability Based on 9-point Profiles Associates with Overall and Nocturnal Hypoglycemia Risk in Adults with Type 1 (T1D) or Type 2 Diabetes (T2D). Can J Diabetes. 2017;41(5):S7. doi: https://doi.org/10.1016/j.jcjd.2017.08.022
4. Scheiner G, Boyer BA. Characteristics of basal insulin requirements by age and gender in Type-1 diabetes patients using insulin pump therapy. Diabetes Research and Clinical Practice. 2005;69(1);14-21. doi: https://doi.org/10.1016/j.diabres.2004.11.005
5. Nicolajsen T, Samuelsson A, Hanas R. Insulin Doses before and One Year after Pump Start: Children Have a Reversed Dawn Phenomenon. J Diabetes Sci Technol. 2012;6(3):589-594. doi: https://doi.org/10.1177/193229681200600314
6. Danne T, Bangstad H-J, Deeb L, et al. Insulin treatment in children and adolescents with diabetes. Pediatr Diabetes. 2014;15(S20):115-134. doi: https://doi.org/10.1111/pedi.12184
7. Danne T, Phillip M, Buckingham BA, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Insulin treatment in children and adolescents with diabetes. Pediatr Diabetes. 2018;19:115-135. doi: https://doi.org/10.1111/pedi.12718
8. Sundberg F, Barnard K, Cato A, et al. Managing diabetes in preschool children. Pediatr Diabetes. 2017;18(7):499-517. doi: https://doi.org/10.1111/pedi.12554
9. Cameron FJ, Garvey K, Hood KK, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Diabetes in adolescence. Pediatr Diabetes. 2018;19:250-261. doi: https://doi.org/10.1111/pedi.12702
10. Goldman J, Kapitza C, Pettus J, Heise T. Understanding how pharmacokinetic and pharmacodynamic differences of basal analog insulins influence clinical practice. Curr Med Res Opin. 2017;33(10):1821-1831. doi: https://doi.org/10.1080/03007995.2017.1335192
11. Schmidt MI, Hadji-Georgopoulos A, Rendell M, et al. The Dawn Phenomenon, an Early Morning Glucose Rise: Implications for Diabetic Intraday Blood Glucose Variation. Diabetes Care. 1981;4(6):579-585. doi: https://doi.org/10.2337/diacare.4.6.579
12. Carroll MF, Schade DS. The dawn phenomenon revisited: implications for diabetes therapy. Endocrine Practice. 2005;11(1):55-64, doi: https://doi.org/10.4158/EP.11.1.55
13. Holterhus PM, Bokelmann J, Riepe F, et al. German/Austrian DPV-Initiative and the German Pediatric CSII Working Group. Predicting the optimal basal insulin infusion pattern in children and adolescents on insulin pumps. Diabetes Care. 2013;36(6):1507-1511. doi: https://doi.org/10.2337/dc12-1705
14. Danne T, Battelino T, Kordonouri O, et al. A cross-sectional international survey of continuous subcutaneous insulin infusion in 377 children and adolescents with type 1 diabetes mellitus from 10 countries. Pediatr Diabetes. 2005;6(4):193-198. doi: https://doi.org/10.1111/j.1399-543X.2005.00131.x
15. Conrad SC, McGrath MT, Gitelman SE. Transition from multiple daily injections to continuous subcutaneous insulin infusion in type 1 diabetes mellitus. J Pediatr. 2002;140(2):235-240. doi: https://doi.org/10.1067/mpd.2002.120509
16. DiMeglio LA, Boyd SR, Pottorff TM, et al. Preschoolers Are Not Miniature Adolescents: A Comparison of Insulin Pump Doses in Two Groups of Children with Type 1 Diabetes Mellitus. J Pediatr Endocrinol Metab. 2004;17(6):865-870. doi: https://doi.org/10.1515/JPEM.2004.17.6.865
17. Mallad A, Hinshaw L, Dalla Man C, et al. Nocturnal Glucose Metabolism in Type 1 Diabetes: A Study Comparing Single Versus Dual Tracer Approaches. Diabetes Technol Ther. 2015;17(8):587-595. doi: https://doi.org/10.1089/dia.2015.0011
18. Niwano F, Hiromine Y, Noso S, et al. Insulin deficiency with and without glucagon: A comparative study between total pancreatectomy and type 1 diabetes. J Diabetes Investig. 2018;9(5):1084-1090. doi: https://doi.org/10.1111/jdi.12799
19. King AB, Clark D, Wolfe GS. Contribution of the dawn phenomenon to the fasting and postbreakfast hyperglycemia in type 1 diabetes treated with once-nightly insulin glargine. Endocr Pract. 2012;18(4):558-562. doi: https://doi.org/10.4158/EP12042.OR
20. Yenigun M, Honka M. Switching patients from insulin glargine-based basal-bolus regimens to a once daily insulin detemir-based basal-bolus regimen: results from a subgroup of the PREDICTIVE study. Int J Clin Pract. 2009;63:425-432. doi: https://doi.org/10.1111/j.1742-1241.2008.01973.x
21. Galindo RJ, Davis GM, Fayfman M, et al. Comparison of efficacy and safety of glargine and detemir insulin in the management of inpatient hyperglycemia and diabetes. Endocr Pract. 2017;23:1059-1066. doi: https://doi.org/10.4158/EP171804.OR
22. Crisher MA, Giuliano CA, Hartner CL. Insulin Detemir Versus Insulin Glargine in the Hospital: Do Hypoglycemia Rates Differ? Clin Diabetes. 2019;37(2):167-171. doi: https://doi.org/10.2337/cd18-0065
23. Capson J, Cade K, Avanesyan A. Detemir vs Glargine: Comparison of Inpatient Glycemic Control. J Am Osteopath Assoc. 2019;119(2):89-95. doi: https://doi.org/10.7556/jaoa.2019.014
24. Pieber TR, Treichel HC, Hompesch B, et al. Comparison of insulin detemir and insulin glargine in subjects with Type 1 diabetes using intensive insulin therapy. Diabet Med. 2007;24(6):635-642. doi: https://doi.org/10.1111/j.1464-5491.2007.02113.x
25. Heller S, Koenen C, Bode B. Comparison of insulin detemir and insulin glargine in a basal—bolus regimen, with insulin aspart as the mealtime insulin, in patients with type 1 diabetes: A 52-week, multinational, randomized, open-label, parallel-group, Treat-to-Target noninferiority tr. Clin Ther. 2009;31(10):2086-2097. doi: https://doi.org/10.1016/j.clinthera.2009.10.006
26. Davies M, Sasaki T, Gross JL, et al. Comparison of insulin degludec with insulin detemir in type 1 diabetes: a 1-year treat-to-target trial. Diabetes Obes Metab. 2016;18:96-99. doi: https://doi.org/10.1111/dom.12573
27. Wang F, Surh J, Kaur M. Insulin degludec as an ultralong-acting basal insulin once a day: a systematic review. Diabetes Metab Syndr Obes. 2012;5:191-204. doi: https://doi.org/10.2147/DMSO.S21979
28. Monnier L, Colette C, Wojtusciszyn A, et al. Toward Defining the Threshold Between Low and High Glucose Variability in Diabetes. Diabetes Care. 2017;40(7):832-838. doi: https://doi.org/10.2337/dc16-1769
29. Thalange N, Deeb L, Klingensmith G, et al. The rate of hyperglycemia and ketosis with insulin degludec-based treatment compared with insulin detemir in pediatric patients with type 1 diabetes: an analysis of data from two randomized trials. Pediatr Diabetes. 2019;20:314-320. doi: https://doi.org/10.1111/pedi.12821
30. Thalange N, Deeb L, Iotova V, et al. Insulin degludec in combination with bolus insulin aspart is safe and effective in children and adolescents with type 1 diabetes. Pediatric Diabetes. 2015;16:164-176. doi: https://doi.org/10.1111/pedi.12263
31. Knudsen ST, Lapolla A, Schultes B, et al. Clinical benefits of switching to insulin degludec irrespective of previous basal insulin therapy in people with Type 1 or Type 2 diabetes: evidence from a European, multicentre, retrospective, non-interventional study (EUTREAT). Diabet Med. 2019;36(7):868-877. doi: https://doi.org/10.1111/dme.13976
32. Heise T, Hermanski L, Nosek L, et al. Insulin degludec: four times lower pharmacodynamic variability than insulin glargine under steady-state conditions in type 1 diabetes. Diabetes Obes Metab. 2012;14(9):859-864 2012. doi: https://doi.org/10.1111/j.1463-1326.2012.01627.x
33. Thalange N, Biester T, Danne T. Clinical use of degludec in children and adolescents with T1D: a narrative review with fictionalized case reports. Diabetes Ther. 2019;10(4):1219-1237. doi: https://doi.org/10.1007/s13300-019-0641-3
34. Thalange N, Gundgaard J, Parekh W, Tutkunkardas D. Cost analysis of insulin degludec in comparison with insulin detemir in treatment of children and adolescents with type 1 diabetes in the UK. BMJ Open Diabetes Res Care. 2019;7:e000664. doi: https://doi.org/10.1136/bmjdrc-2019-000664
Об авторах
А. В. ВитебскаяРоссия
Витебская Алиса Витальевна, к.м.н.
119881, Москва, ул. Б. Пироговская, д. 19
eLibrary SPIN: 9857-9551
Е. В. Шрёдер
Россия
Шрёдер Екатерина Владимировна
eLibrary SPIN: 7997-2501
Москва
А. В. Попович
Россия
Попович Анастасия Владимировна
eLibrary SPIN: 3241-4064
Москва
Е. А. Писарева
Россия
Писарева Елена Александровна, к.м.н.
eLibrary SPIN: 7463-2105
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Уровень гликированного гемоглобина до и после перевода на деглудек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(78KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Гликемия натощак до и после перевода на деглудек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(82KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Вариабельность гликемии до и после перевода на деглудек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(87KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Средняя гликемия натощак в подгруппе пациентов с феноменом «утренней зари» до и после перевода на деглудек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(85KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Средняя гликемия в вечерние часы в подгруппе пациентов с феноменом «вечерней зари» до и после перевода на деглудек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(84KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Витебская А.В., Шрёдер Е.В., Попович А.В., Писарева Е.А. Ретроспективное исследование применения аналогов инсулина продленного действия детемир и деглудек у детей и подростков для преодоления вариабельности гликемии, обусловленной феноменами «утренней и вечерней зари». Сахарный диабет. 2021;24(4):315-324. https://doi.org/10.14341/DM12431
For citation:
Vitebskaya A.V., Shreder E.V., Popovich A.V., Pisareva E.A. Retrospective trial of long acting analogues detemir and degludec usage in children and adolescents to overcome glucose variability caused by dawn phenomenon and reverse dawn phenomenon. Diabetes mellitus. 2021;24(4):315-324. (In Russ.) https://doi.org/10.14341/DM12431
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































