Перейти к:
Оксидативный стресс и система протеолиза при сахарном диабете 2 типа
https://doi.org/10.14341/DM12402
Аннотация
Обоснование. В установлении диагноза сахарный диабет 2 типа наблюдается тенденция к многократному увеличению с каждым годом, что является проблемой здравоохранения. Распространенность сахарного диабета с каждым годом неуклонно растет. Сегодня сахарный диабет является лидером по распространенности неинфекционных заболеваний после онкологических заболеваний, сердечно-сосудистых патологий, нередко приводя к инвалидизации и летальным исходам. Универсальными реакциями организма на патологический процесс являются оксидативный стресс с окислительной модификацией белков-ферментов и активация перекисного окисления липидов, что приводит к неконтролируемой активации протеиназ поджелудочной железы в условиях развития сахарного диабета и его осложнений. Предрасполагающим фактором активации протеиназ может быть нарушение функционирования α1-протеиназного ингибитора (серпина) из-за окисления метионина в активном центре и снижения его способности ограничивать активность протеиназ.
Цель. Изучить взаимосвязь оксидативного стресса и системы «протеиназы-ингибиторы» при сахарном диабете 2 типа.
Материалы и методы. Проведено обсервационное одноцентровое одномоментное выборочное исследование с участием пациентов с сахарным диабетом 2 типа и контрольной группы (практически здоровые лица). У всех обследуемых в плазме крови спектрофотометрическим методом определялись активность эластазо-, трипсиноподобных протеиназ, α1-протеиназного ингибитора, содержание битирозина как показателя окислительной модификации белков и состояние перекисного окисления липидов (ПОЛ): концентрация ТБК-активных продуктов и активность антиоксидантных ферментов — супероксиддисмутазы, каталазы.
Результаты. Показано, что при сахарном диабете 2 типа в 2,34 раза повышается содержание ТБК-активных продуктов (показатель ПОЛ) и в 7 раз возрастает концентрация битирозина — показателя окислительной модификации белков, которая находилась в отрицательной зависимости от активности α1-протеиназного ингибитора (-0,79; р=0,03). Снижение активности α1-протеиназного ингибитора сопровождалось возрастанием активности эластазо- и трипсиноподобных протеиназ в 1,2 и 2,3 раза соответственно по сравнению с практически здоровыми лицами. Активность антиоксидантных ферментов, супероксиддисмутазы и каталазы, возрастала соответственно в 8,2 и 6,4 раза.
Заключение. Увеличение оксидативного стресса и окислительной модификации белков сопровождается снижением активности α1-протеиназного ингибитора и возрастанием активности эластазо-, трипсиноподобных протеиназ, а также антиоксидантных ферментов.
Ключевые слова
Для цитирования:
Дьяков Д.A., Акбашева О.Е. Оксидативный стресс и система протеолиза при сахарном диабете 2 типа. Сахарный диабет. 2022;25(1):14-20. https://doi.org/10.14341/DM12402
For citation:
Dyakov D.A., Akbasheva O.E. Oxidative stress and proteolysis system in type 2 diabetes. Diabetes mellitus. 2022;25(1):14-20. (In Russ.) https://doi.org/10.14341/DM12402
Сахарный диабет 2 типа (СД2) — хроническое заболевание, характеризующееся нарушением углеводного обмена с развитием гипергликемии, спровоцированное инсулинорезистентностью, а также секреторной дисфункцией β-клеток поджелудочной железы. По данным Регистра пациентов с сахарным диабетом, за 2017 г. в России зарегистрировано 4,5 млн человек, из них 94% имеют СД2 [1].
Патофизиологические механизмы, лежащие в основе сосудистых дисфункций при диабете, включают дисбаланс ингибиторного звена, повышенную выработку активных форм кислорода и протромботических факторов, что создает провоспалительный/тромботический потенциал для атеросклеротического поражения сосудов и развития сердечно-сосудистых осложнений [2][3].
Окислительный стресс — это стремительное усиление окислительных процессов в организме при ограниченном функционировании антиоксидантной системы. Избыточная продукция гидроперекисей угнетает транспорт электронов по дыхательной цепи митохондрий и β-окисление жирных кислот.
Супероксиддисмутаза (СОД, КФ 1.15.1.1) является главным антиоксидантным ферментом «первой линии защиты» клеток и тканей, который нейтрализует супероксидный анион — радикал кислорода с помощью реакции дисмутации. Известно, что СОД способствует эпителиально-мезенхимному переходу раковых клеток поджелудочной железы посредством активации пути H2O2/ERK/NF-κB, повышению инвазивной и миграционной активности рака поджелудочной железы [4].
Еще одним ферментом первого звена внутриклеточной защиты от активных форм кислорода является каталаза (КФ 1.11.1.6). Каталаза осуществляет гетеролитическое расщепление О–О-связи в перекиси водорода. Увеличение уровня маркеров окислительного стресса было обнаружено при раке поджелудочной железы и хронических панкреатитах. Образование активных форм кислорода, повреждающих липиды и белки, является общепризнанным фактом при развитии многих заболеваний [5][6].
В условиях окислительного стресса возрастает концентрация битирозина — одного из маркеров окислительной модификации белков. Под действием активных форм кислорода образовавшиеся фенокси-радикалы димеризуются с образованием битирозинов, что приводит к образованию белковых сшивок.
Активность эластазо- и трипсиноподобных протеиназ регулируется α1-протеиназным ингибитором (α1-ПИ). α1-ПИ относят к белкам «острой фазы», данная функция подтверждается резким увеличением активности ингибитора при неспецифической реакции воспаления, что направлено на торможение избыточного протеолиза. Данный ингибитор обладает широким спектром действия и обеспечивает 90–92% общей антипротеазной активности плазмы крови. α1-ПИ угнетает активность трипсина, эластазы, химотрипсина и других сериновых ферментов, инактивирует окислительные свойства нейтрофилов, тем самым проявляя свою противовоспалительную и иммуномодулирующую функции [7–10]. В активном центре α1-ПИ находится метионин, окисление которого под действием активных форм кислорода приводит к инактивации ингибитора. Однако окисленный α1-ПИ способен напрямую взаимодействовать с клетками, высвобождая хемокины IL-8 и MCP-1, которые, в свою очередь, привлекают макрофаги и нейтрофилы, потенцируя реакции воспаления [11]. Таким образом, повреждение активного центра в молекуле α1-ПИ в процессе оксидативного стресса приводит к неконтролируемому росту активности протеолитических ферментов.
Сериновые протеиназы синтезируются в ацинарных клетках поджелудочной железы — трипсин (КФ 3.4.21.4), химотрипсины А и В (КФ 3.4.21.1), химотрипсин С (КФ 3.4.21.2). Сравнительно недавно для трипсина открыты и внутриклеточные эффекты: стимулирование пролиферации и дифференцировки клеток, ангиогенеза, неопластической трансформации клеток [12]. Эти эффекты опосредуются специфическими протеиназо-активируемыми рецепторами (PARs). Увеличение активности трипсиноподобных протеиназ выявлено при заболеваниях желудочно-кишечного тракта: панкреатите, панкреонекрозе, гастритах, колитах, гепатитах [13].
Панкреатическая экзокринная недостаточность — частое явление при диабете 1 и 2 типа, проявляется межацинарным фиброзом от слабого до выраженного, скудным воспалительным инфильтратом, изменением протоков поджелудочной железы и гиалинизацией артерий [14].
Маркером воспаления является нейтрофильная эластаза (КФ 3.4.21.37), активность которой возрастает в очаге повреждения ткани. Значение эластазы в воспалении связано с гидролизом поврежденных структур: эластина, протеогликанов, адгезивных белков соединительной ткани. В поджелудочной железе присутствует панкреатическая эластаза (КФ 3.4.21.36), гликопротеин с молекулярной массой, равной 28 000 Да, активируемый трипсином [15].
Активация трипсином рецепторов, активируемых протеиназами-2 (PAR2), при СД2 приводит к микрососудистым осложнениям, таким как диабетическая нефропатия, гломерулосклероз и др. Активация рецепторов, активируемых протеиназами-1 (PAR1), стимулирует ангиогенез при пролиферативной диабетической ретинопатии [16].
Дефицит ингибиторов протеиназ в плазме крови больных СД2 может сопровождаться более тяжелым течением заболевания с поражением большего количества β-клеток поджелудочной железы [7].
Таким образом, роль и механизм повреждения α1-протеиназного ингибитора, а в дальнейшем рост активности протеолитических ферментов в комплексе с показателями оксидативного стресса недостаточно изучены при СД2.
Цель
Изучить процессы оксидативного стресса и активность системы «протеиназы-ингибиторы» при СД2.
Материалы и методы
Проведено исследование плазмы крови пациентов с СД2 и контрольной группы (практически здоровые лица). У всех обследуемых в плазме крови спектрофотометрическим методом определялась активность эластазо-, трипсиноподобных протеиназ, содержание α1-протеиназного ингибитора, активность СОД, каталазы, содержание ТБК-активных продуктов и битирозина.
Дизайн исследования
Проведено обсервационное одноцентровое одномоментное выборочное исследование с участием пациентов с СД2 и контрольной группы (практически здоровые лица) (рис. 1).
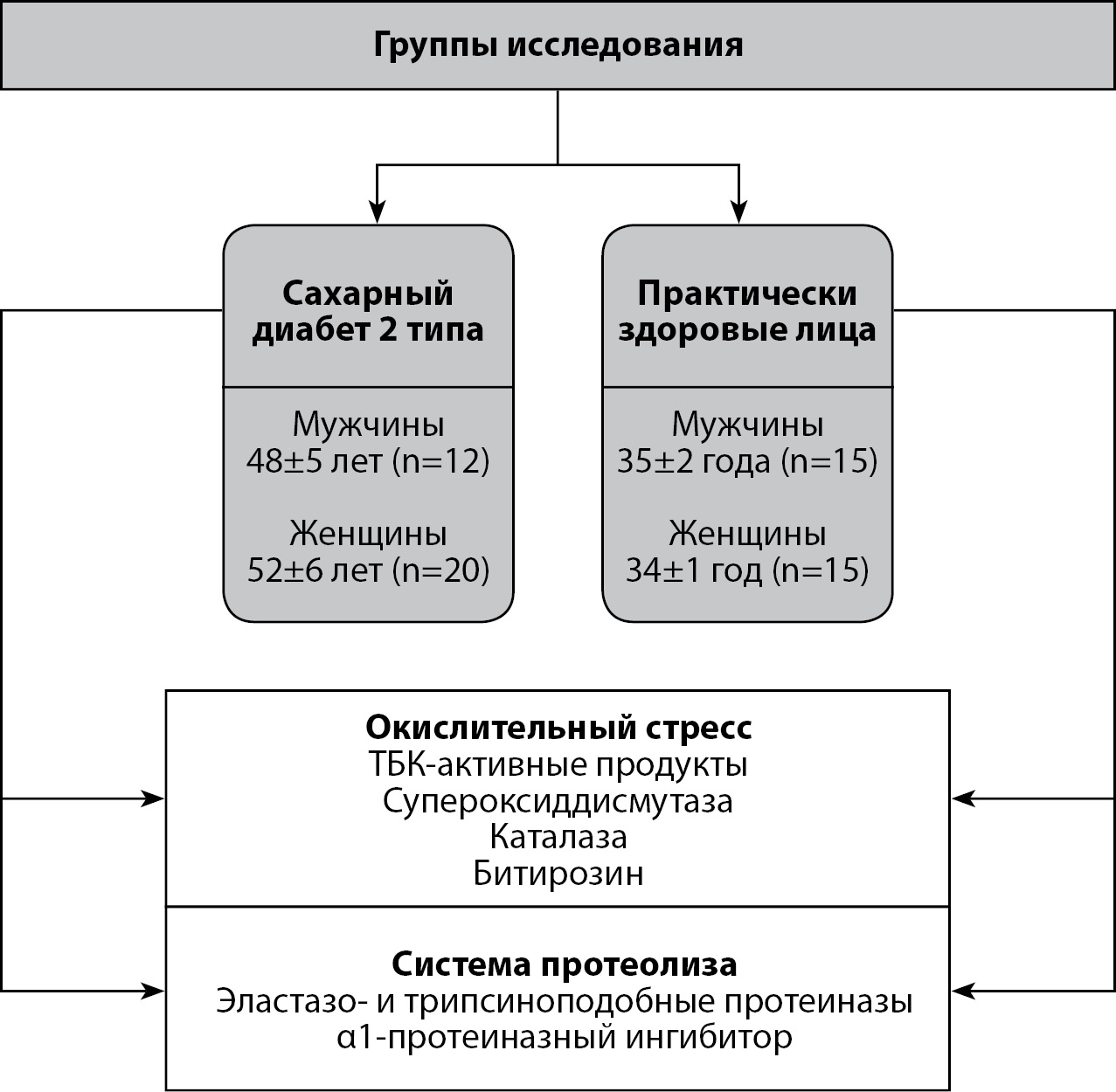
Рисунок 1. Дизайн исследования.
Критерии соответствия
Критерии включения в группу больных СД2: диагноз СД2, который был впервые поставлен в возрасте 30 лет или старше.
Условия проведения
Набор пациентов проводился в условиях стационара на базе факультетских и госпитальных клиник ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России, г. Томск. Определение изучаемых показателей производилось на кафедре биохимии и молекулярной биологии с курсом клинической лабораторной диагностики ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.
Продолжительность исследования
Взятие материала для исследования производилось при поступлении в клиники одномоментно. Контрольную группу (практически здоровые лица) составили лица, проходившие диспансеризацию без диагноза СД2.
Описание медицинского вмешательства
Производилось взятие крови из локтевой вены с дальнейшим получением плазмы крови при помощи центрифугирования. Пациентами было подписано информированное добровольное согласие на участие в исследовании.
Основной исход исследования
Данный вид инвазивного медицинского вмешательства является безопасным и является экономически приемлемым, т.к. взятие крови производится по показаниям госпитализации пациента, а также входит в обязательную процедуру прохождения плановой диспансеризации с дальнейшим определением биохимических показателей согласно половозрастной категории пациента.
Анализ в подгруппах
Группа пациентов с диагнозом СД2: средний возраст: мужчины — 48±5 лет (n=12), женщины — 52±6 лет (n=20).
Контрольная группа (практически здоровые лица): средний возраст: мужчины — 35±2 года (n=15), женщины — 34±1 год (n=15).
Методы регистрации исходов
В работе были использованы спектрофотометрические методы определения активности протеиназ по гидролизу синтетических субстратов.
Активность трипсиноподобных протеиназ определяли по гидролизу N-бензоил-L-аргинин-этилового эфира (БАЭЭ) по увеличению оптической плотности при 253 нм. Активность трипсиноподобных протеиназ выражали в нмоль гидролизованного БАЭЭ в 1 мин на 1 мл биологической жидкости. Активность эластазоподобных протеиназ измеряли по скорости гидролиза ρ-нитрофенилового эфира N-бутилоксикарбонил-L-аланина (БАНЭ) при 347,5 нм и рассчитывали в нмоль гидролизованного БАНЭ в 1 мин на 1 мл биологического материала. Активность α1-протеиназного ингибитора определяли по торможению БАЭЭ-эстеразной активности трипсина и выражали в условных ингибиторных единицах на 1 мл плазмы крови (ИЕ/мл). 1 ИЕ соответствует торможению гидролиза 1 мкмоль БАЭЭ [8].
Измерение содержания ТБК-активных продуктов проводили по реакции с тиобарбитуровой кислотой при длине волны 540 нм в мкмоль/мл [5]. Активность СОД оценивали по торможению реакции окисления раствора адреналина с рН=10,2 при 480 нм. За единицу активности СОД принимали количество фермента, вызывающего 50% торможение окисления адреналина. Активность каталазы (КФ 1.11.1.6) определяли по торможению распада перекиси водорода, по образованию окрашенного комплекса с молибдатом аммония при 410 нм и рассчитывали мкмоль/мин×г белка [5]. Концентрацию битирозина измеряли по интенсивности флюоресценции (в условных единицах — усл. ед.) при длине волны 415 нм, длина волны возбуждения — 325 нм. Измерялась флюоресценция на спектрофлуориметре «Флюорат 02-АБЛФ-Т», Россия. Регистрация оптической плотности исследуемых показателей производилась на спектрофотометре «СФ-2000», Россия.
Статистический анализ
Для оценки полученных данных, их сравнения и выявления статистически значимых различий между группами были использованы электронные таблицы Excel 2016 и пакет прикладных программ STATISTICA 23.0. Проверка на нормальность распределения производилась с помощью критерия Шапиро–Уилка. Далее проводилось сравнение с контрольной группой при помощи непараметрического U-критерия Манна–Уитни. Корреляционный анализ проводили с применением ранговой корреляции Спирмена.
Этическая экспертиза
Проведение исследования было одобрено ЛЭК Сибирского государственного медицинского университета (протокол №6 от 19.04.2020). Все испытуемые, включенные в исследование, подписывали информированное согласие.
Результаты
Объекты (участники) исследования
Клинико-анамнестическая характеристика исследуемых групп представлена в табл. 1. Более 30% обследованных пациентов с СД2 имели гипертоническую болезнь, ишемическую болезнь сердца, хроническую сердечную недостаточность, ретинопатию (табл. 1).
Таблица 1. Клинико-анамнестическая характеристика исследуемых групп
Практически здоровые лица n=30 | СД2 n=30 | р | |||
Демографические признаки | |||||
Пол, чел. | М | 15 | 10 | ||
Ж | 15 | 20 | |||
Возраст, лет | М | 35±2 | 48±5 | 0,04 | |
Ж | 34±1 | 52±6 | 0,03 | ||
Сопутствующие заболевания | |||||
Гипертоническая болезнь | ,n | 4 | 11 | 0,04 | |
Атеросклероз | 2 | 3 | ≥0,05 | ||
Нефропатия | 0 | 10 | 0,02 | ||
Ишемическая болезнь сердца | 2 | 2 | ≥0,05 | ||
Хроническая сердечная недостаточность | 1 | 10 | 0,02 | ||
Дислипидемия | 3 | 10 | 0,02 | ||
Хроническая болезнь почек | 0 | 8 | 0,02 | ||
Хронический пиелонефрит | 0 | 4 | 0,02 | ||
Ретинопатия | 0 | 12 | 0,01 | ||
Основные результаты исследования
Активность трипсиноподобных протеиназ при СД2 возросла в 2,3 раза (р<0,05). Активность эластазоподобных протеиназ увеличилась в 1,2 раза. Активность α1-протеиназного ингибитора снизилась на 23% по отношению к контрольной группе (табл. 2).
Таблица 2. Активность α1-протеиназного ингибитора и протеиназ в плазме крови
больных сахарным диабетом 2 типа и практически здоровых лиц, Me (Q1–Q3)
Показатель | Контроль n=30 | СД n=30 | р |
1 | 2 | ||
α1-Протеиназный ингибитор, ИЕ/мл | 30,0 (24,6–37,2) | 23,1 (20,8–42,4) | Р1–2=0,025 |
Трипсиноподобные протеиназы, нмоль БАЭЭ*/мин×мл | 63,2 (44,9–68,8) | 142,3 (79,3–167,1) | Р1–2=0,0012 |
Эластазоподобные протеиназы, нмоль БАНЭ**/мин×мл | 68,4 (50,3–90,25) | 79,8 (69,5–100,1) | Р1–2=0,025 |
*N-бензоил-L-аргинин-этиловый эфир
** N-бутилоксикарбонил L-аланина-нитрофениловый эфир
Активность СОД у пациентов с СД2 увеличилась в 8,2 раза, каталазы — в 6,4 раза. Содержание ТБК-активных продуктов в плазме крови возросло в 2,34 раза, а битирозина — в 7 раз по отношению к контрольной группе (табл. 3). Следует отметить, что среди двух универсальных реакций организма, к которым относятся активация ПОЛ и окислительная модификация белков, преимуществом с более выраженным изменением характеризуется окислительная модификация белков по сравнению с содержанием ТБК-активных продуктов.
Таблица 3. Показатели перекисного окисления липидов и содержание битирозина
в плазме крови больных сахарным диабетом (СД) 2 типа, Me (Q1–Q3)
Показатель | Контроль n=30 | СД n=30 | р |
1 | 2 | ||
ТБК-активные продукты, мкмоль/мл | 3,1 (2,25–3,5) | 7,25 (0,9–9,1) | Р1–2=0,0019 |
Супероксиддисмутаза, Eд/л | 0,09 (0,04–0,22) | 0,74 (0,32–0,82) | Р1–2=0,002 |
Каталаза, мкмоль/мин×г белка | 23,1 (15,7–25,9) | 147,6 (80,4–279,1) | Р1–2=0,012 |
Битирозин, усл. ед. | 1×10-3 (1×10-3–2×10-3) | 7×10-3 (4×10-3–13×10-3) | Р1–2=0,0018 |
Между активностью эластазо- и трипсиноподобных протеиназ выявлена прямая корреляционная зависимость (табл. 4). Отслеживается положительная корреляция между активностью эластазоподобных протеиназ и показателем окислительной модификации белков (содержание битирозина). Наблюдается обратная зависимость α1-ПИ от активности эластазоподобных протеиназ, а также прямая зависимость от активности трипсиноподобных протеиназ. Следует отметить, что между активностью ингибитора и содержанием битирозина выявлена отрицательная корреляция (рис. 2), что подтверждает инактивацию активного центра α1-протеиназного ингибитора в условиях окислительного стресса. При этом у практически здоровых лиц подобная корреляция отсутствовала.
Таблица 4. Коэффициенты корреляции Спирмена между изучаемыми показателями
при сахарном диабете 2 типа
Показатели | Эл | Тр | α1-ПИ | Кат | СОД | ТБК-ак. пр. |
Эл | 0,96** р=0,001 | -0,93** р=0,003 | 0,57 р=0,18 | 0,64 р=0,12 | 0,46 р=0,29 | |
Тр | 0,96** р=0,001 | -0,89** р=0,007 | 0,50 р=0,25 | 0,61 р=0,15 | 0,36 р=0,43 | |
α1-ПИ | -0,93** р=0,003 | -0,89** р=0,007 | -0,64 р=0,12 | -0,68 р=0,09 | -0,54 р=0,22 | |
Кат | 0,57 р=0,18 | 0,50 р=0,25 | -0,64 р=0,12 | 0,9** р=0,003 | 0,96** р=0,001 | |
СОД | 0,64 р=0,12 | 0,61 р=0,15 | -0,68 р=0,09 | 0,96** р=0,001 | 0,86* р=0,01 | |
ТБК-ак. пр. | 0,46 р=0,29 | 0,36 р=0,43 | -0,54 р=0,22 | 0,93** р=0,003 | 0,86** р=0,01 | |
Битир | 0,78* р=0,04 | 0,69 р=0,09 | -0,79* р=0,03 | 0,85* р=0,02 | 0,79* р=0,03 | 0,88** р=0,008 |
Примечания: α1-протеиназный ингибитор (α1-ПИ), эластазо- (Эл),
трипсиноподобные протеиназы (Тр),
каталаза (Кат), супероксиддисмутаза (СОД),
ТБК-активные продукты (ТБК-ак. пр.), битирозин (Битир);
*p<0,05; **p<0,01
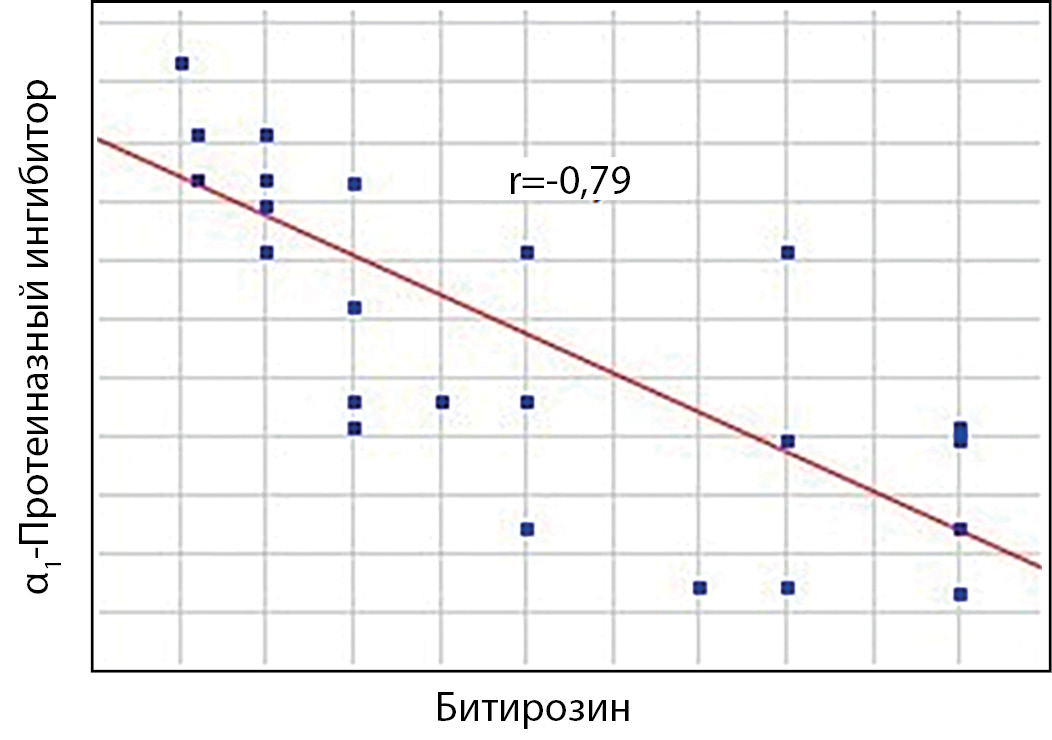
Рисунок 2. График корреляционной связи между битирозином
и α1-протеиназным ингибитором у больных сахарным диабетом 2 типа.
Обсуждение
Резюме основного результата исследования
Таким образом, со стороны системы протеолиза наблюдается увеличение активности протеолитических ферментов (эластазо- и трипсиноподобные протеиназы), чего нельзя сказать об α1-протеиназном ингибиторе, активность которого снижается. Активность оксидативного стресса при СД2 многократно возрастает, что подтверждается увеличением содержания ТБК-активных продуктов на фоне возрастания активности антиоксидантных ферментов (СОД, каталаза) и битирозина. Обнаружена положительная корреляция между показателями окислительного стресса. Максимальная сила связи наблюдается между активностью каталазы и концентрацией ТБК-активных продуктов.
Обсуждение основного результата исследования
В результате активации окислительного стресса происходят накопление его продуктов (ТБК-активные продукты) и продуктов окислительной модификации белков (битирозин), активация антиоксидантных ферментов (каталаза, СОД) по механизму автономной регуляции, а именно регуляция активности фермента уровнем субстрата или продуктом реакции [15]. Под действием активных форм кислорода происходит повреждение активного центра α1-ПИ, данный механизм подтверждается увеличением уровня окисленных модифицированных белков (битирозина). Обоснованием этого является наличие обратной зависимости активности α1-ПИ от содержания битирозина — продукта окислительной модификации белков. Дефицит α1-ПИ приводит к более выраженной активации протеолиза при СД. Коэффициент корреляции между эластазо- и трипсиноподобными протеиназами и α1-ПИ показывает значительно высокую отрицательную связь, это свидетельствует о нарушении контроля протеолиза. Дефицит α1-ПИ в плазме крови больных СД2 может сопровождаться более тяжелым течением заболевания с поражением большего количества β-клеток поджелудочной железы чрезмерной активацией протеолитических ферментов [7–9][17].
Заключение
Таким образом, активация протеолиза и окислительный стресс являются универсальными реакциями при СД2. Запускающим звеном активации протеолиза являются свободные радикалы, которые образуются в процессе оксидативного стресса и оказывают цитолизирующее действие на клетки, окисление активного центра ингибитора протеиназ. Снижение активности α1-ПИ сопровождается дисбалансом в системе «протеиназы-ингибиторы» и неконтролируемым ростом активности ферментов протеолиза, что может иметь существенное значение для развития осложнений СД2.
Список литературы
1. Поликарпов А.В. Заболеваемость всего населения России в 2017 году. Статистические материалы. Часть 1 / Под ред. А.В. Поликарпова, Г.А. Александровой, Н.А. Голубева. — М.: ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России; 2018. — 140 с.
2. Lepedda AJ, Lobina O, Rocchiccioli S, et al. Identification of differentially expressed plasma proteins in atherosclerotic patients with type 2 diabetes. J Diabetes Complications. 2016;30(5):880-886. doi: https://doi.org/10.1016/j.jdiacomp.2016.03.007
3. Hardt PD, Ewald N. Exocrine Pancreatic Insufficiency in Diabetes Mellitus: A Complication of Diabetic Neuropathy or a Different Type of Diabetes? Exp Diabetes Res. 2011;2011:1-7. doi: https://doi.org/10.1155/2011/761950
4. Li W, Cao L, Han L, et al. Superoxide dismutase promotes the epithelial-mesenchymal transition of pancreatic cancer cells via activation of the H2O2/ERK/NF-κB axis. Int J Oncol. 2015;46(6):2613-2620. doi: https://doi.org/10.3892/ijo.2015.2938
5. Меньщикова Е.Б. Окислительный стресс. Патологические состояния и заболевания / Под ред. Е.Б. Меньщиковой, И.К. Зенкова, В.З. Ланкина, и др. — Новосибирск: АРТА; 2008. — 284 с.
6. Kodydkova J, Vavrova L, Stankova B, et al. Antioxidant Status and Oxidative Stress Markers in Pancreatic Cancer and Chronic Pancreatitis. Pancreas. 2013;42(4):614-621. doi: https://doi.org/10.1097/MPA.0b013e318288360a
7. Poteryaeva ON, Russkich GS, Panin LE. Analysis of Serum Activities of Matrix Metalloproteinases and α1-Proteinase Inhibitor in Patients with Type 2 Diabetes Mellitus. Bull Exp Biol Med. 2012;152(5):578-579. doi: https://doi.org/10.1007/s10517-012-1579-x
8. Веремеенко К.Н. Протеолитические ферменты и их ингибиторы. Новые области применения в клинике // Врачебное дело. — 1994. — №1. — С. 8-13.
9. Sandström CS, Ohlsson B, Melander O, et al. An association between type 2 diabetes and α 1 -antitrypsin deficiency. Diabet Med. 2008;42(4):614-621. doi: https://doi.org/10.1111/j.1464-5491.2008.02584.x
10. Дьяков Д.А., Акбашева О.Е. Состояние системы протеолиза у больных внебольничной пневмонией, протекающей на фоне сахарного диабета типа 2 // Молекулярная медицина. — 2020. — Т. 18. — №2. — С. 60–63. doi: https://doi.org/10.29296/24999490-2020-02-11
11. Li Z, Alam S, Wang J, Sandstrom CS, et al. Oxidized α 1 -antitrypsin stimulates the release of monocyte chemotactic protein-1 from lung epithelial cells: potential role in emphysema. Am J Physiol Cell Mol Physiol. 2009;297(2):L388-L400. doi: https://doi.org/10.1152/ajplung.90373.2008
12. Маслов А.А., Франциянц Е.М., Козлова Л.С., Малинин С.А. Трипсиноподобные протеиназы, кининовая система и ингибиторы в плазме крови больных при раке желудка и лимфоме селезенки // Международный журнал прикладных и фундаментальных исследований. — 2014. — Т. 10. — №1. — С. 124-129.
13. Кит О.И., Франциянц Е.М., Козлова Л.С. Трипсиновые протеиназы в дифференциальной диагностике доброкачественных, первичных и вторичных злокачественных опухолей головного мозга // Современные проблемы науки и образования. — 2016. — №6. — C. 4.
14. Prasanna Kumar H, Gowdappa HB, Hosmani T, Urs T. Exocrine dysfunction correlates with endocrinal impairment of pancreas in Type 2 diabetes mellitus. Indian J Endocrinol Metab. 2018;22(1):121. doi: https://doi.org/10.4103/ijem.IJEM_139_17
15. MacfarlaneSR, SeatterMJ, Kanke T. Proteinase-activated receptors. Pharmacol. Rev. 2001;53(2):245-282.
16. Kumar VR, Darisipudi MN, Steiger S, et al. Cathepsin S Cleavage of Protease-Activated Receptor-2 on Endothelial Cells Promotes Microvascular Diabetes Complications. J Am Soc Nephrol. 2016;27(6):1635-1649. doi: https://doi.org/10.1681/ASN.2015020208
17. Азизова Г.И., Дадашова А.Р., Амирова М.Ф. Биомаркеры оксидативного стресса и состояние антиоксидантной системы при сахарном диабете типа 2 // Universum: Медицина и фармакология. — 2016. — Т. 6. — №7.
Об авторах
Д. A. ДьяковРоссия
Дьяков Денис Александрович - ассистент; eLibrary SPIN: 3029-3824.
634050, Томск, Московский тракт, д. 2
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
О. Е. Акбашева
Россия
Акбашева Ольга Евгеньевна - доктор медицинских наук, профессор; eLibrary SPIN: 8042-6940
Томск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн исследования | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(192KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. График корреляционной связи между битирозином и α1-протеиназным ингибитором у больных сахарным диабетом 2 типа | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(105KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дьяков Д.A., Акбашева О.Е. Оксидативный стресс и система протеолиза при сахарном диабете 2 типа. Сахарный диабет. 2022;25(1):14-20. https://doi.org/10.14341/DM12402
For citation:
Dyakov D.A., Akbasheva O.E. Oxidative stress and proteolysis system in type 2 diabetes. Diabetes mellitus. 2022;25(1):14-20. (In Russ.) https://doi.org/10.14341/DM12402

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































