Перейти к:
Повторная трансплантация почки у пациентки с сахарным диабетом 1 типа и хроническим пиелонефритом: клинический случай
https://doi.org/10.14341/DM13393
Аннотация
В настоящее время аллотрансплантация трупной почки представляет собой наиболее эффективный и безопасный метод лечения терминальной почечной недостаточности у пациентов с сахарным диабетом. Для предотвращения отторжения трансплантата необходимо учитывать множество факторов, способствующих его повреждению. Особое внимание следует уделить снижению риска инфекционных осложнений трансплантата, возникающих на фоне иммуносупрессивной терапии.
В данной статье представлен клинический случай пациентки с отторжением почечного трансплантата, которое произошло вскоре после эпизода острого пиелонефрита и повторной аллотрансплантации трупной почки.
Ключевые слова
Для цитирования:
Звягинцева А.Н., Иванова Д.В., Северина А.С., Сухарева О.Ю., Шамхалова М.Ш. Повторная трансплантация почки у пациентки с сахарным диабетом 1 типа и хроническим пиелонефритом: клинический случай. Сахарный диабет. 2025;28(5):480-486. https://doi.org/10.14341/DM13393
For citation:
Zvyagintseva A.N., Ivanova D.V., Severina A.S., Sukhareva O.Y., Shamkhalova M.S. Repeat kidney transplantation in a patient with type 1 diabetes mellitus and chronic pyelonephritis: a clinical case. Diabetes mellitus. 2025;28(5):480-486. (In Russ.) https://doi.org/10.14341/DM13393
АКТУАЛЬНОСТЬ
Трансплантация почки является оптимальным методом заместительной почечной терапии (ЗПТ) у пациентов с сахарным диабетом 1 типа (СД1) и терминальной стадией диабетической нефропатии (ДН). Данный метод лечения имеет ряд преимуществ: ликвидация уремической интоксикации, снижение сердечно-сосудистых рисков, устранение или уменьшение степени выраженности осложнений хронической болезни почек (ХБП), в значительной степени влияющих на прогноз пациентов, и в целом улучшение качества жизни за счет отсутствия необходимости диализа. Предпочтительно, чтобы ЗПТ программным гемодиализом (ПГД) или перитонеальным диализом рассматривалась как промежуточный этап именно в плане подготовки к трансплантации почки. Тем не менее трансплантация почки представляет собой сложное хирургическое вмешательство с высоким риском послеоперационных осложнений, как в раннем, так и позднем периоде, требующее как тщательной подготовки пациента к операции, так и последующего наблюдения целой командой специалистов (нефролога, трансплантолога, эндокринолога, кардиолога и др.) [1].
Наиболее часто встречающимися осложнениями, ассоциированными со снижением функции почечного трансплантата, являются острый канальцевый некроз и отторжение трансплантата (43,4%), инфекционные осложнения (28,6%), а также тромбоз сосудов трансплантата вследствие атеросклероза подвздошных артерий (28,6%) [2–4].
Инфекции трансплантата являются часто встречающимся осложнением у данных пациентов [5].
В настоящей статье представлен клинический случай пациентки с СД1 и хроническим пиелонефритом, у которой на фоне острого пиелонефрита трансплантата развилось его отторжение, потребовавшее проведение повторной трансплантации трупной почки.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка А., 36 лет, с СД1, манифестировавшим с кетоацидотической комы, диагностирован в 1997 г. (в возрасте 9 лет, продолжительность заболевания — 27 лет).
После проведения реанимационных мероприятий инициирована инсулинотерапия в базис-болюсном режиме, однако стойкой компенсации основного заболевания с самого его начала и на протяжении всего периода достичь не удавалось. Отмечались частые гипо- и гипергликемии; в анамнезе — 2 кетоацидотические комы и тяжелые гипогликемии со снижением уровня глюкозы до 0,6 ммоль/л потребовавшие госпитализации в ОРИТ. Обучение в школе для пациентов с СД проходила в детстве.
С 2010 г. в анамнезе — хронический пиелонефрит с обострениями от 1 до 3 раз в год. С декабря 2014 г. в связи с рецидивирующей инфекцией мочевыводящих путей проводилась массивная антибиотикотерапия, в т.ч. препаратами группы аминогликозидов. Протеинурия впервые зарегистрирована в 2015 г. на фоне обострения хронической инфекции мочевыводящих путей (2 г/л в суточной моче, креатинин — 111,9 мкмоль/л, расчетная скорость клубочковой фильтрации (рСКФ) по CKD-EPI — 59 мл/мин/1,73 м²). С 2015 г. отмечалось активное прогрессирование симптомов ХБП: отечный синдром, протеинурия, повышение уровня креатинина до 328 мкмоль/л, снижение рСКФ по CKD-EPI до 38 мл/мин/1,73 м², артериальная гипертензия 3 степени, в связи с чем назначен фуросемид в больших дозировках с положительным эффектом, а также ингибитор ангиотензинпревращающего фермента (иАПФ) (эналаприл 20 мг).
С октября 2015 г. переведена на помповую инсулинотерапию аналогом инсулина ультракороткого действия (лизпро), на которой находится по настоящее время, с 2020 г. использует помпу Medtronic 722. Гликированный гемоглобин на фоне проводимой сахароснижающей терапии — 7,2%. Использует датчик непрерывного мониторирования глюкозы — время в целевом диапазоне 66%, средний уровень глюкозы — 8,5 ммоль/л, вариабельность уровня глюкозы — 37,6% (рис. 1).
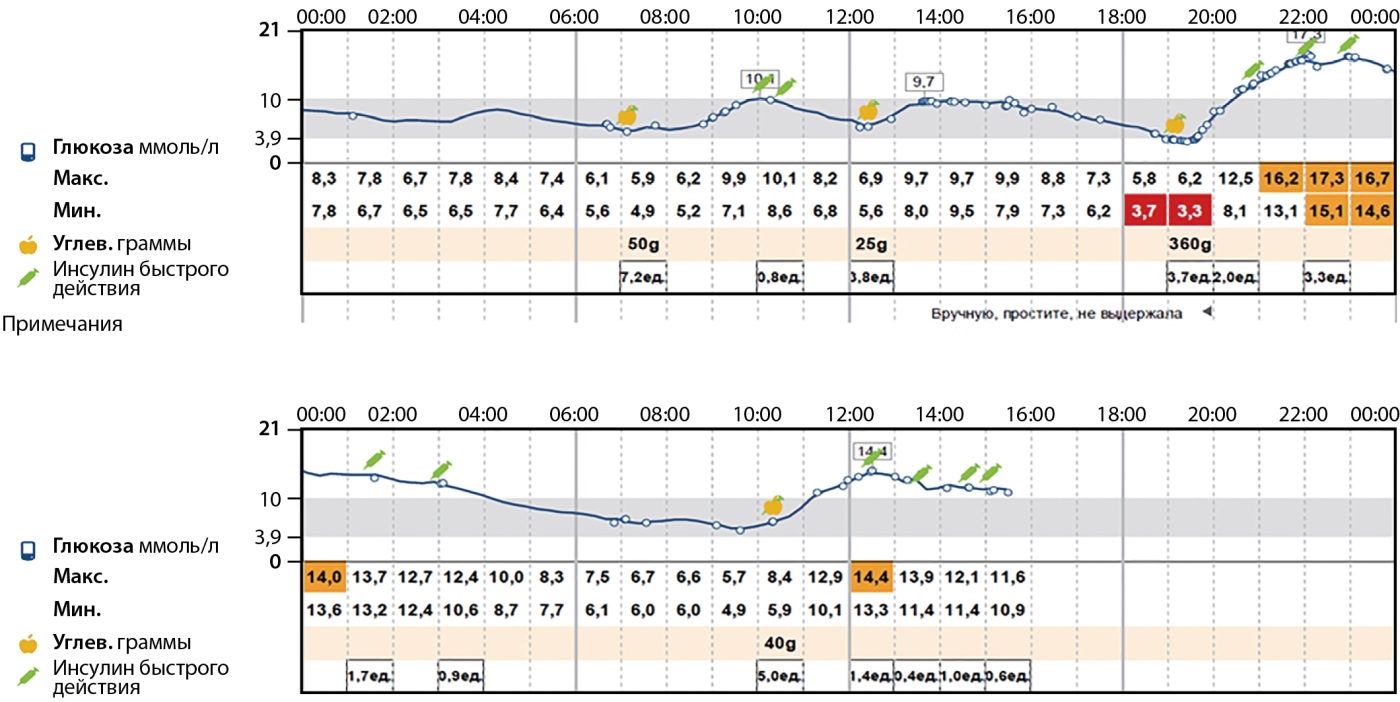
Рисунок 1. Данные непрерывного мониторирования уровня глюкозы при поступлении.
В 2017 г. на фоне беременности, выявлено повышение креатинина до 700 мкмоль/л, после прерывания беременности креатинин снизился до 250 мкмоль/л с последующим постепенным повышением уровня на фоне частых мочевых инфекций. В этот период на предмет поздних осложнений не обследовалась.
В 2019 г. диагностирован вирусный гепатит С, проведено противовирусное лечение (велпатасвир + софосбувир по схеме) с положительной динамикой в виде снижении вирусной нагрузки.
По жизненным показаниям в январе 2019 г. (повышение уровня креатинина до 600 мкмоль/л, рСКФ по CKD-EPI — 8 мл/мин/1,73 м², отечный синдром, неконтролируемая артериальная гипертензия) инициирована ЗПТ ПГД через центральный венозный катетер (ЦВК). Впоследствии была сформирована артериовенозная фистула левого предплечья, и пациентка находилась на ЗПТ ПГД в течение 4 мес.
15 мая 2019 г. в НИИ скорой помощи им. Н.В. Склифософского проведена аллотрансплантация трупной почки (АТТП) в левую подвздошную область по поводу терминальной стадии ДН. Функция трансплантата немедленная, инициирована трехкомпонентная иммуносупрессивная терапия такролимусом, микофеноловой кислотой, метилпреднизолоном. После АТТП наблюдалась выраженная гипотония без приема антигипертензивных препаратов со снижением АД до 70/50 мм рт.ст. с эпизодами потери сознания.
В результате неоднократного индивидуального обучения основам инсулинотерапии при СД1, использованию инсулиновой помпы, применению современных инсулинов и регулярного контроля гликемии, как при помощи глюкометра, так и непрерывного мониторирования глюкозы, показатели гликемии приблизились к целевым значениям (рис. 2).
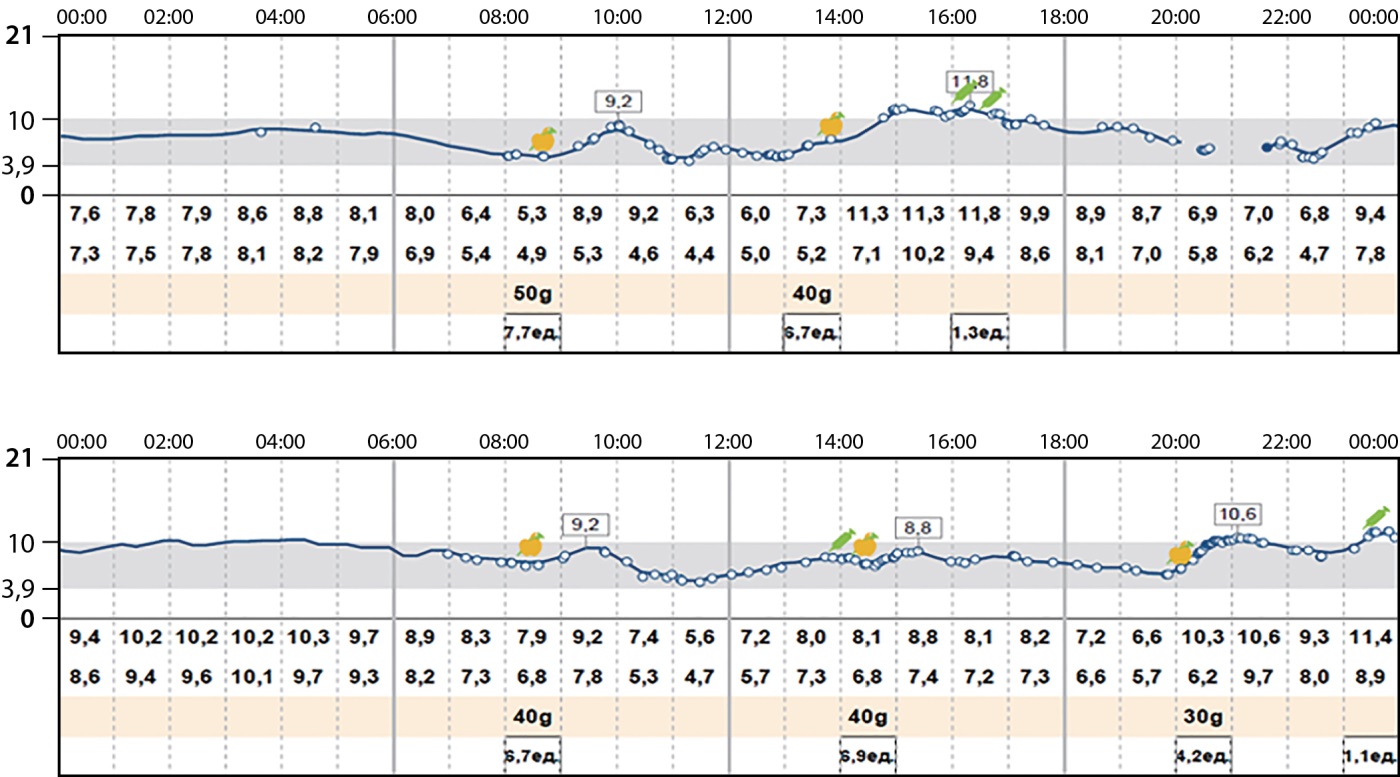
Рисунок 2. Данные непрерывного мониторирования уровня глюкозы после трансплантации почки.
23.05.2019 г. отметила снижение темпа диуреза, повышение температуры, тошноту, в связи с чем проведена коррекция иммуносупрессивной терапии (конверсия микофеноловой кислоты на азатиоприн) с положительной динамикой.
08.06.2019 г. в связи с жалобами на повышение температуры, резкое снижение диуреза при дообследовании выявлен острый пиелонефрит трансплантата, проведен бактериальный посев мочи с оценкой чувствительности к антибиотикам, получен рост: Klebsiela Pneumoniae, резистентной к антибактериальной (АБ) терапии, в диагностически значимом титре. В связи с неэффективностью консервативной терапии, по жизненным показаниям 23.07.2019 г. выполнена трансплантатэктомия. Сохранялись признаки синдрома системной воспалительной реакции, назначена массивная АБ терапия (в том числе амикацином — с дальнейшей потерей слуха, пользуется слуховым аппаратом). Возобновлен ПГД, который получала на протяжении 5 лет, с удовлетворительной переносимостью. Во время проведения ЗПТ ПГД отмечалась нормотония, без приема антигипертензивной терапии. С января 2023 г. включена в лист ожидания траснплантации почки, в феврале 2024 г. выполнена повторная АТТП в Московском многопрофильном научно-клиническом центре им. С.П. Боткина, функция трансплантата немедленная, креатинин после операции — 140–190 мкмоль/л, возобновлена трехкомпонентная иммуносупрессивная терапия, которую получает по настоящее время. В октябре 2024 г. СКФ по пробе Реберга-Тареева — 21,4 мл/мин, соотношение альбумин/креатинин в разовой порции утренней мочи — 4,1 мг/ммоль, что соответствует ХБПС4А2. При УЗИ трансплантата и УЗДС его сосудов патологии не выявлено. После повторной АТТП от 2024 г. АД — в пределах нормы без антигипертензивной терапии.
В посттрансплантационном периоде отмечается регресс нефрогенной анемии, в настоящий момент не получает препараты железа и эритропоэтин. Уровень гемоглобина — 111 г/л, железо — 7,9 мкмоль/л, ферритин — 68,9 нг/мл, трансферрин — 2,31 г/л, насыщение трансферрина железом — 13,97 % (рис. 1).
После повторной трансплантации нормокальциемия по альбумин-скорректированному кальцию (2,212 ммоль/л), нормофосфатемия (1,39 ммоль/л), повышение уровня паратгормона (ПТГ) (84 пг/мл) на фоне дефицита витамина D (25 OH витамина D = 15 нг/мл). Постоянно принимает колекальциферол 1500 МЕ утром и кальция карбонат 500 мг через сутки. По данным денситометрии поясничного отдела позвоночника, предплечья, проксимального отдела бедра, минеральная плотность костной ткани соответствует возрастной норме.
В анамнезе — диабетическая пролиферативная ретинопатия, клинически значимый макулярный отек с обеих сторон, многократное проведение лазеркоагуляции сетчатки (ЛКС), в том числе после повторной трансплантации.
В апреле 2015 г. диагностирована диабетическая дистальная полинейропатия, сенсомоторная форма. В 2021 г. — низкотравматический перелом тела пяточной кости правой стопы с дальнейшим формированием диабетической нейроостеоартропатии правой стопы, хронической стадии, фазы 1. Длительно носила индивидуальную разгрузочную повязку Total Contact Cast на правой ноге с последующим переходом на ортопедическую обувь индивидуального пошива.
Выявлен атеросклероз (медиакальциноз) артерий нижних конечностей: стеноз правой общей артерии бедра до 20–30%, стеноз подколенных артерий до 20–30%, постоянно принимает аторвастатин 20 мг вечером, на этом фоне уровень ЛПНП — 1,6 ммоль/л.
Динамика основных лабораторных показателей представлена на рис. 3.
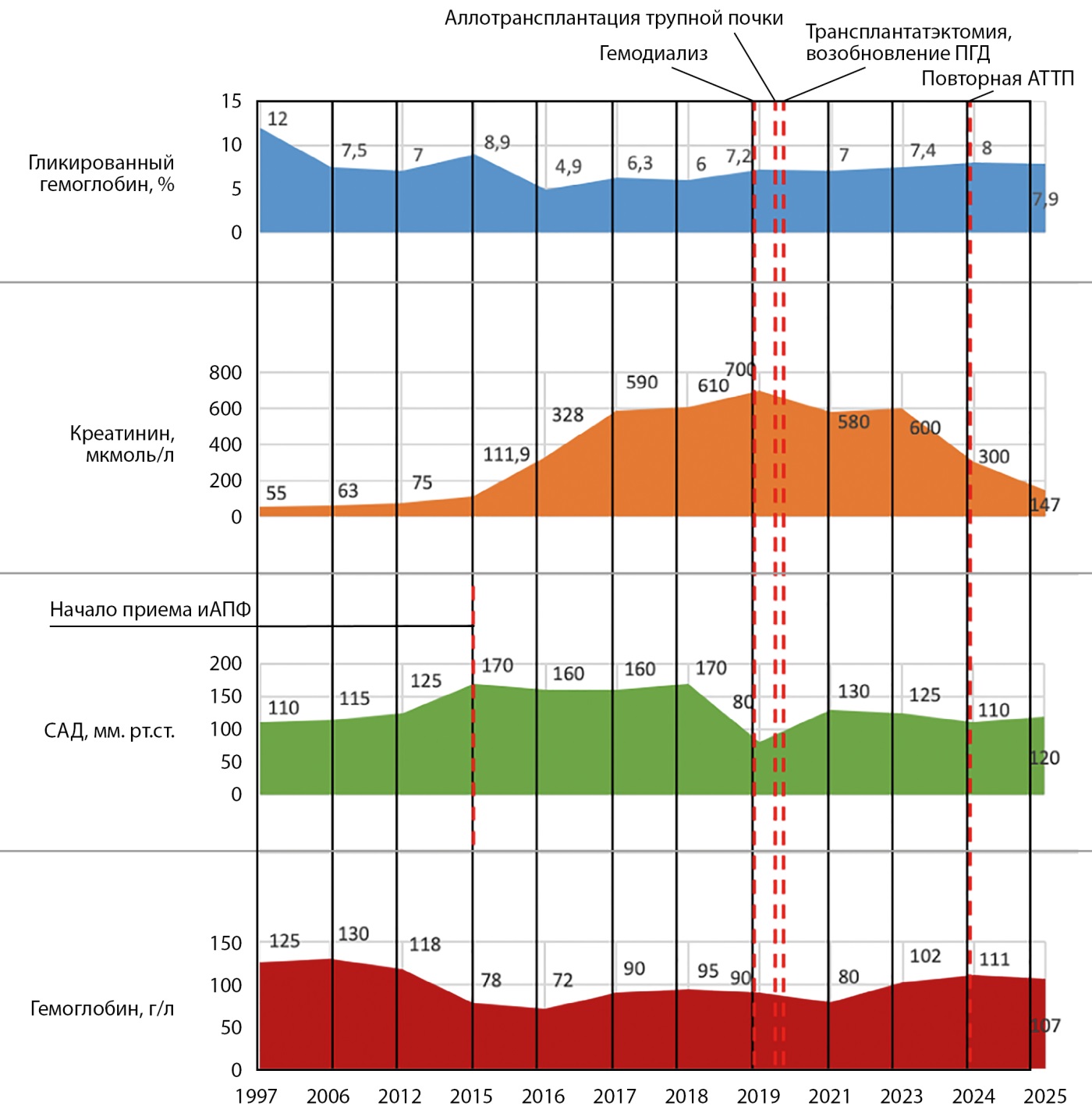
Рисунок 3. Динамика основных лабораторных показателей.
Таким образом, в настоящее время сформулирован следующий клинический диагноз.
Основное заболевание: «Сахарный диабет 1 типа» [ E10.7].
Осложнения основного заболевания. Диабетические микроангиопатии: пролиферативная ретинопатия обоих глаз. Состояние после панретинальной ЛКС (2013 г., октябрь 2024 г). Начальная катаракта обоих глаз. Диабетическая нефропатия. Состояние после аллотрансплантации трупной почки в 2019 г., отторжение почечного трансплантата в июне 2019 г. Повторная аллотрансплантации трупной почки в феврале 2024 г. Функция почечного трансплантата соответствует ХБПС4А2. Артериальная гипертензия 3 ст., контролируемая АГ, риск 4. Нефрогенная анемия легкой степени тяжести. МКН при ХБП: Вторичный гиперпаратиреоз. Дефицит витамина D.
Дистальная диабетическая полинейропатия, сенсомоторная форма. Низкотравматический перелом тела пяточной кости правой стопы. Диабетическая нейроостеоартропатия правой стопы, хроническая стадия, фаза 1. Раневой дефект 4 пальца правой стопы Wagner I.
Диабетические макроангиопатии: атеросклероз артерий нижних конечностей: стеноз правой общей артерии бедра до 20–30%, стеноз подколенных артерий до 20–30%.
Сопутствующие заболевания. Хроническая инфекция мочевыводящих путей, вне обострения. Миопия слабой степени правого глаза. Дислипидемия. Хронический вирусный гепатит с 2019 г., вне обострения. Нейросенсорная тугоухость.
ОБСУЖДЕНИЕ
Терминальная стадия ХБП у пациентов с СД1 развивается в более молодом возрасте, что связано с ранним дебютом заболевания и быстропрогрессирующим развитием микро- и макрососудистых осложнений [7]. Развитие микрососудистых осложнений, в частности ДН, может быть связано с особенностями дебюта заболевания, наличием острых осложнений СД (развитие острого повреждения почки (ОПП) в результате кетоацидотических состояний), состоянием углеводного обмена в особенности в первые 6–8 лет от дебюта заболевания, своевременной диагностикой и назначением патогенетически обоснованной терапии. Неудовлетворительный гликемический контроль влияет на судьбу пациента за счет эффекта «метаболической памяти», так как нарушения, возникшие под влиянием гипергликемии, сохраняются еще длительное время после нормализации показателей углеводного обмена [8].
Дебют заболевания с острых осложнений (кетоацидотическая кома) ведет за собой невосполнимую утрату нефронов в результате развития ОПП [9]. В представленном клиническом случае СД1 дебютировал с кетоацидотической комы, в последующем у пациентки имели место 2 кетоацидотические комы.
По данным литературы, наиболее часто ХБП возникает у пациентов с дебютом СД1 в возрасте 11–20 лет, это связано с патологическим воздействием на почки возрастной гормональной перестройки растущего организма [11]. Кроме того, достижение и стойкое поддержание компенсации углеводного обмена при дебюте СД1 в подростковом возрасте во многом определяется поведенческими факторами (недостаточным гликемическим контролем, отрицанием своего заболевания, неадекватно проводимой инсулинотерапии) [7][10]. У нашей пациентки дебют СД1 пришелся на возраст 9 лет.
По данным исследования Diabetes Control and Complication Study, компенсация углеводного обмена является ключевым фактором профилактики диабетической нефропатии, так как ведущая роль в развитии микро- и макрососудистых осложнений принадлежит гипергликемии, под воздействием которой запускается неферментное гликирование белков, окислительный стресс, происходит активация протеинкиназы С, действие факторов роста, вазоактивных факторов, цитокинов, вызывающих повреждение почек на клеточном уровне. Вышеперечисленные факторы ведут к развитию почечной гипертрофии и аккумуляции экстрацеллюлярного матрикса, предшествующих таким необратимым изменениям, как гломерулосклероз и тубулоинтерстициальный фиброз [12]. Ключевыми причинами прогрессирующего течения диабетической нефропатии у нашей пациентки стали многократные кетоацидотические комы, провоцирующие гибель нефронов, хронический пиелонефрит с частыми обострениями в анамнезе, нерациональной антибиотикотерапией (аминогликлазиды), и несвоевременное назначение нефропротективной (иАПФ или блокаторы рецептора ангиотензина-II (БРА)) и гиполипидемической терапии.
Трансплантация почки — оптимальный метод ЗПТ, обеспечивающий максимальную продолжительность жизни, высокое ее качество и социальную реабилитацию реципиентов при высокой экономической эффективности в сравнении с другими методами ЗПТ [13].
Залогом успешной трансплантации почки является качество донорского материала, оснащение медицинского учреждения, наличие высококвалифицированных специалистов и состояние реципиента на момент проведения операции.
Одним из факторов выживаемости почечного трансплантата является возраст, как донора, так и реципиента: более молодые реципиенты имеют лучший прогноз выживаемости почечного трансплантата [14, 15]. Важнейшим фактором успешной трансплантации почки является HLA-совместимость, это обеспечивает лучшую функцию трансплантата, меньшее количество эпизодов отторжения, более длительную выживаемость трансплантата и возможность снижения иммуносупрессивной терапии [16].
В дальнейшем правильно назначенная современная иммуносупрессивная терапия в адекватных дозировках позволяет снизить частоту острого отторжения с 40–50% до 10–15% и сохранять функцию трансплантата в течение длительного времени [16].
Несмотря на современные достижения трансплантологии, как в области совершенствования хирургической тактики, так и современной иммуносупрессивной терапии, в ряде случаев развивается дисфункция трансплантата, требующая возобновления терапии ПГД, и встает вопрос о повторной трансплантации почки. По статистике в США из 100 000 пациентов, ежегодно начинающих лечение диализом, 5% в прошлом перенесли трансплантацию почки, в национальном листе ожидания доля пациентов, ожидающих повторную пересадку, составляет 14%, а из общего числа трансплантаций почки 11,5% составляют ретрансплантации [17][18]. Аналогичная ситуация наблюдается и в странах Европы [19][20]. В большинстве случаев технические особенности повторной трансплантации почки не вызывают сложностей, с учетом анатомических особенностей целесообразней использовать левую почку (большая длина сосудов) [21]. Однако повторную трансплантацию почки должен выполнять опытный хирург-трансплантолог для обеспечения адекватного артериального притока, венозного оттока и подтверждения наличия достаточного пространства для повторной имплантации [22].
Инфекции трансплантата являются часто встречающимся осложнением у данных пациентов по причине приема иммуносупрессивной терапии, которая подвергает пациента повышенному риску инфекционных заболеваний, а также реактивации скрытых патогенов, возникновению оппортунистических инфекций [5]. Учитывая трудности в их лечении, обусловленные природой возбудителя (чаще всего причиной инфекции является внутрибольничная флора, резистентная к большому количеству антибиотиков), необходимостью приема иммуносупрессивной терапии, декомпенсацией углеводного обмена, такие инфекции зачастую являются рецидивирующими, что существенно ухудшает прогноз для почечного трансплантата, и в итоге может приводить даже к его отторжению и необходимости возобновления ПГД [6].
В связи с рецидивирующей хронической мочевой инфекцией и пиелонефритом пациентке были назначены аминогликлазиды вследствие неэффективности других антибактериальных препаратов, однако не была учтена их нефро- и ототоксичность. Аминогликлазиды обладают прямым токсичным действием на почечные канальцы, что способствует развитию ХБП неолигурического типа и затрудняет своевременную диагностику [23].
Пациенты с вирусным гепатитом С имеют более высокий риск смертности в течение первых 6 месяцев после трансплантации почки [24]. Также наличие вирусного гепатита С способствует развитию цирроза печени у пациентов после трансплантации почки [25]. Лечение вирусного гепатита С лучше проводить до трансплантации с целью снижения риска отторжения трансплантата [25].
Одним из важнейших вопросов повторной АТТП является дополнительная антигенная стимуляция (новый донор), что может потребовать коррекции иммуносупрессивной терапии [22]. В случае задержки ретрансплантации целесообразно прекратить или произвести коррекцию режима иммуносупрессивной терапии после отторжения аллотрансплантата [22] для профилактики развития неиммунологических осложнений (инфекции, сердечно-сосудистые катастрофы и посттрансплантатные злокачественные опухоли) [26].
Пациенты после повторной трансплантации почки имеют очень высокий риск смертности (выше, чем после первичной), однако риск меньше, чем при продолжении ПГД [27].
В случае нашей пациентки повторная трансплантация почки прошла успешно, однако на момент обследования функция почечного трансплантата соответствует ХБПС4А2, что требует тщательного регулярного контроля со стороны нефролога, трансплантолога и эндокринолога.
ЗАКЛЮЧЕНИЕ
Таким образом, успешное проведение повторной трансплантации почки требует междисциплинарного подхода, тщательной подготовки пациента и индивидуализации иммуносупрессивной терапии. Несмотря на высокий иммунологический риск, при адекватной оценке донорско-реципиентной совместимости, компенсации углеводного обмена, контроля минерально-костных нарушений при ХБП, коррекции анемии и нормализации артериального давления возможно успешное проведение трансплантации с улучшением прогноза для пациента.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа проведена в рамках выполнения государственного задания Минздрава России (№123021000038-6).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Звягинцева А.Н. — анализ медицинской документации пациентки, литературных данных и написание текста; Иванова Д.В. — анализ медицинской документации пациентки, литературных данных и написание текста; Северина А.С. — написание текста, анализ литературных данных; Сухарева О.Ю. — внесение существенных правок в текст статьи, анализ литературных данных; Шамхалова М.Ш. — разработка концепции, дизайна, анализ литературных данных, окончательное утверждение для публикации рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациентки. Авторы настоящей статьи получили письменное разрешение от упомянутой в статье пациентки на публикацию ее медицинских данных в журнале «Сахарный диабет».
Список литературы
1. Wang Y., Hemmelder M.H., Bos W.J.W., et al. Mapping health-related quality of life after kidney transplantation by group comparisons: a systematic review. Nephrology Dialysis Transplantation. 2021;36(12): 2327–2339. doi: 10.1093/ndt/gfab232.
2. Grochowiecki T., Gałązka Z., Madej K., et al. Surgical complications related to transplanted pancreas after simultaneous pancreas and kidney transplantation. Transplantation Proceedings. 2014; 46 (8): 2818–2821. doi: 10.1016/j.transproceed.2014.08.012.
3. Sansalone C.V., Maione G., Aseni P., et al. Surgical complications are the main cause of pancreatic allograft loss in pancreas-kidney transplant recipients. Transplantation Proceedings. 2005; 37 (6); 2651–2653. doi: 10.1016/j.transproceed.2005.06.103.
4. Michalak G., Kwiatkowski A., Czerwinski J., et al. Surgical complications of simultaneous pancreas-kidney transplantation: a 16-year-experience at one center. Transplantation Proceedings. 2005; 37 (8.); 3555–3557. doi: 10.1016/j.transproceed.2005.09.077.
5. Nambiar P., Silibovsky R., Belden K.A. Infection in Kidney Transplantation. Contemporary Kidney Transplantation. 2018; 307–327. doi:10.1007/978-3-319-19617-6_22.
6. Goldman J.D., Julian K. Urinary tract infections in solid organ transplant recipients: Guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clinical Transplantation. 2019; 33 (9). doi:10.1111/ctr.13507.
7. Евлоева М.И., Арутюнова М.С., Северина А.С., и др. Хроническая болезнь почек у пациентов с длительным течением сахарного диабета 1 типа // Сахарный диабет. –2023. – Т. 26. – №6 – С. 504–514. [Evloeva M.I., Arutyunova M.S., Severina A.S., i dr. Xronicheskaya bolezn` pochek u pacientov s dlitel`ny`m techeniem saxarnogo diabeta 1 tipa. Saxarny`j diabet. 2023; 26 (6): 504–514. (In Russ).]. doi:10.14341/DM13108.
8. Черников А.А., Северина А.С., Шамхалова М.Ш., и др. Роль механизмов «метаболической памяти» в развитии и прогрессировании сосудистых осложнений сахарного диабета // Сахарный диабет. – 2017. – Т. 20. – № 2 – С. 126–134. doi:10.14341/7674.
9. Piani F., Melena I., Severn C., et al. Tubular injury in diabetic ketoacidosis: Results from the diabetic kidney alarm study. Pediatric Diabetes. 2021; 22 (7); 1031–1039. doi:10.1111/pedi.13259.
10. Melena I., Piani F., Tommerdahl K.L., et al. Aminoaciduria and metabolic dysregulation during diabetic ketoacidosis: Results from the diabetic kidney alarm (DKA) study. Journal of Diabetes and Its Complications. 2022; 36 (6). doi: 10.1016/j.jdiacomp.2022.108203.
11. de Boer I.H., Khunti K., Sadusky T., et al. Diabetes Management in Chronic Kidney Disease: A Consensus Report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Diabetes Care. 2022; 45 (12); 3075–3090. doi: 10.2337/dci22-0027.
12. Шестакова М.В., Шамхалова М.Ш., Ярек-Мартынова И.Я., и др. Сахарный диабет и хроническая болезнь почек: достижения, нерешенные проблемы и перспективы лечения // Сахарный диабет. – 2011. – Т. 14. – № 1 – С. 81–88 . doi:10.14341/2072-0351-6254
13. Галиев Ш.Р. Медикаментозная индукция иммуносупрессии и иммуносупрессивная терапия при трансплантации почки: Дис. докт. мед. наук. – Москва; 2024. Доступно по: https://transpl.ru/upload/medialibrary/6c9/6c9e9591e9508ae0e2fca010735f9f63.pdf. Ссылка активна на 01.06.2025
14. Lim K., Lee Y.J., Gwon J.G., et al. Impact of Donor Age on the Outcomes of Kidney Transplantation From Deceased Donors With Histologic Acute Kidney Injury. Transplantation Proceedings. 2019; 51(8); 2593–2597. doi: 10.1016/j.transproceed.2019.03.074.
15. Zachary A.A., Leffell M.S. HLA Mismatching Strategies for Solid Organ Transplantation – A Balancing Act. Frontiers in Immunology. 2016; 7. doi:10.3389/fimmu.2016.00575.
16. Sandal S., Ahn J.B., Segev D.L., et al. Comparing outcomes of third and fourth kidney transplantation in older and younger patients. American Journal of Transplantation. 2021; 21 (12); 4023–4031. doi: 10.1111/ajt.16786.
17. Matas A.J., Smith J.M., Skeans M.A., et al. OPTN/SRTR 2013 Annual Data Report: kidney. American Journal of Transplantation. 2015; 15 (2): 1–34.
18. US Renal Data System. USRDS 2007 Annual Data Report. Bethesda: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases; 2007.
19. Kramer A., Pippias M., Noordzij M., et al. Renal replacement therapy in Europe: a summary of the 2013 ERA-EDTA Registry Annual Report with a focus on diabetes mellitus. Clinical Kidney Journal. 2016; 9 (3): 457–469. doi: 10.1093/ckj/sfw031.
20. Eurotransplant International Foundation. Annual Report 2014. Leiden: Eurotransplant Foundation; 2015.
21. Сушков А.И. Повторная трансплантация почки // Вестник трансплантологии и искусственных органов. – 2016. – Т. 18. – № 4 – С. 157–169. doi: 10.15825/1995-1191-2016-4-157-169.
22. Argani H. Second and Third Kidney Transplants. Experimental and Clinical Transplantation. 2024; 22 (1); 60–65. doi: 10.6002/ect.MESOT2023.L45.
23. Бушма К. М., Спас В. В., Шапель И. А., и др. К вопросу о нефротоксичности аминогликозидов // Новости хирургии. – 2009. – №1.
24. Kim H.S., Kim J.Y., Kang E.J., et al. Immunologic and non-immunologic complications of a third kidney transplantation. Korean Journal of Internal Medicine. 2015; 30 (5); 657–664. doi: 10.3904/kjim.2015.30.5.657.
25. Telkes G., Piros L., Szabó J., et al. Outcomes of first versus third kidney transplantations: propensity score matching and paired subgroup analysis—a single-centre experience. Langenbeck's Archives of Surgery. 2021; 406 (3); 863–871. doi: 10.1007/s00423-020-02063-y.
26. Roth D, Gaynor JJ, Reddy KR, et al. Effect of kidney transplantation on outcomes among patients with hepatitis C. J Am Soc Nephrol. 2011;22(6):1152-60. doi: 10.1681/ASN.2010060668.
27. Yu TM, Lin CC, Shu KH, et al. Increased risk of hepatic complications in kidney transplantation with chronic virus hepatitis infection: A nationwide population-based cohort study. Sci Rep. 2016;19(6). doi: 10.1038/srep21312.
Об авторах
А. Н. ЗвягинцеваРоссия
Звягинцева Анастасия Николаевна
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Д. В. Иванова
Россия
Иванова Дарья Вячеславовна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
А. С. Северина
Россия
Северина Анастасия Сергеевна, к.м.н., в.н.с.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
О. Ю. Сухарева
Россия
Сухарева Ольга Юрьевна, к.м.н., доцент
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
М. Ш. Шамхалова
Россия
Шамхалова Минара Шамхаловна, д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Данные непрерывного мониторирования уровня глюкозы при поступлении. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(750KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Данные непрерывного мониторирования уровня глюкозы после трансплантации почки. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(787KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Динамика основных лабораторных показателей. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(925KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Звягинцева А.Н., Иванова Д.В., Северина А.С., Сухарева О.Ю., Шамхалова М.Ш. Повторная трансплантация почки у пациентки с сахарным диабетом 1 типа и хроническим пиелонефритом: клинический случай. Сахарный диабет. 2025;28(5):480-486. https://doi.org/10.14341/DM13393
For citation:
Zvyagintseva A.N., Ivanova D.V., Severina A.S., Sukhareva O.Y., Shamkhalova M.S. Repeat kidney transplantation in a patient with type 1 diabetes mellitus and chronic pyelonephritis: a clinical case. Diabetes mellitus. 2025;28(5):480-486. (In Russ.) https://doi.org/10.14341/DM13393

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































