Перейти к:
Повторный набор веса и отдаленный рецидив сахарного диабета 2 типа после его ремиссии вследствие бариатрических вмешательств — кто в зоне риска?
https://doi.org/10.14341/DM13348
Аннотация
ОБОСНОВАНИЕ. Бариатрические операции (БО) — один из наиболее эффективных методов лечения морбидного ожирения и часто сопутствующего ему сахарного диабета 2 типа (СД2). Около 80% пациентов не только снижают вес после БО, но и достигают ремиссии СД2. Тем не менее, в отдаленном периоде у части пациентов отмечается повторный набор веса и рецидив СД2.
ЦЕЛЬ. Определить факторы риска повторного набора веса и отдаленного рецидива СД2 после его ремиссии вследствие БО.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование были включены 111 пациентов с ожирением и СД2, которым была проведена БО одного из типов: продольная резекция желудка/гастрошунтирование/билиопанкреатическое шунтирование в модификации SADI или DS через ≥5 лет после БО. Критерии ремиссии СД2 включали: удержание уровня гликированного гемоглобина (HbA1c) ≤6,5% и уровня глюкозы плазмы натощак менее 7,0 ммоль/л не менее, чем 3 месяца после отмены сахароснижающей терапии. За стабильное удержание массы тела принималась ее прибавка <10 кг от минимального значения после БО.
РЕЗУЛЬТАТЫ. Пациенты были дважды разделены на группы: со стабильным удержанием достигнутого веса (группа 1) и с набором веса ≥10 кг от минимально достигнутого веса после БО (группа 2); с ремиссией СД2 (группа 3) и с рецидивом/отсутствием ремиссии СД2 (группа 4). Статистически значимых различий по дооперационным клинико-лабораторным характеристикам между группой 1 и группой 2 выявлено не было. До операции в группе 4 в сравнении с группой 3 отмечались более высокие значения HbA1c (8,70% [7,4; 10,1] против 7,45% [6,4; 8,3], p<0,001), более низкие уровни иммунореактивного инсулина (ИРИ) (12,70 мкМЕ/мл [9,39; 17,70] против 28,1 мкМЕ/мл [20,5; 33,3], p<0,001), и С-пептида (3,01 нг/мл [2,19; 4,66] против 4,7 нг/мл [4,0; 5,5], p<0,001). В группе 4 длительность диабета была больше (9,0 лет [6,0; 12,0] против 4,0 лет [2,0; 9,0], p<0,001), и чаще назначалась инсулинотерапия и многокомпонентная саха роснижающая терапия.
ЗАКЛЮЧЕНИЕ. Факторы риска отдаленного рецидива СД2 после БО включают: большую длительность СД2, более высокие уровни HbA1c и более низкие значения ИРИ, С-пептида до операции, инсулинотерапию и многокомпонентную сахароснижающую терапию. Значимой связи между рецидивом СД2 и повторным набором веса, а также их взаи мосвязи с типом БО выявлено не было, что требует дальнейшего изучения.
Ключевые слова
Для цитирования:
Вознесенская А.А., Першина-Милютина А.П., Аредов А.В., Рожевская Е.Е., Томилова А.О., Шестакова Е.А., Синеокая М.С., Ершова Е.В., Стафеев Ю.С., Яшков Ю.И., Шестакова М.В. Повторный набор веса и отдаленный рецидив сахарного диабета 2 типа после его ремиссии вследствие бариатрических вмешательств — кто в зоне риска? Сахарный диабет. 2025;28(5):404-415. https://doi.org/10.14341/DM13348
For citation:
Voznesenskaya A.A., Pershina-Miliutina A.P., Aredov A.V., Rozhevskaya E.E., Tomilova A.O., Shestakova E.A., Sineokaya M.S., Ershova E.V., Stafeev Y.S., Yashkov Y.I., Shestakova M.V. Weight regain and type 2 diabetes relapse in the long-term period after bariat ric surgery — who is at risk? Diabetes mellitus. 2025;28(5):404-415. (In Russ.) https://doi.org/10.14341/DM13348
ОБОСНОВАНИЕ
Бариатрические операции (БО) —наиболее эффективные методы лечения морбидного ожирения и часто сопутствующего ему сахарного диабета 2 типа (СД2). Хорошо известно, что развитие бариатрической хирургии позволило ввести понятие «ремиссии» СД2 как достижения компенсации этого заболевания в отсутствие сахароснижающей терапии. В то же время, по существующим данным, до 49% больных сталкиваются с повторным набором веса [1], и до 20% отмечают «рецидив» СД2 после его ремиссии вследствие БО в отдаленном периоде (>5–10 лет после БО) [2]. Одним из крупнейших проспективных исследований, посвященных отдаленным результатам после БО, является Шведское исследование пациентов с ожирением (SOS). В нем приняли участие 2010 пациентов с ожирением, которым выполнялось гастрошунтирование с межкишечным анастомозом по Ру (13%), бандажирование желудка (19%) или вертикальная гастропластика (68%). Период наблюдения составил до 20 лет после БО. В трех подгруппах после БО средний процент снижения массы тела был максимальным через 1–2 года наблюдения. Повторный набор веса наблюдался во всех трех хирургических подгруппах в последующие годы, через 2 года наблюдения, когда исследователи фиксировали «лучшие» результаты в снижении веса, 72% пациентов с исходным СД2 в группе БО достигли ремиссии диабета. Однако через 10 лет после БО у 50% пациентов, достигших ремиссии диабета в течение первых 2 лет, отмечался рецидив СД2 (в хирургической группе 72% в ремиссии через 2 года против 36% в ремиссии через 10 лет) [3].
В то же время важно отметить, что вертикальная гастропластика и бандажирование желудка, которые проводились в рамках исследования SOS, в настоящее время практически не применяются, на смену им пришли продольная резекция желудка (ПРЖ), различные модификации гастрошунтирования (ГШ) и билиопанкреатического шунтирования (БПШ). В свою очередь, БПШ демонстрирует значительно более устойчивые результаты как в отношении массы тела, так и долгосрочной ремиссии СД2 [4]. Так, по данным исследования Süsstrunk J. и соавт., включавшем 116 пациентов, с длительностью наблюдения до 20 лет после БПШ, средний процент потери избыточной массы тела (%EWL) через 5, 10 и 14 лет после БПШ составил 78%±24,1%, 76,5%±26,7% и 77,8%±33,8 соответственно [5]. По данным Kapeluto J.E. с соавт. (2020), через 10 лет после БПШ в модификации Duodenal switch (DS) у 90 пациентов из 132 (68,1%) отмечалась полная ремиссия СД2, у 3 (2,3%) зарегистрирована частичная ремиссия, у 21 (15,9%) — улучшение контроля гликемии и у 3 (2,3%) — отсутствие изменения гликемического статуса, при этом рецидив СД2 после первоначально достигнутой ремиссии развился у 15 (11,4%) пациентов [6].
Таким образом, с течением времени после различных бариатрических вмешательств у части пациентов в той или иной степени отмечается как повторный набор веса, так и рецидив СД2 после его первоначальной ремиссии. Отдельный интерес многих исследователей вызывает поиск потенциальных предикторов повторного возврата веса и СД2 через несколько лет после БО.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью нашей работы стало определение факторов риска повторного набора веса и отдаленного рецидива СД2 после его ремиссии вследствие БО через 5 и более лет после различных видов операций.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Набор пациентов проводился на базе ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России. Хирургические вмешательства проводились в следующих учреждениях: ГНЦ РФ ФГБУ «НМИЦ эндокринологии», ЗАО «Центр эндохирургии и литотрипсии». Все лабораторные и инструментальные исследования были проведены на базе лаборатории клэмп-технологий ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
В исследование были включены 111 пациентов с ожирением и исходным СД2, которым в период с 2004 по 2019 гг. была проведена БО одного из четырех типов. Общая медиана периода динамического наблюдения составила 7,2 года [ 5,1; 10,8], минимальный период наблюдения — 5 лет, максимальный — 18 лет. Медиана периода динамического наблюдения после ПРЖ составила 6,24 года [ 5,45; 7,62], после ГШ — 5,0 лет [ 5,0; 5,04], после БПШ в модификации SADI — 7,06 года [ 5,6; 8,6], после БПШ в модификации DS — 10,88 года [ 8,72; 13,32].
Критерии включения в исследование:
- подписанное добровольное информированное согласие;
- пациенты обоих полов;
- пациенты старше 18 лет;
- код диагноза МКБ-10: E11;
- проведенная БО в анамнезе ≥5 лет до начала исследования.
Критерии исключения из исследования:
- беременные пациентки;
- СД1 и другие специфические типы СД;
- наличие клинической картины острой декомпенсации углеводного обмена;
- пациенты с тяжелыми соматическими/психическими заболеваниями, состояниями.
Дизайн исследования:
одноцентровое, динамическое, ретроспективное.
Описание медицинского вмешательства
Всем пациентам в анамнезе (не менее 5 лет до настоящего исследования) проводилось бариатрическое лечение. Вид операции был согласован между пациентом и бариатрическим хирургом. Проведен анализ данных архивов медицинских учреждений, на базе которых были выполнены БО, с оценкой исходных лабораторных показателей, антропометрических характеристик пациентов, анамнестических сведений. Через 5 и более лет после БО повторно проводилась оценка антропометрических показателей и лабораторное обследование пациентов.
Определение ремиссии сахарного диабета 2 типа
В качестве критериев ремиссии СД2 использовались следующие: отмена сахароснижающей терапии и удержание HbA1c≤6,5 % не менее, чем 3 месяца после ее отмены, уровень глюкозы плазмы натощак менее 7,0 ммоль/л при наличии факторов, искажающих уровень лабораторно измеренного HbA1c [7].
Определение стабильного удержания массы тела
В качестве критерия удержания массы тела принималась ее прибавка <10 кг от минимально достигнутой после БО [8].
Методы
Определение антропометрических показателей
Для всех пациентов проведено антропометрическое исследование (измерение роста, веса) с расчетом ИМТ и процента снижения избыточной массы тела (% EWL).
- Рост и вес измеряли утром натощак с помощью ростомера и весов.
- Расчет ИМТ проводился по формуле отношения массы тела в килограммах к квадратному значению роста, выраженному в метрах (кг/м²).
- Процент снижения избыточной массы тела (%EWL) рассчитывался по формуле: (вес до операции-текущий вес)/(вес до операции-«идеальный вес»)х100%, где идеальный вес=25х рост, (м²).
Оценка композиционного состава тела
С целью оценки композиционного состава тела проводилась биоимпедансометрия. Оценивалось содержание жира в организме (%), а также площадь висцерального жира (см²). Исследование проводилось натощак: пациент вставал босиком на блок анализатора (InBody 770, Korea).
Определение лабораторных показателей
HbA1c, глюкоза сыворотки и липидный спектр (общий холестерин, триглицериды) оценивались натощак. Определение в сыворотке крови уровня глюкозы и показателей липидного спектра проводили на биохимическом анализаторе Architect c4000 («Abbott Diagnostics», «Abbott Park», IL, США) стандартными наборами производителя. HbA1c определяли методом высокоэффективной жидкостной хроматографии на анализаторе D10 (Bio Rad); метод сертифицирован NGSP (The National Glycohemoglobin Standartization Program). Иммунореактивный инсулин (ИРИ), С-пептид определяли в сыворотке крови на электрохемилюминесцентном анализаторе Cobas 6000 (Roche, Швейцария) стандартными наборами.
Статистический анализ
Статистическая обработка проводилась с помощью программы Statistica 13.3. Распределения количественных признаков представлены в виде медиан и межквартильного интервала (1 и 3 квартили) — Me [ Q1; Q3]. Качественные данные представлены в виде абсолютных (n) и относительных (%) частот. Для межгрупповых различий по количественным признакам для независимых выборок использовались критерии Манна-Уитни и критерий Краскела-Уоллиса. Для межгрупповых сравнений по качественным признакам использовались двусторонний точный критерий Фишера и критерий Фишера-Фримана-Холтона. Для поиска отрезных точек использовали ROC-анализ. Отрезная точка выбиралась с помощью критерия Юдена. Для оценки диагностической способности отрезной точки рассчитывали диагностическую чувствительность (ДЧ), диагностическую специфичность (ДС), прогностическую ценность положительного результата и отрицательного результатов (ПЦПР, ПЦОР) с 95% доверительными интервалами (ДИ). Статистически значимым признавали уровень ошибки первого рода менее 5% (p<0,05). Для коррекции проблемы множественных сравнений применялась поправка Бонферрони, после чего значения р в диапазоне между рассчитанным и 0,05 интерпретировались как статистическая тенденция.
Этическая экспертиза
Проведение исследования одобрено локальным этическим комитетом ГНЦ РФ ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России (выписка из протокола №14 от 29.07.2022). Все пациенты, включенные в исследование, подписывали информированное согласие.
РЕЗУЛЬТАТЫ
Характеристика пациентов
В исследование были включены 111 пациентов с ожирением и исходным СД2 (26 мужчин (23%), 85 женщин (77%), медиана возраста на момент проведения БО составила 49,6 года [ 42,8; 54,5]. Всем пациентам в период с 2004 по 2019 гг. была проведена БО: 13 пациентам (12%) — ПРЖ, 28 пациентам (25%) — ГШ, 70 пациентам (63%) — БПШ: 32 пациентам (29%) — в модификации SADI, 38 пациентам (34%) — в модификации DS.
Исходные характеристики пациентов представлены в виде медианных значений и межквартильных интервалов. Масса тела пациентов перед БО составляла 130 кг [ 113; 149], ИМТ перед БО — 46,19 кг/м² [ 41,09; 51,95]. Длительность СД2 до БО составляла 5,8 лет [ 2,57; 10,38], уровень HbA1c до БО — 7,7% [ 6,8; 8,9]. До проведения операции у 32 (29%) пациентов в качестве сахароснижающей терапии была монотерапия, у 41 (37%) — комбинация препаратов, 21 (19%) пациентов получали инсулинотерапию, 17 (15%) пациентов не получали никакой терапии.
Все пациенты были разделены на группы по одному из двух критериев: группа со стабильным удержанием достигнутого веса (группа 1) и группа с повторным набором веса после БО (группа 2); группа с ремиссией СД2 (группа 3) и группа с рецидивом/отсутствием ремиссии СД2 (группа 4).
Сравнение пациентов со стабильным удержанием достигнутого веса и повторным набором массы тела через 5 и более лет после БО
При сравнении динамики веса, ИМТ и процента снижения избыточной массы тела между различными типами операций было выявлено, что показатели ИМТ до операции и в динамике статистически значимо не различались при разных типах БО, за исключением минимального значения ИМТ, который на уровне статистической тенденции был меньше после БПШ/DS в сравнении с ПРЖ (25,43 [ 23,38; 29,41] кг/м² против 31,17 [ 27,64; 32,42], p=0,057). Процент потери избыточной массы тела (% EWL) был статистически значимо выше в группах БПШ/SADI 78,2 [ 62,2; 89,4]%, p<0,05) и БПШ/DS (72,8 [ 64,2; 83,0]%, p<0,05) в сравнении с ПРЖ (48,7 [ 39,9; 74,7]%).
У 54 пациентов (48,6%) (группа 1) отсутствовал значимый повторный набора веса в сравнении с группой 2, при этом 36-ти из них было выполнено БПШ (18-ти — в модификации SADI, 18-ти — в модификации DS), 12-ти — ГШ, 6-ти — ПРЖ. На на рис. 1 (а, б) представлены графики, отражающие динамику ИМТ в группе стабильного удержания веса и повторного набора веса в зависимости от типа БО.
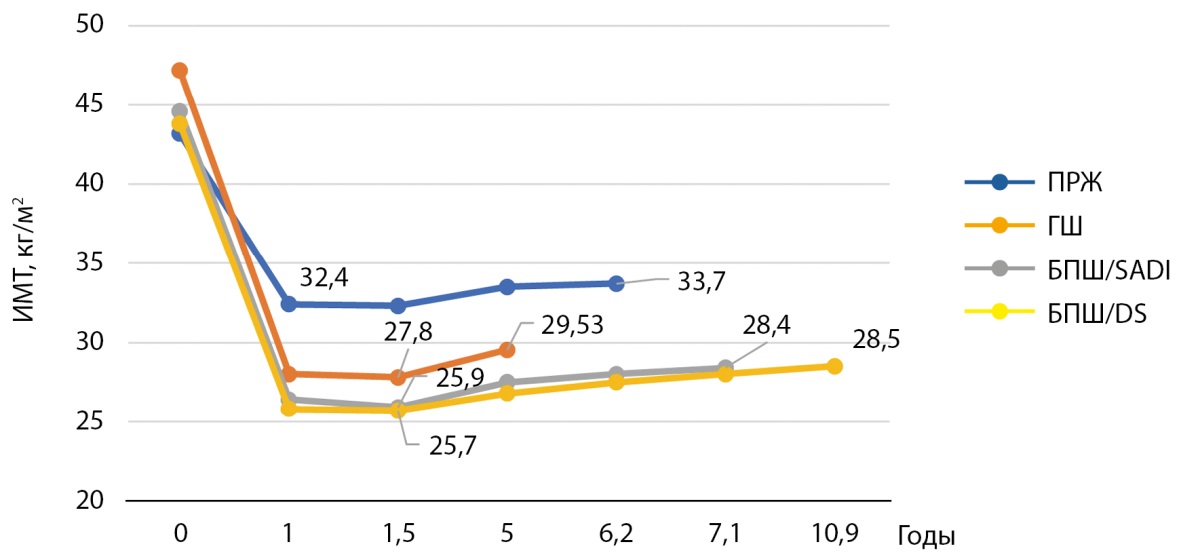
Рисунок 1 (а). Динамика индекса массы тела в группе стабильного удержания веса после бариатрической операции.
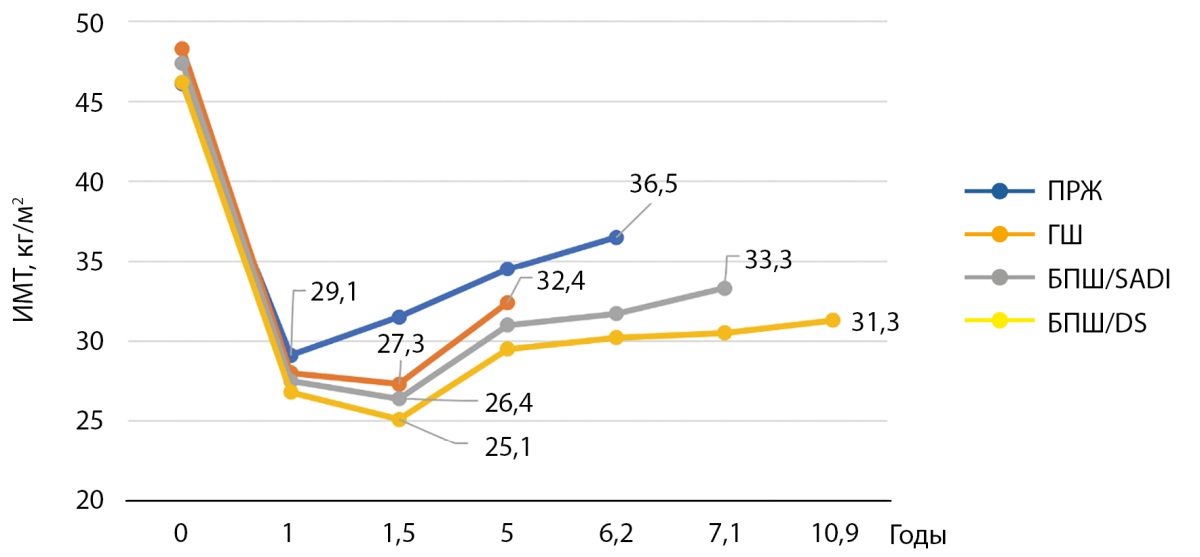
Рисунок 1 (б). Динамика индекса массы тела в группе повторного набора веса после бариатрической операции.
При сравнении ряда до- и послеоперационных клинико-лабораторных характеристик, включая тип проведенных операций, пациентов группы 1 и группы 2 статистически значимых различий выявлено не было, за исключением долгосрочных показателей ИМТ и %EWL, которые были ожидаемо хуже в группе 2. Также на уровне статистической тенденции были выявлены большие значения площади висцерального жира после БО в группе повторного набора веса (табл. 1).
Таблица 1. Сравнительная характеристика пациентов со стабильным удержанием достигнутого веса (группа 1) и повторным набором массы тела (группа 2) через 5 и более лет после бариатрической операции
|
Показатель |
Группа 1, |
Группа 2, |
p |
|||
|
N |
Me [ Q1; Q3]/n (%) |
N |
Me [ Q1; Q3]/n (%) |
|||
|
Пол |
Мужской |
54 |
14 (26) |
57 |
12 (21) |
0,660³ |
|
Возраст на момент проведения БО, лет |
54 |
51,5 [ 45,8; 56,4] |
57 |
46,9 [ 41,0; 53,3] |
0,020¹ |
|
|
Тип БО |
ПРЖ |
54 |
6 (11,1) |
57 |
7 (12) |
0,775² |
|
ГШ |
12 (22,2) |
16 (28) |
||||
|
SADI |
18 (33,3) |
14 (25) |
||||
|
DS |
18 (33,3) |
20 (35) |
||||
|
Max ИМТ до БО, кг/м² |
54 |
48,6 [ 42,3; 56,8] |
57 |
49,7 [ 45,7; 54,9] |
0,285¹ |
|
|
ИМТ перед БО, кг/м² |
54 |
45,1 [ 39,9; 53,0] |
57 |
46,7 [ 42,7; 51,2] |
0,275¹ |
|
|
Min ИМТ после БО, кг/м² |
54 |
27,0 [ 25,0; 30,1] |
57 |
26,9 [ 23,8; 30,3] |
0,594¹ |
|
|
Срок достижения минимальной массы тела после БО, лет |
53 |
1,5 [ 1,0; 2,0] |
57 |
1,5 [ 1,0; 1,5] |
0,2¹ |
|
|
ИМТ ≥ 5 лет после БО, кг/м² |
54 |
28,7 [ 26,5; 31,0] |
57 |
32,9 [ 29,4; 37,6] |
<0,001¹ |
|
|
EWL ≥ 5 лет после БО, % |
54 |
79,4 [ 64,2; 90,4] |
57 |
65,3 [ 47,4; 75,0] |
<0,001¹ |
|
|
Площадь висцерального жира до БО, см² |
5 |
240 [ 210; 250] |
11 |
270 [ 200; 330] |
0,510¹ |
|
|
Содержание жира в организме до БО, % |
5 |
47,5 [ 40,2; 48,2] |
11 |
42,9 [ 38,2; 48,7] |
1,0¹ |
|
|
Площадь висцерального жира ≥ 5 лет после БО, см² |
5 |
134,5 [ 130,2; 139,1] |
11 |
199,1 [ 150,9; 222,8] |
0,005¹ |
|
|
Содержание жира в организме ≥ 5 лет после БО, % |
5 |
40,0 [ 39,0; 43,5] |
11 |
39,4 [ 38,2; 48,7] |
0,827¹ |
|
|
Длительность послеоперационного периода, лет |
54 |
7,6 [ 5,3; 9,9] |
57 |
6,8 [ 5,1; 10,8] |
0,834¹ |
|
Примечание: данные представлены в виде медианы и интерквартильного размаха [ Q1; Q3]. Поправка Бонферрони: р0- 0,05/22=0,002; ¹критерий Манна-Уитни; ²критерий Фишера-Фримена-Холтона; ³ — точный критерий Фишера; DS — билиопанкреатическое шунтирование в модификации DS (Duodenal switch); EWL — процент снижения избыточной массы тела; SADI — билиопанкреатическое шунтирование в модификации SADI (Single Anastomosis Duodeno-Ileal); БО — бариатрическая операция; ГШ — гастрошунтирование; ИМТ — индекс массы тела; ПРЖ — продольная резекция желудка.
Сравнение пациентов с длительной ремиссией и рецидивом СД2 после первоначальной ремиссии/отсутствием ремиссии СД2 через 5 и более лет после БО
Ремиссии СД2 в периоде 5–18 лет после операции достигли 80 человек (72%), у 20 пациентов (18%) выявлен рецидив СД2 после первоначально достигнутой ремиссии вследствие БО (медиана периода сохранения ремиссии составила 5,0 лет [ 2,0; 8,5]), у 11 (10%) пациентов ремиссия СД2 за период наблюдения не наступала. Отдельный интерес представляло для нас сравнение пациентов в зависимости от развития рецидива/достижения и поддержания ремиссии СД2. Все пациенты были разделены на 2 группы по данному критерию: ремиссия СД2 (группа 3) и рецидив/отсутствие ремиссии СД2 (группа 4) (табл. 2).
Таблица 2. Сравнительная характеристика пациентов с длительной ремиссией (группа 3) и рецидивом сахарного диабета 2 типа (группа 4) после первоначальной ремиссии/отсутствия ремиссии сахарного диабета 2 типа через 5 и более лет после бариатрической операции
|
Признаки |
Группа 3, |
Группа 4, |
p |
|||
|
N |
Me [ Q1; Q3] / n (%) |
N |
Me [ Q1; Q3] / n (%) |
|||
|
Пол |
Мужской |
80 |
20 (25) |
31 |
6 (19,4) |
0,782² |
|
Тип БО |
ПРЖ |
80 |
8 (10) |
31 |
5 (16,1) |
0,815³ |
|
ГШ |
21 (26,3) |
7 (22,6) |
||||
|
SADI |
24 (30) |
8 (25,8) |
||||
|
DS |
27 (33,8) |
11 (35,5) |
||||
|
Возраст на момент проведения БО, лет |
80 |
49 [ 41; 54] |
31 |
52 [ 45; 56] |
0,093¹ |
|
|
Длительность периода после БО, лет |
80 |
7 [ 5; 10] |
31 |
8 [ 5; 11] |
0,735¹ |
|
|
Артериальная гипертензия |
80 |
75 (93,8) |
31 |
26 (83,9) |
0,139² |
|
|
Дислипидемия |
80 |
63 (78,8) |
31 |
23 (74,2) |
0,619² |
|
|
Наследственность по ожирению и СД2 |
80 |
71 (88,8) |
31 |
23 (74,2) |
0,077² |
|
|
Длительность СД2 до БО, лет |
80 |
4 [ 2; 9] |
31 |
9 [ 6; 12] |
<0,001¹ |
|
|
Терапия с инсулином/без |
С инсулином |
80 |
7 (8,8) |
31 |
14 (45,2) |
<0,001³ |
|
Без инсулина |
57 (71,3) |
16 (51,6) |
||||
|
Отсутствие терапии |
16 (20) |
1 (3,2) |
||||
|
Количество сахароснижающих препаратов до БО |
80 |
1 [ 1; 2] |
31 |
2 [ 2; 3] |
<0,001¹ |
|
|
Лабораторные показатели до БО: |
||||||
|
HbA1c, % |
80 |
7,45 [ 6,40; 8,30] |
31 |
8,7 [ 7,4; 10,1] |
<0,001¹ |
|
|
ИРИ, мкМЕ/мл |
49 |
28,10 [ 20,54; 3,30] |
17 |
12,70 [ 9,39; 17,70] |
<0,001¹ |
|
|
С-пептид, нг/мл |
53 |
4,72 [ 4,06; 5,51] |
20 |
3,01 [ 2,19; 4,66] |
<0,001¹ |
|
|
Глюкоза плазмы, ммоль/л |
20 |
8,58 [ 7,30; 10,03] |
11 |
9,1 [ 8,1; 11,8] |
0,197¹ |
|
|
Холестерин общий, ммоль/л |
22 |
5,50 [ 4,86; 6,30] |
10 |
6,20 [ 5,07; 6,60] |
0,534¹ |
|
|
Триглицериды, ммоль/л |
22 |
2,50 [ 1,54; 3,30] |
10 |
3,60 [ 2,33; 4,13] |
0,090¹ |
|
|
Лабораторные показатели через 5 и более лет после БО: |
||||||
|
HbA1c, % |
80 |
5,3 [ 4,9; 5,7] |
31 |
6,7 [ 6,2; 7,9] |
<0,001¹ |
|
|
Глюкоза плазмы, ммоль/л |
37 |
4,95 [ 4,60; 5,44] |
13 |
7,80 [ 6,10; 8,81] |
<0,001¹ |
|
|
C-пептид, нг/мл |
37 |
2,33 [ 2,01; 2,63] |
13 |
2,28 [ 1,92; 2,73] |
0,950¹ |
|
|
ИРИ, мкМЕ/мл |
37 |
10,16 [ 7,70; 12,70] |
13 |
6,4 [ 5,6; 13,8] |
0, 334¹ |
|
|
Холестерин общий, ммоль/л |
37 |
4,35 [ 3,65; 5,09] |
13 |
4,41 [ 3,20; 5,20] |
0,680¹ |
|
|
Триглицериды, ммоль/л |
37 |
0,9 [ 0,7; 1,3] |
13 |
1,3 [ 1,0; 1,5] |
0,030¹ |
|
Примечание: данные представлены в виде медианы и интерквартильного размаха [ Q1; Q3]. Поправка Бонферрони: p0=0,05/31=0,002; 1 — критерий Манна-Уитни; 2 — точный критерий Фишера; 3 — критерий Фишера-Фримена-Холтона; DS — билиопанкреатическое шунтирование в модификации DS (Duodenal switch); HbA1c — гликированный гемоглобин; SADI — билиопанкреатическое шунтирование в модификации SADI (Single Anastomosis Duodeno-Ileal); БО — бариатрическая операция; ГШ — гастрошунтирование; ИРИ — иммунореактивный инсулин; ПРЖ — продольная резекция желудка; СД2 — сахарный диабет 2 типа.
Статистически значимых различий в группах 3 и 4 по типам операций, большинству антропометрических и клинико-лабораторных характеристик выявлено не было. По данным исследования, у пациентов группы 4 выявлены более высокие исходные значения гликированного гемоглобина и более низкие исходные уровни ИРИ и С-пептида в сравнении с пациентами группы 3. Уровень ИРИ не оценивался у пациентов, получающих инсулинотерапию. Кроме того, именно в группе 4 отмечалась большая длительность СД2 до операции, а также чаще назначалась инсулинотерапия, а общее количество принимаемых препаратов было выше, чем в группе 3. В целом, долгосрочное послеоперационное наблюдение демонстрирует сопоставимые результаты по антропометрическим и большинству клинико-лабораторных характеристик среди пациентов двух групп при ожидаемо более низких уровнях глюкозы плазмы натощак и HbA1c в группе 3. Также на уровне статистической тенденции в группе 3 выявлены более низкие уровни триглицеридов (см. табл. 2).
Расчет отрезных точек для факторов риска рецидива СД2
Далее выполнен поиск отрезной точки для факторов риска отдаленного рецидива СД2. Для поиска отрезных точек был выполнен ROC-анализ с построением ROC-кривых и расчетом критерия Юдена (табл. 3, 4). Площадь под ROC-кривой в случае показателей длительности СД2 и уровня HbA1c была больше для прогноза рецидива/отсутствия ремиссии СД2 в случае значений базального инсулина, С-пептида- для прогноза ремиссии СД2.
Таблица 3. Результаты ROC-анализа достоверных предикторов рецидива сахарного диабета 2 типа после его ремиссии вследствие бариатрической операции/отсутствия ремиссии сахарного диабета 2 типа через 5 и более лет после бариатрического вмешательства
|
Параметр, точка разделения (cut-off) |
ДЧ, % |
ДС, % |
Площадь под кривой (AUC) |
ПЦПР, % |
ПЦОР, % |
|
Длительность СД2≥6,5 лет |
71,0 [ 54,6; 84,1] |
67,5 [ 61,1; 72,6] |
0,719 [ 0,618; 0,819] |
45,8 [ 35,2; 54,3] |
85,7 [ 77,6; 92,2] |
|
HbA1c≥8,14% |
64,5 [ 48,2; 78,4] |
73,8 [ 67,4; 79,1] |
0,725 [ 0,618; 0,832] |
48,8 [ 36,5; 59,3] |
84,3 [ 77,1; 90,4] |
Примечание: HbA1c — гликированный гемоглобин; ДС — диагностическая специфичность; ДЧ — диагностическая чувствительность; ПЦОР — прогностическая ценность отрицательного результата; ПЦПР — прогностическая ценность положительного результата; СД2 — сахарный диабет 2 типа. Данные, указанные в квадратных скобках, отражают 95% ДИ (доверительный интервал).
Таблица 4. Результаты ROC-анализа достоверных предикторов ремиссии сахарного диабета 2 типа через 5 и более лет после бариатрического вмешательства
|
Параметр, точка разделения (cut-off) |
ДЧ, % |
ДС, % |
Площадь под кривой (AUC) |
ПЦПР, % |
ПЦОР, % |
|
ИРИ≥18,85 мкМЕ/мл |
83,7 [ 76,0; 88,0] |
82,4 [ 60,1; 95,0] |
0,880 [ 0,793; 0,967] |
93,2 [ 84,6; 98,1] |
63,6 [ 46,5; 73,4] |
|
C-пептид≥3,175 нг/мл |
90,6 [ 83,3; 95,8] |
60,0 [ 40,8; 74,0] |
0,744 [ 0,612; 0,876] |
85,7 [ 78,8; 90,7] |
70,6 [ 48,0; 87,0] |
Примечание: ДС — диагностическая специфичность; ДЧ — диагностическая чувствительность; ИРИ — иммунореактивный инсулин; ПЦОР — прогностическая ценность отрицательного результата; ПЦПР — прогностическая ценность положительного результата. Данные, указанные в квадратных скобках, отражают 95% ДИ (доверительный интервал).
Площадь под ROC-кривой в случае показателей длительности СД2 и уровня HbA1c была больше для прогноза рецидива/отсутствия ремиссии СД2, в случае значений ИРИ, С-пептида — для прогноза ремиссии СД2, т.е. длительность СД2≥6,5 лет, уровень HbA1c≥ 8,14% служили предикторами рецидива СД2, а уровень ИРИ≥18,85 мкМЕ/мл и уровень С-пептида ≥3,175 нг/мл — предикторами ремиссии СД2.
Связь динамики веса и метаболического статуса пациентов после БО
Дополнительно был проведен анализ данных для оценки взаимосвязи динамики массы тела пациентов и риска рецидива СД2 после его ремиссии вследствие БО.
Значимых различий по длительности СД2 до БО, уровням HbA1c до и через 5 и более лет после БО, С-пептида, ИРИ, показателям липидного профиля до БО, а также по частоте ремиссии/рецидива СД2 между группами со стабильным удержанием веса и его повторным набором выявлено не было (табл. 5).
Таблица 5. Сравнение группы стабильного удержания веса (группа 1) с группой повторного набора веса (группа 2) по показателям метаболического статуса пациентов
|
Показатель |
Группа 1, |
Группа 2, |
p |
|||
|
N |
Me [ Q1; Q3]/n (%) |
N |
Me [ Q1; Q3]/n (%) |
|||
|
Длительность СД2 до БО, лет |
54 |
6,2 [ 2,7; 11,2] |
57 |
4,4 [ 1,9; 8,8] |
0,080¹ |
|
|
HbA1c до БО, % |
54 |
7,7 [ 6,6; 9,0] |
57 |
7,8 [ 6,9; 8,5] |
0,674¹ |
|
|
HbA1c≥5 лет после БО, % |
54 |
5,5 [ 5,0; 6,1] |
57 |
5,6 [ 5,2; 6,2] |
0,482¹ |
|
|
С-пептид до БО, нг/мл |
36 |
4,5 [ 2,3; 5,2] |
37 |
4,7 [ 3,6; 5,4] |
0,141¹ |
|
|
ИРИ до БО, мкМЕ/мл |
31 |
25,50 [ 12,8; 34,5] |
34 |
24,3 [ 18,3; 30,0] |
0,719¹ |
|
|
Холестерин общий до БО, ммоль/л |
13 |
5,74 [ 4,86; 6,29] |
19 |
5,71 [ 5,05; 6,62] |
0,940¹ |
|
|
Триглицериды до БО, ммоль/л |
13 |
2,33 [ 1,72; 3,54] |
19 |
2,8 [ 1,65; 3,95] |
0,570¹ |
|
|
Метаболический статус (текущий) |
рецидив/отсутствие ремиссии СД2 |
54 |
14 (26) |
57 |
17 (30) |
0,677³ |
|
ремиссия СД2 |
40 (74) |
40 (70) |
||||
Примечание: данные представлены в виде медианы и интерквартильного размаха [ Q1; Q3]. Поправка Бонферрони: р0- 0,05/22=0,002; 1 — критерий Манна-Уитни; 2 — критерий Фишера-Фримена-Холтона; 3 — точный критерий Фишера; HbA1c — гликированный гемоглобин; БО — бариатрическая операция; ИРИ — иммунореактивный инсулин; СД2 — сахарный диабет 2 типа.
Через 5 и более лет после БО на уровне статистической тенденции (%EWL) был больше в группе ремиссии СД2. При этом значимого различия по антропометрическим характеристикам до и после БО и по частоте повторного набора веса между группами ремиссии и рецидива/отсутствия ремиссии СД2 выявлено не было (табл. 6).
Таблица 6. Сравнение группы ремиссии (группа 3) и рецидива/отсутствия ремиссии сахарного диабета 2 типа (группа 4) по антропометрическим характеристикам
|
Признаки |
Группа 3, |
Группа 4, |
p |
||
|
N |
Me [ Q1; Q3] / n (%) |
N |
Me [ Q1; Q3] / n (%) |
||
|
ИМТ перед БО, кг/м² |
80 |
46,6 [ 42,4; 51,7] |
31 |
44,2 [ 37,8; 53,0] |
0,147¹ |
|
Мin ИМТ после БО, кг/м² |
80 |
26,9 [ 24,8; 29,0] |
31 |
27,1 [ 23,8; 33,2] |
0,365¹ |
|
ИМТ≥5 лет после БО, кг/м² |
80 |
30,4 [ 28,0; 33,9] |
31 |
31,2 [ 27,7; 38,3] |
0,161¹ |
|
EWL≥5 лет после БО, % |
80 |
74,8 [ 63,4; 86,4] |
31 |
61,0 [ 50,1; 80,5] |
0,029¹ |
|
Площадь висцерального жира до БО, см² |
11 |
240 [ 190; 280] |
5 |
300 [ 240; 360] |
0,090¹ |
|
Содержание жира в организме до БО, % |
11 |
45,2 [ 39,4; 48,4] |
5 |
42,1 [ 42,0; 47,5] |
0,910¹ |
|
Площадь висцерального жира ≥ 5 лет после БО, см² |
11 |
194,9 [ 141,5; 222,8] |
5 |
134,5 [ 130,2; 158,5] |
0,100¹ |
|
Содержание жира в организме ≥ 5 лет после БО, % |
11 |
39,4 [ 38,4; 45,9] |
5 |
40,0 [ 34,4; 47,5] |
0,910¹ |
|
Повторный набор веса, % |
80 |
40 (50) |
31 |
17 (55) |
0,677² |
Примечание: данные представлены в виде медианы и интерквартильного размаха [ Q1; Q3]. Поправка Бонферрони: p0=0,05/31=0,002, 1 — критерий Манна-Уитни; 2 — точный критерий Фишера; 3 — критерий Фишера-Фримена-Холтона; EWL — процент снижения избыточной массы тела; БО — бариатрическая операция; ИМТ — индекс массы тела; СД2 — сахарный диабет 2 типа.
ОБСУЖДЕНИЕ
Повторный набор веса после БО
Наше исследование показало, что около половины (48,6%) всех пациентов демонстрировало отсутствие значимого повторного набора веса при долгосрочном наблюдении после БО.
Мы не обнаружили значимых дооперационных предикторов повторного набора веса. В то же время в различных исследованиях неоднократно предпринимались попытки идентифицировать прогностические факторы возврата веса после БО, которые могли бы быть использованы еще на дооперационном этапе. Среди них рассматриваются: более старший возраст пациентов, мужской пол, этническая принадлежность (принадлежность к афроамериканской популяции), более высокий дооперационный уровень ИМТ, наличие сопутствующих заболеваний (СД2, артериальная гипертензия, синдром обструктивного апноэ сна), наличие психоэмоциональных расстройств, в т.ч. расстройств пищевого поведения [9].
Согласно крупному систематическому обзору и метаанализу [1] Marcela GR и соавт., из множества рассмотренных выше факторов, именно более низкие уровни ИМТ и более молодой возраст пациентов являлись значимыми предикторами долгосрочного удержания веса после БО.
Различий по типу операций между группами со стабильным удержанием достигнутого веса и повторным набором веса в нашей работе также не было выявлено, в то же время %EWL среди всех пациентов был значимо выше в группе шунтирующих операций в сравнении с ПРЖ, что согласуется с результатами других исследований [5]. В ранее упомянутом исследовании Marcela GR и соавт. [1] ПРЖ была значимым фактором риска повторного набора веса после БО.
Нельзя исключить, что отсутствие корреляции между типом БО и повторным набором веса в нашем исследовании может быть обусловлено как неоднородностью хирургических групп по числу пациентов, так и выбранным критерием повторного набора веса — прибавка в весе ≥10 кг от минимально достигнутого после БО [8]. В литературе используется много различных критериев повторного набора веса в зависимости от абсолютных значений массы тела, ИМТ, EWL и т.д. (снижение EWL>25% от максимального значения; прибавка ≥10% или >15% от минимального веса; увеличение ИМТ≥5 кг/м² от минимально достигнутого/повышение ИМТ> 35 кг/м² после успешного снижения веса и т.д.) [10]. Различные критерии повторного набора веса могут влиять на неоднородность результатов исследований в отношении динамики массы тела при разных типах БО.
Рецидив СД2 после его ремиссии вследствие БО
В нашем исследовании в периоде 5 и более лет после БО большая часть пациентов с СД2 (72%) достигла и поддерживала ремиссию диабета, у 18% выявлен рецидив СД2 после ремиссии вследствие БО, у 10% пациентов ремиссия СД2 после БО не наступала.
Мы обнаружили значимые факторы риска отдаленного рецидива СД2 после его ремиссии вследствие БО: более высокие дооперационные значения HbA1c и более низкие дооперационные уровни ИРИ и С-пептида, большая длительность диабета до операции, инсулинотерапия в анамнезе, а также терапия несколькими сахароснижающими препаратами. Дополнительно нами были рассчитаны отрезные точки для каждого из параметров: длительность СД2≥6,5 года и уровень HbA1c≥8,14% служили предикторами рецидива СД2, а уровень ИРИ≥18,85 мкМЕ/мл и уровень С-пептида ≥3,175 нг/мл — предикторами ремиссии СД2.
Изучение факторов, влияющих на метаболические эффекты после БО, неоднократно проводилось в различных исследованиях. На основании выделенных значимых предикторов ремиссии СД2 к настоящему времени было разработано несколько прогностических моделей, 11 из которых представляют собой шкалы предикции, а остальные 5 — модели логистической регрессии [11].
Шкалы предикции предполагают оценку каждого из учитываемых параметров определенным количеством баллов с последующим вычислением их суммы и определением на ее основании вероятности ремиссии СД2 после операции. К этой группе относятся такие широко известные шкалы, как ABCD, DiaRem, Ad-DiaRem, DiaBetter и ряд других [11]. Почти во всех шкалах в различных комбинациях используются следующие прогностические параметры: возраст на момент операции, дооперационные значения ИМТ, HbA1c, C-пептида, длительность СД2, тип сахароснижающей терапии (с инсулином/без), количество сахароснижающих препаратов.
Модели логистической регрессии также учитывают упомянутые выше показатели: наличие/отсутствие инсулинотерапии в анамнезе, дооперационный уровень HbA1c, глюкозы плазмы натощак, С-пептида, инсулина, длительность СД2, дооперационный ИМТ, а также возраст, пол и т.д. [11].
В среднем период послеоперационного наблюдения в большинстве шкал/моделей составлял 1–5 лет, в 13 из 16 исследований срок наблюдения ограничивался лишь 1 годом после БО. Подавляющее большинство исследований основывались на данных пациентов, перенесших один тип бариатрического вмешательства (8 исследований — ГШ с межкишечным анастомозом по Ру, 2 — ПРЖ), и лишь 6 моделей включали более одного типа БО. Важно отметить, что в различных зарубежных моделях были предложены разные критерии ремиссии СД2. Неоднородность критериев ремиссии СД2 между различными моделями затрудняет их сравнительную характеристику и оценку применимости на различных популяциях пациентов. К настоящему времени проведено несколько исследований [11, 12], сравнивающих прогностическую мощность различных шкал и моделей, однако консенсуса в использовании той или иной модели не достигнуто.
В 2024 г. отечественные исследователи также предложили вариант модели прогнозирования ремиссии СД2 после БО, разработанный на основе данных по 112 пациентам, которым в период с 2018 по 2022 гг. проводилась БО одного из типов: ПРЖ или ГШ. В модели использовались такие предикторы, как: длительность СД2, возраст, индекс инсулинорезистентности HOMA-IR, уровень HbA1с, ИМТ, терапия метформином, препаратами сульфонилмочевины, инсулинотерапия, повышение уровня печеночных трансаминаз, уровень общего холестерина. По результатам проведенного статистического анализа был вычислен коэффициент значимости каждого из параметров, в результате чего была разработана формула, позволяющая прогнозировать высокую или низкую вероятность ремиссии СД2 после бариатрического лечения [13]. Длительность послеоперационного наблюдения в данном исследовании составляла ≤5 лет, что, как и в случае с зарубежными моделями, не дает возможности прогнозирования отдаленных метаболических эффектов БО (>5 лет наблюдения).
Как и в случае группы повторного набора веса мы не обнаружили влияния типа БО на частоту рецидива СД2. Вероятно, это может быть обусловлено неоднородностью хирургических групп по количеству пациентов и относительно небольшим объемом выборки в целом. Данное обстоятельство также требует проведения дальнейших исследований, поскольку во многих работах сообщалось о заведомо большей метаболической эффективности БПШ в сравнении с ГШ [14], а также шунтирующих операций в сравнении с продольной резекцией желудка [15]. В то же время в некоторых работах также не было показано влияние типа БО на частоту ремиссии СД2 [2][16], однако чаще всего они ограничивались относительно небольшим сроком послеоперационного наблюдения и не учитывали результаты БПШ.
Связь между повторным набором веса и рецидивом СД2
Отдельный интерес представляет то, что в нашем исследовании не было выявлено ожидаемой взаимосвязи между значимым повторным набором веса и частотой рецидива СД2, и лишь на уровне статистической тенденции %EWL был больше в группе стойкой ремиссии СД2.
Хорошо известно, что снижение массы тела часто сопровождается улучшением гликемического контроля [17]. И наоборот, о связи повторного набора веса и рецидива СД2 после БО также сообщалось в нескольких исследованиях [18][19]. Интересно, что в работе Zhou K. и соавт. у пациентов после ПРЖ и ГШ повторный набор веса коррелировал с более высоким уровнем HbA1c через 5 лет только после ПРЖ, но не после ГШ. Авторы исследования предположили, что подобные результаты могут объясняться несколькими факторами, например, недостаточно выраженным повторным набором веса в группе пациентов ГШ, включенных в исследование («пороговый уровень» набора веса может быть выше для развития рецидива СД2 в сравнении с тем набором веса, который демонстрировали пациенты в исследовании). Также авторы отмечают, что важен не набор веса в целом, а то, за счет чего он происходит (преимущественное отложение висцерального жира метаболически менее благоприятно в сравнении с увеличением массы подкожного жира) [20]. Кроме того, различие в механизмах снижения веса при разных типах БО также может приводить к отсутствию прямой связи между повторным набором веса и рецидивом СД2. Поскольку метаболический эффект шунтирующих операций обусловлен сразу несколькими механизмами и не ограничен лишь снижением массы тела, повторный набор веса может не играть столь значимой роли при ГШ, БПШ, как в случае с ПРЖ в отношении рецидива СД2 [20]. Вышеуказанные особенности могут быть применимы и к полученным нами результатам. Таким образом, вопросы о частоте отдаленного рецидива СД2 в зависимости от типа БО, а также роли послеоперационного возврата избыточной массы тела в развитии отдаленного рецидива СД2 требуют дальнейших исследований. Это откроет возможность лучшего понимания взаимосвязи между динамикой массы тела и метаболическим статусом пациентов, и наравне с уже обозначенными факторами, влияющими на развитие отдаленного рецидива СД2, позволит определять прогноз пациента в долгосрочном периоде после бариатрических вмешательств.
Ограничения исследования
Ограничением нашего исследования являются относительно небольшой общий объем выборки, обусловленный длительным периодом наблюдения после БО, а также неравномерное распределение пациентов по различным хирургическим группам. Данные обстоятельства требуют дальнейшего исследования с привлечением большего числа участников.
ЗАКЛЮЧЕНИЕ
Наше исследование показало, что факторы риска отдаленного рецидива СД2 после его ремиссии вследствие БО включают: большую длительность СД2, более высокие уровни HbA1c и более низкие значения ИРИ, С-пептида до операции, инсулинотерапию и большее количество сахароснижающих препаратов в анамнезе. В то же время нами не было выявлено значимых дооперационных предикторов повторного набора веса. Кроме того, мы не обнаружили значимой связи между рецидивом СД2 и повторным набором веса после БО, а также их взаимосвязи с типом бариатрического вмешательства, что требует дальнейшего изучения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена при поддержке Российского научного фонда (проект №22-15-00365 «Динамика гормонально-метаболических факторов, маркеров “метаболической памяти” и фенотипических особенностей зрелых и прогениторных клеток жировой ткани на фоне постбариатрической ремиссии сахарного диабета 2 типа»).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Вознесенская А.А. — наблюдение пациентов, проведение лабораторного обследования, анализ литературы, статистическая обработка материала, написание статьи; Першина-Милютина А.П. — статистическая обработка материала, написание статьи; Аредов А.В. — статистическая обработка материала, написание статьи; Томилова А.О., Рожевская Е.Е. — анализ литературы, написание статьи; Шестакова Е.А. — организация клинико-лабораторного обследования пациентов, анализ литературы, написание статьи, утверждение итогового варианта текста рукописи; Cинеокая М.C. — хирургическое лечение пациентов, редактирование текста, утверждение итогового варианта текста рукописи; Ершова Е.В. — наблюдение пациентов, анализ литературы, редактирование текста; Стафеев Ю.С. — анализ литературы, участие в написании статьи; Яшков Ю.И. — хирургическое лечение пациентов, редактирование текста, утверждение итогового варианта текста рукописи; Шестакова М.В. — концепция и дизайн статьи, редактирование текста, утверждение итогового варианта текста рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Gomes M, Guimar LF, Siqueira L, et al. Weight regain after bariatric surgery : A systematic review and meta-analysis of observational studies. 2024;45(September 2023). doi:10.1016/j.obmed.2023.100528
2. Jans A, D M, Szabo E, et al. Factors affecting relapse of type 2 diabetes after bariatric surgery in Sweden 2007 – 2015 : a registry-based cohort study. 2022;18:305-312. doi:10.1016/j.soard.2021.12.005
3. Sjöström L. Review of the key results from the Swedish Obese Subjects (SOS) trial - a prospective controlled intervention study of bariatric surgery. J Intern Med. 2013;273(3):219-234. doi:10.1111/joim.12012
4. Бордан Н.С. Хирургическое лечение морбидного ожирения и ассоциированных заболеваний с применением различных модификаций билиопанкреатического шунтирования с продольной резекцией желудка: дис. на соискание ученой степени д.м.н., 3.1.9. – хирургия/Бордан Н.С.- Москва, 2023 г.-292 стр.-Библиогр.: с.246-286.
5. J Süsstrunk J, Schneider R, Peterli R et al. Long-term outcome after biliopancreatic diversion with duodenal switch: a single-center experience with up to 20 years follow-up. Surg Obes Relat Dis. 2023;19(2):83-90. doi:10.1016/j.soard.2022.10.020
6. Kapeluto JE, Tchernof A, Masckauchan D, et al. Ten-year remission rates in insulin-treated type 2 diabetes after biliopancreatic diversion with duodenal switch. Surg Obes Relat Dis. 2020;16(11):1701-1712. doi:10.1016/j.soard.2020.06.052
7. Дедов И. И. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск // Сахарный диабет. 2023. Т. 26, № 2S. С. 1-157. doi:10.14341/DM13042
8. Неймарк А. Е. и др. Оценка эффективности снижения массы тела и возврата потерянного веса после продольной резекции желудка в отдаленные сроки // Ожирение и метаболизм. 2022. Т. 18, № 4. С. 447-455. doi:10.14341/omet12815
9. Park JY. Weight Loss Prediction after Metabolic and Bariatric Surgery. J Obes Metab Syndr. 2023;32(1):46-54. doi:10.7570/jomes23008
10. El Ansari W, Elhag W. Weight Regain and Insufficient Weight Loss After Bariatric Surgery: Definitions, Prevalence, Mechanisms, Predictors, Prevention and Management Strategies, and Knowledge Gaps-a Scoping Review. Obes Surg. 2021;31(4):1755-1766. doi:10.1007/s11695-020-05160-5
11. Singh P, Adderley NJ, Hazlehurst J, et al. Prognostic Models for Predicting Remission of Diabetes Following Bariatric Surgery: A Systematic Review and Meta-analysis. Diabetes Care. 2021;44(11):2626-2641. doi:10.2337/dc21-0166
12. Ha J, Kwon Y, Kim NH et al. Discordance in prediction for prognosis of type 2 diabetes after metabolic surgery: Comparison of the ABCD, DiaRem, and individualized metabolic surgery models. Ann Surg Treat Res. 2019;97(6):309-318. doi:10.4174/astr.2019.97.6.309
13. Неймарк А. Е. и др. Система прогнозирования ремиссии сахарного диабета 2 типа после бариатрической хирургии DRAMS // Сахарный диабет. 2024. Т. 27, № 5. С. 451-460. doi:10.14341/DM13169
14. Scopinaro N, Adami GF, Bruzzi P, et al. Prediction of Diabetes Remission at Long Term Following Biliopancreatic Diversion. Obes Surg. Published online 2017:3-6. doi:10.1007/s11695-017-2555-3
15. Aminian A, Vidal J, Salminen P, et al. Late Relapse of Diabetes After Bariatric Surgery: Not Rare, but Not a Failure. Diabetes Care. 2020;43(3):534-540. doi:10.2337/dc19-1057
16. Ramos-Levi AM, Matia P, Cabrerizo L, et al. Statistical models to predict type 2 diabetes remission after bariatric surgery. J Diabetes. 2014;6(5):472-477. doi:10.1111/1753-0407.12127
17. Liu Y, Chen Y, Ma J, et al. Dapagliflozin plus calorie restriction for remission of type 2 diabetes: multicentre, double blind, randomised, placebo controlled trial. BMJ. 2025;388:e081820. Published 2025 Jan 22. doi:10.1136/bmj-2024-081820
18. Chikunguwo SM, Wolfe LG, Dodson P, et al. Analysis of factors associated with durable remission of diabetes after Roux-en-Y gastric bypass. Surg Obes Relat Dis. 2010;6(3):254-259. doi:10.1016/j.soard.2009.11.003
19. Digiorgi M, Rosen DJ, Choi JJ, et al. Re-emergence of diabetes after gastric bypass in patients with mid-to long-term follow-up. Surg Obes Relat Dis. 2010;6(3):249-253. doi:10.1016/j.soard.2009.09.019
20. Zhou K, Wolski K, Malin SK, et al. Impact of weight loss trajectory following randomization to bariatric surgery on long-term diabetes glycemic and cardiometabolic parameters. Endocr Pract. 2019;25(6):572-579. doi:10.4158/EP-2018-0522
Об авторах
А. А. ВознесенскаяРоссия
Вознесенская Анастасия Александровна, аспирант
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. П. Першина-Милютина
Россия
Першина-Милютина Анастасия Павловна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. В. Аредов
Россия
Аредов Алексей Вячеславович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. Е. Рожевская
Россия
Рожевская Екатерина Евгеньевна, клинический ординатор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. О. Томилова
Россия
Томилова Алина Олеговна, аспирант
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. А. Шестакова
Россия
Шестакова Екатерина Алексеевна, д.м.н., г.н.с., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
М. С. Синеокая
Россия
Синеокая Мария Сергеевна, к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. В. Ершова
Россия
Ершова Екатерина Владимировна, к.м.н., в.н.с.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Ю. С. Стафеев
Россия
Стафеев Юрий Сергеевич, к.б.н., в.н.с.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Ю. И. Яшков
Россия
Яшков Юрий Иванович, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1 (а). Динамика индекса массы тела в группе стабильного удержания веса после бариатрической операции. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(243KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 1 (б). Динамика индекса массы тела в группе повторного набора веса после бариатрической операции. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(241KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Вознесенская А.А., Першина-Милютина А.П., Аредов А.В., Рожевская Е.Е., Томилова А.О., Шестакова Е.А., Синеокая М.С., Ершова Е.В., Стафеев Ю.С., Яшков Ю.И., Шестакова М.В. Повторный набор веса и отдаленный рецидив сахарного диабета 2 типа после его ремиссии вследствие бариатрических вмешательств — кто в зоне риска? Сахарный диабет. 2025;28(5):404-415. https://doi.org/10.14341/DM13348
For citation:
Voznesenskaya A.A., Pershina-Miliutina A.P., Aredov A.V., Rozhevskaya E.E., Tomilova A.O., Shestakova E.A., Sineokaya M.S., Ershova E.V., Stafeev Y.S., Yashkov Y.I., Shestakova M.V. Weight regain and type 2 diabetes relapse in the long-term period after bariat ric surgery — who is at risk? Diabetes mellitus. 2025;28(5):404-415. (In Russ.) https://doi.org/10.14341/DM13348

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































