Перейти к:
Спектр эффектов ингибиторов дипептидилпептидазы-4: внутри и за пределами гликемического контроля (часть 2)
https://doi.org/10.14341/DM13343
Аннотация
К 20-летию клинического применения ингибиторов дипептидазы-4 (иДПП-4) расширяется представление о спектре эффектов (метаболических, клинических, биологических) за пределами первоначально определенного гликемического контроля, рассматриваются возможности и направления их безопасного использования с учетом новых биологических эффектов. Уточняется сердечно-сосудистая и нефрологическая безопасность иДПП-4 в контексте комбинированной терапии с метформином и инсулином. Анализируется недооцененная связь сахарного диабета 2 типа с хрупкостью костей и выбором антигипергликемических препаратов. Рассматриваются новые биологические эффекты ингибиторов ДПП-4 с потенциальной клинической значимостью. Представлен алоглиптин как противодиабетическое инкретиновое средство с его возможностями и сюрпризами в метаболическом контроле.
Ключевые слова
Для цитирования:
Руяткина Л.А., Руяткин Д.С. Спектр эффектов ингибиторов дипептидилпептидазы-4: внутри и за пределами гликемического контроля (часть 2). Сахарный диабет. 2025;28(5):451-459. https://doi.org/10.14341/DM13343
For citation:
Ruyatkina L.A., Ruyatkin D.S. Spectrum of effects of dipeptidyl peptidase-4 inhibitors: within and beyond glycemic control (part 2). Diabetes mellitus. 2025;28(5):451-459. (In Russ.) https://doi.org/10.14341/DM13343
СЕРДЕЧНО-СОСУДИСТАЯ БЕЗОПАСНОСТЬ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ-4 В КОНТЕКСТЕ КОМБИНИРОВАННОЙ ТЕРАПИИ
Обновленный метаанализ рандомизированных клинических исследований (РКИ) не показал значительного риска хронической сердечной недостаточности (ХСН) при терапии пациентов с сахарным диабетом 2 типа (СД2) ингибиторами дипептидилпептидазы-4 (иДПП-4) [1]. Хотя сердечно-сосудистый эффект лечения иДПП-4 в РКИ кажется нейтральным в отношении ХСН [2], средние итоги лечения часто скрывают вариабельность результатов в подгруппах пациентов [3]. Так, в зависимости от этиологии ХСН отмечена гетерогенность данных внутри классов иДПП-4 и агонистов рецепторов глюкагоноподобного пептида -1 (арГПП-1) [4]. Одним из потенциальных факторов наблюдаемой гетерогенности лечения служит взаимодействие совместно назначаемых препаратов.
Ретроспективный анализ трех РКИ у пациентов с базовым лечением метформином (МЕТ) по сравнению с лицами, не принимающими бигуанид, предполагает для иДПП-4 снижение риска сердечно-сосудистых событий (ССС), в первую очередь инфаркта миокарда (ИМ), инсульта, сердечно-сосудистой смертности и госпитализации вследствие нестабильной стенокардии [5]. При сравнении иДПП-4 (n=13 391) и препаратов сульфонилмочевины (СМ) (n=33 206) в комбинации с МЕТ по данным Medicare, взаимодействие между началом приема глиптинов и МЕТ было статистически значимым для суммарного результата по MACE (р=0,024) и смертности (р=0,023), что предполагает возможное взаимодействие между иДПП-4 и метформином [3].
У пациентов с ИМ и СД2 применение МЕТ в комбинации с иДПП-4 было связано с уменьшением частоты рецидивов инфаркта по сравнению с применением МЕТ в сочетании с СМ в течение 3 лет наблюдения [6]. Полагают, что МЕТ может усиливать кардиопротекцию иДПП-4, регулируя путь инкретинов: стимулирует выработку кишечного ГПП-1, способствует экспрессии рецепторов глюкагоноподобного пептида (ГПП) и глюкозозависимого инсулинотропного полипептида (ГИП) в β-клетках островков, снижает уровни циркулирующей ДПП-4 [7]. В совокупности эти механизмы бигуанида могут усиливать сердечно-сосудистые преимущества при сочетании с иДПП-4 [5], определяя роль МЕТ в качестве сердечно-сосудистого модератора глиптина [8].
Терапия иДПП-4 связана с более низким риском MACE по сравнению с СМ и аналогичным риском MACE по сравнению с МЕТ у пациентов с кардиологической и почечной патологией. Эта связь, наиболее очевидная в первый год терапии, характеризует иДПП-4 как более безопасный выбор, чем СМ для старта лечения диабета у пациентов с высоким риском [9]. Комбинация иДПП-4 с метформином экономически эффективна по сравнению с комбинацией МЕТ и СМ в качестве долгосрочной терапии второй линии [10].
При оценке предикторов ответа на лечение тремя дополнительными препаратами: СМ, иДПП-4 и ингибиторами натрий-глюкозного котранспортера типа 2 (иНГЛТ-2) в добавление к монотерапии МЕТ, вероятность достижения целевого уровня гликированного гемоглобина (HbA1c) с присоединением глиптинов была выше у пациентов с более низкой скоростью клубочковой фильтрации (СКФ) [11]. Представлены свидетельства способности иДПП-4, в монотерапии или в сочетании с другими сахароснижающими препаратами, профилактировать снижение СКФ при легком нарушении функции почек [12], снижать альбуминурию и, потенциально, предотвращать периферическую нейропатию [13][14], а также свидетельства безопасности и хорошей переносимости при почечной недостаточности [15]. Микроальбуминурию считают основным клиническим фактором, взаимосвязанным с повышением вариабельности гликемии (ВГ) у больных СД2 [16]; антипротеинурический эффект иДПП-4 без влияния на конечные почечные точки отмечен при диабетических и недиабетических заболеваниях почек [17]. При использовании комбинации иДПП-4 с МЕТ частота ССС существенно не отличалась от иНГЛТ-2 с сердечно-сосудистыми преимуществами [18] и оказалась ниже в отличие от СМ с аналогичной эффективностью [19]. Ингибиторы ДПП-4 были связаны с лучшими долгосрочными результатами у пациентов с сердечной недостаточностью с сохраненной фракцией выброса (СНсФВ) и диабетом [20].
Особое внимание привлекают варианты инсулинотерапии в комбинации с неинсулиновыми препаратами, способными снижать сердечно-сосудистый риск за счет устранения метаболического дисбаланса, уменьшения воспаления и улучшения эндотелиальной функции [21]. При комбинации иДПП-4 с инсулином показано: снижение риска смертности от всех причин по сравнению с сочетанием инсулинотерапии с не иДПП-4 на основании результатов 11-летнего ретроспективного когортного исследования (n=3120) [22], предотвращение прогрессирования ишемической болезни сердца [23], улучшение вариабельности гликемии (ВГ), при этом добавление ингибитора ДПП-4 к более низкой дозе МЕТ стало альтернативным подходом к стабильной ВГ по сравнению с дополнительной высокой дозой МЕТ [24].
В целом, этот класс безопасных пероральных антигипергликемических средств с противовоспалительным профилем и обширным опытом применения, не требуя повышения дозы, без увеличения веса и сердечно-сосудистых рисков, оптимального соотношения эффективности лечения и стоимости иДПП-4 [25], играет серьезную роль в терапии СД2 [26, 27]. Указанные качества определяют иДПП-4 в качестве привилегированной цели в области открытия лекарств [27]. Основываясь на ингибирующей активности в отношении ДПП-4, для дальнейшей разработки целевых соединений из мощных производных хиназолина, пиримидина и аминопиперидина рассматривают три препарата: алоглиптин, алинаглиптин и трелаглиптин [28].
АЛОГЛИПТИН (ВИПИДИЯR) КАК ПРОТИВОДИАБЕТИЧЕСКОЕ ИНКРЕТИНОВОЕ СРЕДСТВО: ВОЗМОЖНОСТИ И СЮРПРИЗЫ В МЕТАБОЛИЧЕСКОМ КОНТРОЛЕ
Выбор алоглиптина в качестве одного из прототипов не случаен, поскольку его принадлежность к классу непептидомиметиков обеспечивает лучшую фармакокинетику и большую метаболическую стабильность [29]. Уникальное строение алоглиптина с четырьмя центрами связывания, в основе которого лежит 3D-структура ДПП-4, обеспечивает высокую селективность (наибольшую среди представленных в РФ: >14000 vs ДПП-8 и -9) и эффективность препарата, что позволило отнести его к третьему поколению внутри класса [30]. Гликемический контроль при терапии иДПП-4 варьирует в зависимости от отдельных молекул; при монотерапии снижение HbA1c составляет от -0,5 до -1,0% [31], в среднем — на 0,74% при исходном уровне 8% [32]. Эффективность монотерапии алоглиптина в 12-месячном исследовании составила 1,3% при исходном уровне HbA1c — 7,6% [33]. Более существенные эффекты алоглиптина объяснили большей селективностью к дипептидилпептидазе-4 и более высокой скоростью ее ингибирования [34]. Снижение гликемии и безопасность алоглиптина продемонстрированы независимо от исходного уровня HbA1c, хотя эффективность оказалась сильнее при более высоких исходных значениях HbA1c [33].
Стабильный контроль гликемии и безопасность алоглиптина подтверждены в долгосрочных исследованиях: проспективном 3-летнем J-BRAND Registry в монотерапии или сочетании с другими пероральными сахароснижающими препаратами [35] и наблюдательном 3,5-летнем исследовании [36]. Результаты нового систематического обзора и сетевого метаанализа РКИ с помощью SUCRA-рейтинга показали, что алоглиптин (ВипидияR) превосходит другие иДПП-4 в виде монотерапии и в комбинации с МЕТ в достижении целевого HbA1c в общей популяции и в популяции наивных и не наивных больных СД2 [37]. В контроль гликемии вносит вклад способность алоглиптина снижать ВГ [38] и улучшать ранний ответ β-клеток [26].
Метаболические нарушения СД2 в комплексе с микро- и макрососудистыми осложнениями рассматриваются как единое кардиоренальное метаболическое заболевание [39]. Ключевым фактором риска СД2 и его прогрессирования считают дислипидемию [40]; среди механизмов этого процесса выделяя апоптоз β-клеток, вторичную инсулинорезистентность (ИР) в печени и скелетных мышцах и воспалительную реакцию в жировой ткани при их тесной связи с индексом массы тела. Алоглиптин в монотерапии, помимо его способности модулировать функцию β-клеток, снижает постпрандиальные атерогенные липиды и печеночные трансаминазы [33][36][41][42]. Показана роль ДПП-4 в ИР и воспалительных процессах в жировой ткани, где преимущественно синтезируется этот адипокин, нарушая сигнализацию инсулина внутри адипоцита и способствуя развитию провоспалительной среды [26][43]. Предоставлены доказательства потенциала алоглиптина, в отличие от других протестированных глиптинов, регулировать ИР жировой ткани [44].
Алоглиптин стремительно развивается как противодиабетическое инкретиновое средство [33]. Так, независимо от гликемического и липидного статуса, лечение алоглиптином привело к значительной регрессии бляшек и стабилизации неклеточных лейкоцитов у пациентов с острым коронарным синдромом (ОКС) и легкой дисгликемией, что свидетельствует о потенциальной полезности раннего вмешательства с использованием иДПП-4 для этой подгруппы пациентов [45]. Исследование SPEAD-A по результатам 20 месяцев лечения алоглиптином показало его профилактическое антиатеросклеротическое действие при СД2, значительно изменив максимальную толщину интима-медиа (ТКИМ) сонных артерий [46], что коррелирует с исследованием Lv Q и соавт. (2024), продемонстрировавших большую эффективность длительной терапии эксенатидом, алоглиптином или МЕТ в замедлении прогрессирования ТКИМ (маркера субклинического атеросклероза), чем другими сахароснижающими препаратами при сравнении с плацебо [47].
Поскольку маркирует атеросклероз повышенная жесткость артериальной стенки [48], важна способность алоглиптина улучшать этот показатель у пациентов с артериальной гипертонией (АГ) и СД2 [33][49], а также резерв коронарного кровотока и фракцию выброса левого желудочка у пациентов с СД2 и ИБС [50]. При этом иДПП-4 продемонстрировали уникальные преимущества в регуляции артериального давления (АД) в шести механизмах (рис. 1), включая гормональные, почечные, сосудистые, иммунной и нервной системы, ИР [51].
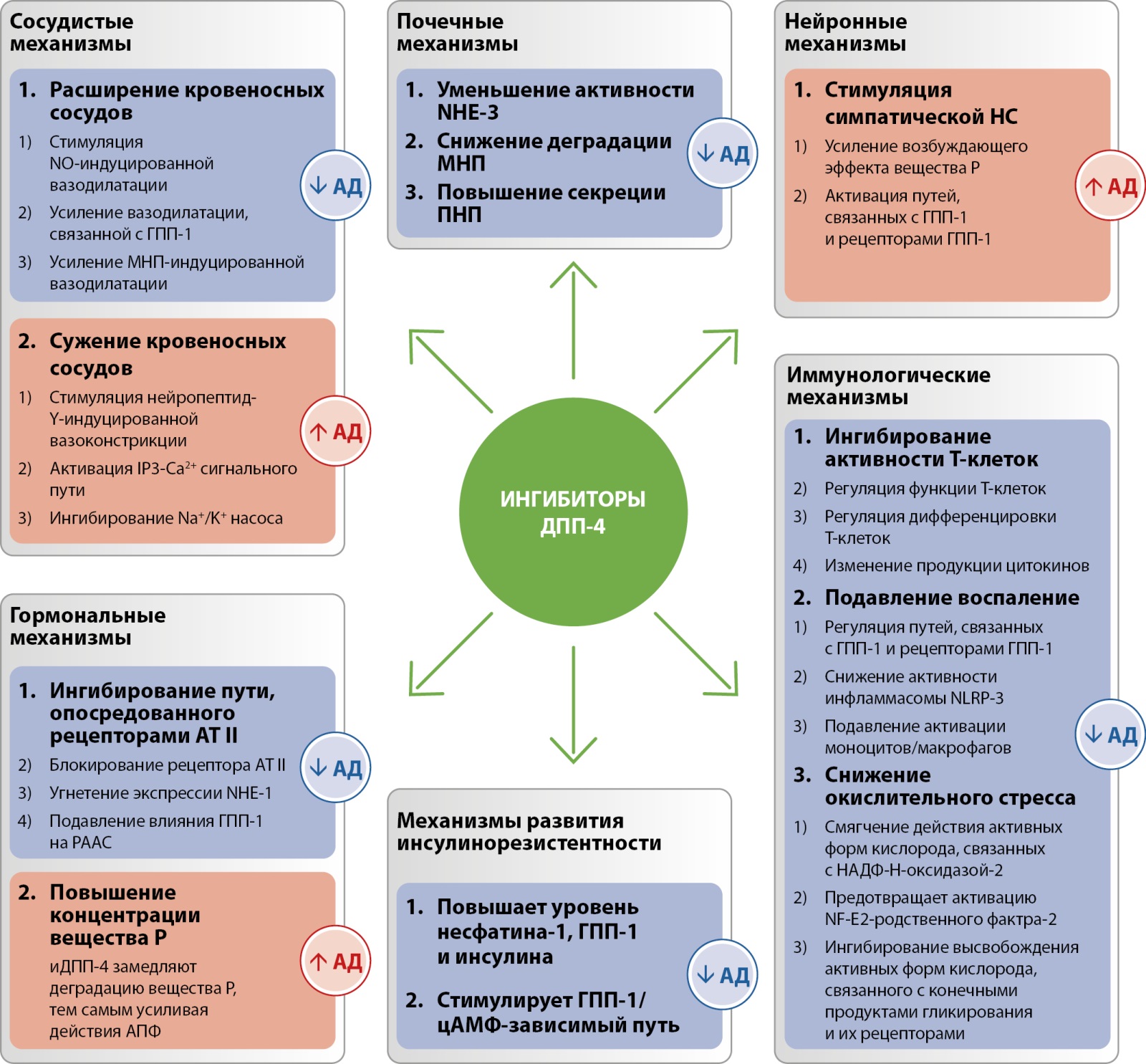
Рисунок 1. Потенциальные механизмы ингибиторов дипептидилпептидазы-4 в регуляции артериального давления. Адаптировано по Zhang J. с соавт. [51].
Примечания: АТ II — ангиотензин II; ГПП-1 — глюкагоноподобный пептид-1; АПФ — ангиотензинпревращающий фермент; ДПП-4 — дипептидилпептидаза-4; МНП — мозговой натрийуритический пептид (нарийуритический пептид типа B); НАДФ-Н — никотинамидадениндинуклеотидфосфат восстановленный; НС — нервная система; ПНП — предсердный натрийуритический пептид; РААС — ренин-ангиотензин-альдостероновая система; цАМФ — циклический аденозинмонофосфат; IP3 (inositoltrisphosphate (англ.)) — инозитолтрифосфат; NF-E2 (nuclear factor erythroid-derived 2 (англ.)) — ядерный фактор эритроидного происхождения 2; NHE-1 (Sodium–hydrogen antiporter 1 (англ.)) — натрий-водородный антипортер-1; NHE-3 (Sodium–hydrogen antiporter 3 (англ.)) — натрий-водородный антипортер-3; NLRP-3 (nod-like receptor protein 3 (англ.)) — nod-подобный рецепторный белок-3; NO (nitric oxide (англ.)) — оксид азота.
При использовании иДПП-4 важно учитывать их потенциальные различия в отношении более низкого риска развития ХСН, поскольку классовым эффектом является симпатическая активация, способная повысить риск сердечной недостаточности. В отличие от других глиптинов, ситаглиптин и алоглиптин выводятся в основном с мочой и подавляют активность почечного натрий-водородного обменника-3. Эти два препарата не увеличивали риск госпитализации по поводу ХСН в масштабных РКИ сердечно-сосудистых исходов [52].
Ингибиторы ДПП-4 оказывают плейотропное воздействие за пределами гликемического контроля, задерживая старение сосудов [53]. Представлены данные о возможном антивозрастном действии алоглиптина, канаглифлозина и метформина путем активации AMPK — ключевого фермента энергетического баланса [54]. Дополнительный анализ результатов исследования ENTIRE показал, что интенсификация терапии алоглиптином позволила добиться компенсации углеводного обмена, умеренного снижения массы тела, показателей АД, холестерина липопротеидов низкой плотности (ХС-ЛНП) у большинства пациентов с СД2. Наиболее частое достижение целевых значений HbA1c, отмеченное у молодых пациентов с меньшей длительностью диабета [55], свидетельствуя в пользу более раннего назначения алоглиптина. Особое внимание спектр возможностей алоглиптина в метаболическом контроле, наряду с сердечно-сосудистой безопасностью, привлекает в терапии дебютов СД2 в уязвимой в плане кардиометаболического риска когорте постменопаузальных женщин [56].
НЕДООЦЕНЕННАЯ СВЯЗЬ САХАРНОГО ДИАБЕТА, ХРУПКОСТИ КОСТЕЙ И ВЫБОРА АНТИГИПЕРГЛИКЕМИЧЕСКИХ ПРЕПАРАТОВ
Общий регуляторный контроль гликемического и костного гомеостаза позволяет рассматривать хрупкие переломы как еще одно осложнение диабета [57], обосновывая введение термина «диабетопороз» [58]. Компоненты метаболического синдрома (МС): висцеральное ожирение, низкий уровень холестерина липопротеинов высокой плотности (ЛПВП), гипергликемия, высокие уровни триглицеридов (ТГ) и АГ, — влияют на здоровье костей посредством высвобождения адипокинов и провоспалительных цитокинов висцеральной жировой тканью [59][60]. При СД2 в дополнение к метаболическим нарушениям серьезное влияние на риск переломов оказывают нейропатия и гипогликемии [61], привлекая внимание к антидиабетическим препаратам [62][63], особенно к инкретиновым, поскольку ГПП-1 и ГИП участвуют в регуляции состояния костной ткани [64].
Повышенная активность ДПП-4 может косвенно способствовать резорбции и подавлять формирование костей, увеличивая риск остеопороза [65]. Метаанализ 28 РКИ (n=220 000) выявил более низкий риск переломов среди пользователей иДПП-4 (OR 0,60, 95% CI 0,37–0,99) [66], что согласуется с анаболическим влиянием инкретиновых препаратов, арГПП-1 и иДПП-4, на кость [67]; снижение риска остеопороза было дозозависимым [68].
Алоглиптин продемонстрировал более низкий риск перелома костей по сравнению с плацебо, СМ, линаглиптином или саксаглиптином с вероятностью 76,3% [69]. Хотя переход на арГПП-1 улучшает гликемический контроль, он, по-видимому, оказывает менее благоприятное воздействие на плотность костей, чем продолжение приема иДПП4 [70]. Возможным объяснением этого феномена является сохранение костной ткани при терапии иДПП-4 с помощью как ГИП (ингибирует резорбцию костей), так и арГПП-1 (способствует формированию костей, ингибированию их резорбции и улучшению свойств костного материала) [71]. Новые эффекты иДПП-4 на метаболизм костей объясняют обратную зависимость между активностью дипептидилпептидазы-4 и минеральной плотностью костной ткани, а также повышенный риск переломов [72].
О НОВЫХ БИОЛОГИЧЕСКИХ ЭФФЕКТАХ ИНГИБИТОРОВ ДПП-4
Поскольку ДПП-4 модулирует воспаление и иммуноопосредованное разрушение β-клеток [73], иДПП-4 потенциально может выполнять функции иммунной регуляции при аутоиммунных и воспалительных заболеваниях [74]. В этом направлении обсуждаются, исследуются и апробируются патогенетически обоснованные перспективы применения иДПП-4 в качестве революционных стратегий лечения [29]. В консенсусном заявлении международной группы экспертов предложено использовать иДПП-4 в лечении латентного аутоиммунного диабета у взрослых (LADA) [75], что активно обсуждается [76]. Поскольку LADA составляет 2–12% всех взрослых пациентов, эксперты обосновывают целесообразность общего скрининга LADA при недавно диагностированном СД2, а также необходимость проведения крупных РКИ [75].
На основании повышенной активности сывороточной ДПП4 при сахарном диабете 1 типа (СД1), связанной с продолжительностью диабета [77], иДПП-4 рассматривают в качестве потенциальных терапевтических средств при СД1 в дополнение к подавлению деградации ГПП-1 и ГИП [73]. На основании экспериментальных и пилотных клинических исследований предлагают применять иДПП-4 в профилактике и лечении СД1. Показано, что добавление иДПП4 в комбинации с витамином D3 продлевает период «медового периода» до 24 месяцев [78], особенно эффективно сохраняя функцию β-клеток при аутоиммунном СД1 у взрослых с более высокими уровнями GAD [79]. Запатентована тройная комбинация иДПП-4 с ингибиторами протонной помпы и гамма-аминомасляной кислотой в качестве дополнения к инсулинотерапии, показав улучшение гликемического контроля у пациентов с СД1 при снижении дозы инсулина или даже ее отмены [80]. Разработан протокол PRE1BRAZIL предстоящего РКИ по оценке эффективности алоглиптина в задержке прогрессирования стадии 2 (предсимптомной) в стадию 3 (симптомной) СД1 [81].
Последние годы исследования фармакомикробиомики показали, что микробиота и ее метаболиты участвуют в регуляции проницаемости кишечника, а также влияют на иммунные, воспалительные реакции и метаболический гомеостаз при СД2; выявлены двунаправленные эффекты между микробиомом кишечника и рядом противодиабетических препаратов, включая иДПП-4 и МЕТ [82]; продемонстрировано важное влияние иДПП4 на микробиоту кишечника, раскрывая новый антигипергликемический механизм с дополнительным преимуществом [83].
Модуляция биодоступности и функции других субстратов ДПП-4, включая хемокины, повышает вероятность использования глиптинов за пределами контроля гипергликемии. Воспаление является признанным фактором прогрессирования рака и метастазирования, что делает противовоспалительный потенциал иДПП-4 ценным активом в лечении рака; в доклинических исследованиях и некоторых клинических испытаниях препараты продемонстрировали многообещающие результаты в снижении роста опухоли и повышении эффективности традиционных методов лечения рака [84][85]. Поскольку ДПП-4 участвует в устойчивости к ряду препаратов, в том числе противораковым, обсуждается потенциальное влияние ее ингибиторов на снижение риска заболеваний печени: вирусного гепатита С, стеатогепатоза и гепатоцеллюлярной карциномы [86]. Одновременно обновленный метаанализ РКИ (n=81 737 участников с СД2) подтвердил безопасность иДПП-4 относительно повышенного риска панкреатита (Peto-OR 0,97; 95% ДИ: 0,74, 1,27) или рака pancreas [87].
Изучаются возможности иДПП-4 в снижении полиорганной токсичности химиотерапии из-за индукции воспаления, оксидативного стресса и апоптоза. Продемонстрирован многообещающий эффект алоглиптина в снижении токсичности циклофосфамида в отношении гепатоцеллюлярного повреждения [88][89] и легких путем смягчения окислительного, воспалительного и фиброзного воздействия [90]. Ингибиторы ДПП-4 облегчают когнитивную дисфункцию при СД2 [91], предполагая перспективы предотвращения и прогрессирования болезни Альцгеймера с учетом контроля уровня глюкозы, улучшения нейрональной инсулинорезистентности, противовоспалительных, антиоксидантных и антиапоптотических эффектов, а также стимулирования нейрогенеза [92].
ЗАКЛЮЧЕНИЕ
ДПП-4, фермент сериновой протеазы и адипокин CD36, участвует в многочисленных физиологических и патологических процессах (рис. 2): регулирует воспалительные и иммунные реакции, контролирует метаболизм глюкозы посредством своего протеолитического воздействия на инкретины, оказывает многоплановое воздействие на сердечно-сосудистую систему, включая эндотелиальную дисфункцию и повышенную проницаемость сосудов [93]. Согласно спектру выявленных эффектов, уточняется место иДПП-4 в клинической практике: от безопасности в отношении риска панкреатита или рака pancreas до возможного использования противовоспалительного потенциала в повышении эффективности традиционных методов лечения рака и функции иммунной регуляции при аутоиммунных и воспалительных заболеваниях.
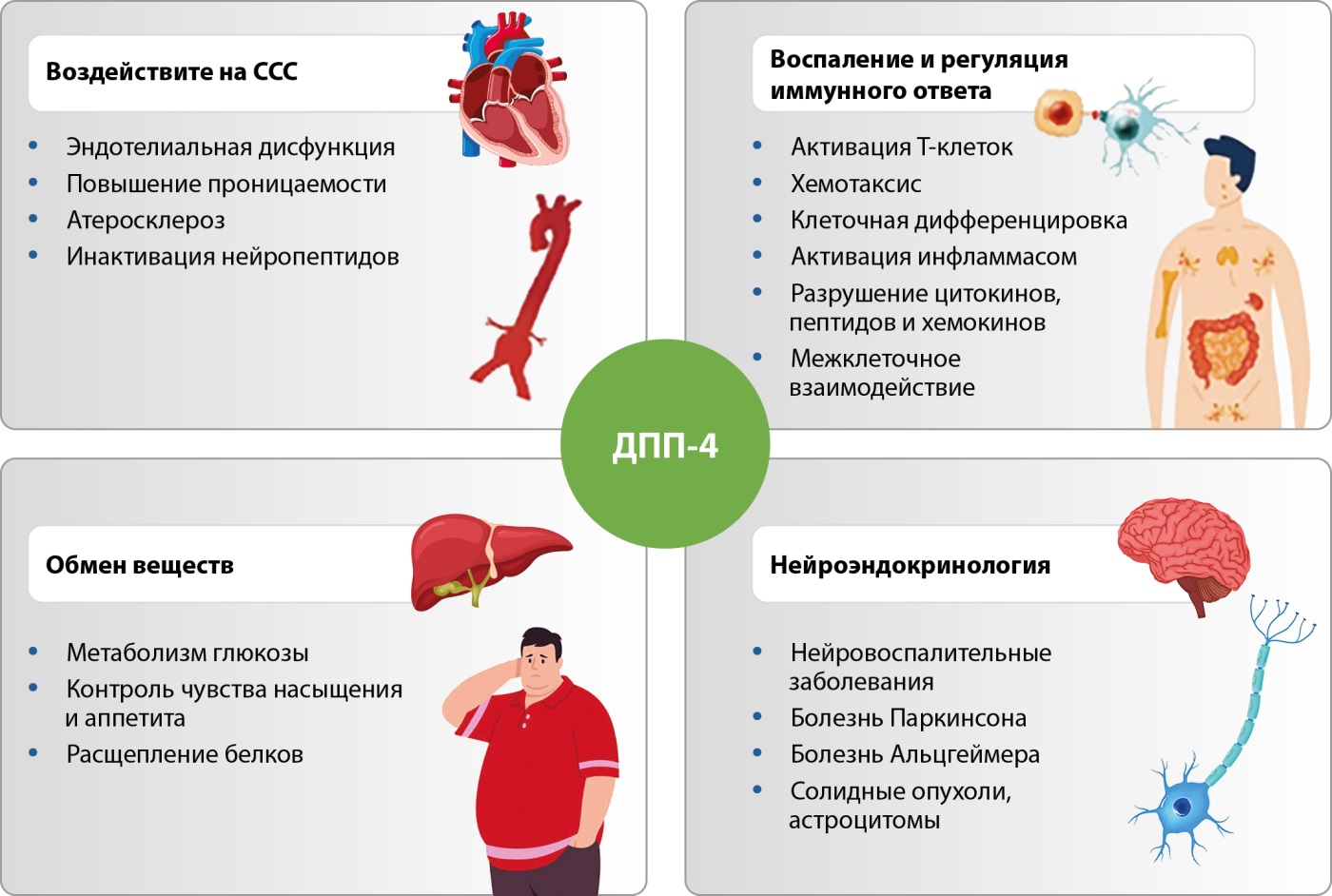
Рисунок 2. Участие дипептидилпептидазы-4 в многочисленных физиологических и патологических процессах. Адаптировано по Ngetich E. и соавт. [93].
Примечание: ДПП-4 — дипептидилпептидаза-4; ССС — сердечно-сосудистая система.
Современные тенденции комбинированной антидиабетической терапии с использованием плейотропных эффектов препаратов группы смещают внимание от доказанной в РКИ сердечно-сосудистой безопасности к более низкому риску MACE по сравнению с СМ и аналогичным метформину. Уточняется сердечно-сосудистая и нефрологическая безопасность иДПП-4 в контексте комбинированной терапии: рассматривается роль метформина в качестве сердечно-сосудистого модератора иДПП-4 и улучшение сердечно-сосудистого прогноза при их комбинации с инсулинотерапией.
Изучаются возможности и направления их безопасного использования с учетом новых биологических эффектов. Участие ДПП-4 в нейровоспалительных и нейродегенеративных расстройствах предполагает возможность положительных эффектов ингибиторов этого фермента в терапии болезней Альцгеймера и Паркинсона [93]. Анализируется недооцененная связь СД2 с хрупкостью костей и особенности анаболического влияния иДПП-4 на костную ткань, а также их потенциальная клиническая значимость с учетом выявленных новых биологических эффектов.
Представлен алоглиптин (ВипидияR) как противодиабетическое инкретиновое средство с его возможностями в метаболическом контроле. Эффективность в достижении целевых уровней HbA1c в сочетании со снижением ВГ, улучшение раннего ответа β-клеток с влиянием на их дисбаланс с α-клетками, а также коррекции ИР жировой ткани и снижение постпрандиальных атерогенных липидов, свидетельствуя в пользу более раннего назначения препарата. Представлены данные о возможном антивозрастном действии алоглиптина: через путь АМФ-активируемой протеинкиназы, ключевой фермент энергетического баланса, снижение жесткости артериальной стенки; при длительном лечении замедление прогрессирования ТКИМ сонных артерий.
Соответственно, расширяющийся спектр эффектов ингибиторов ДПП-4 определяет дальнейшую разработку целевых соединений этого класса.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Информация о спонсорстве. Статья подготовлена при поддержке группы компаний «НИЖФАРМ».
Информация о конфликте интересов. Авторы декларируют отсутствие конфликта интересов.
Информация о вкладе авторов в написание статьи. Руяткина Л.А. — концепция, анализ литературных данных, написание статьи; Руяткин Д.С. — обсуждение концепции, поиск и анализ литературных данных, написание статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Scirica BM, Im K, Murphy SA et al. Re-adjudication of the Trial Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS) with study-level meta-analysis of hospitalization for heart failure from cardiovascular outcomes trials with dipeptidyl peptidase-4 (DPP-4) inhibitors. Clin. Cardiol. 2022;45:794–801. https://doi.org/10.1002/clc.23844.
2. Nikolaidou A, Ventoulis I, Karakoulidis G et al. Hypoglycemic Drugs in Patients with Diabetes Mellitus and Heart Failure: A Narrative Review. Medicina (Kaunas). 2024;60(6):912. https://doi.org/10.3390/medicina60060912.
3. Crowley MJ, Gokhale M, Pate V et al. Impact of metformin use on the cardiovascular effects of dipeptidyl peptidase-4 inhibitors: An analysis of Medicare claims data from 2007 to 2015. Diabetes Obes Metab. 2019;21(4):854-865. https://doi.org/10.1111/dom.13589.
4. Razavi M, Wei YY, Rao XQ, Zhong JX. DPP-4 inhibitors and GLP-1RAs: cardiovascular safety and benefits. Military Med Res 9, 45 (2022). https://doi.org/10.1186/s40779-022-00410-2.
5. Crowley MJ, Williams JW Jr, Kosinski AS et al. Metformin Use May Moderate the Effect of DPP-4 Inhibitors on Cardiovascular Outcomes. Diabetes Care. 2017;40(12):1787-1789. https://doi.org/10.2337/dc17-1528.
6. Her AY, Choi BG, Rha SW et al. Korea Acute Myocardial Infarction Registry (KAMIR)-National Institutes of Health (NIH) investigators. Dipeptidyl peptidase-4 inhibitors versus sulfonylureas on the top of metformin in patients with diabetes and acute myocardial infarction. Cardiovasc Diagn Ther. 2024;14(1):38-50. https://doi.org/10.21037/cdt-23-349.
7. Koufakis T, Papanas N, Zebekakis P, Kotsa K. Treatment options following metformin in primary prevention populations with type 2 diabetes: which is the right road to take? Expert Rev Clin Pharmacol. 2021;14(10):1189-1192. https://doi.org/10.1080/17512433.2021.1942843.
8. Scheen AJ. Diabetes: Metformin - a cardiovascular moderator of DPP4 inhibitors? Nat Rev Endocrinol. 2018;14(1):8-9. https://doi.org/10.1038/nrendo.2017.154.
9. Baksh S, Wen J, Mansour O et al. Dipeptidyl peptidase-4 inhibitor cardiovascular safety in patients with type 2 diabetes, with cardiovascular and renal disease: a retrospective cohort study. Sci Rep. 2021;11(1):16637. https://doi.org/10.1038/s41598-021-95687-z.
10. Kwon CS, Seoane-Vazquez E, Rodriguez-Monguio R. Cost-effectiveness analysis of metformin+dipeptidyl peptidase-4 inhibitors compared to metformin+sulfonylureas for treatment of type 2 diabetes. BMC Health Serv Res. 2018;18(1):78. https://doi.org/10.1186/s12913-018-2860-0.
11. Tan WY, Hsu W, Lee ML, Tan NC. Predictors of HbA1c treatment response to add-on medication following metformin monotherapy: a population-based cohort study. Sci Rep. 2023;13(1):20891. https://doi.org/10.1038/s41598-023-47896-x.
12. Hsu WC, Lin CS, Chen JF, Chang CM. The Effects of Dipeptidyl Peptidase 4 Inhibitors on Renal Function in Patients with Type 2 Diabetes Mellitus. J Clin Med. 2022;11(9):2653. https://doi.org/10.3390/jcm11092653.
13. Goldney J, Sargeant JA, Davies MJ. Incretins and microvascular complications of diabetes: neuropathy, nephropathy, retinopathy and microangiopathy. Diabetologia. 2023;66(10):1832-1845. https://doi.org/10.1007/s00125-023-05988-3.
14. Krook A, Mulder H. Incretins: turning the venom into the antidote. Diabetologia 66, 1762–1764 (2023). https://doi.org/10.1007/s00125-023-05987-4.
15. Gallwitz B. Clinical Use of DPP-4 Inhibitors. Front Endocrinol (Lausanne). 2019;10:389. https://doi.org/10.3389/fendo.2019.00389.
16. Бондарь И. А., Гражданкина Д. В., Краснопевцева И. П. Вариабельность гликемии у больных сахарным диабетом 2-го типа. Лечащий Врач. 2024; 12 (27): 39-45. https://doi.org/10.51793/OS.2024.27.12.006.
17. Nicotera R, Casarella A, Longhitano E et al. Antiproteinuric effect of DPP-IV inhibitors in diabetic and non-diabetic kidney diseases. Pharmacol Res. 2020;159:105019. https://doi.org/10.1016/j.phrs.2020.105019.
18. Lyu YS, Oh S, Kim JH et al. Comparison of SGLT2 inhibitors with DPP-4 inhibitors combined with metformin in patients with acute myocardial infarction and diabetes mellitus. Cardiovasc Diabetol. 2023 Jul 22;22(1):185. https://doi.org/10.1186/s12933-023-01914-4. Erratum in: Cardiovasc Diabetol. 2023; 5;22(1):242. https://doi.org/10.1186/s12933-023-01960-y.
19. Xie Y, Bowe B, Xian H et al. Comparative effectiveness of SGLT2 inhibitors, GLP-1 receptor agonists, DPP-4 inhibitors, and sulfonylureas on risk of major adverse cardiovascular events: emulation of a randomised target trial using electronic health records. Lancet Diabetes Endocrinol. 2023;11(9):644-656. https://doi.org/10.1016/S2213-8587(23)00171-7.
20. Enzan N, Matsushima S, Kaku H et al. Beneficial Effects of Dipeptidyl Peptidase-4 Inhibitors on Heart Failure With Preserved Ejection Fraction and Diabetes. JACC Asia. 2023;3(1):93-104. https://doi.org/10.1016/j.jacasi.2022.09.015.
21. Caturano A, Vetrano E, Galiero R et al. Advances in the Insulin-Heart Axis: Current Therapies and Future Directions. Int J Mol Sci. 2024;25(18):10173. https://doi.org/10.3390/ijms251810173.
22. Yen FS, Chiang JH, Hwu CM et al. All-cause mortality of insulin plus dipeptidyl peptidase-4 inhibitors in persons with type 2 diabetes. BMC Endocr Disord. 2019;19(1):3. https://doi.org/10.1186/s12902-018-0330-7.
23. Choi Y, Ko SH, Chang K et al. Effect of dipeptidyl peptidase-4 inhibitor on the progression of coronary artery disease evaluated by computed tomography in patients receiving insulin therapy for type 2 diabetes mellitus. J Diabetes. 2023;15(11):944-954. https://doi.org/10.1111/1753-0407.
24. Yoshikawa F, Uchino H, Nagashima T et al. Dipeptidyl peptidase-4 inhibitor improves glycemic variability in multiple daily insulin-treated type 2 diabetes: a prospective randomized-controlled trial. Diabetol Int. 2021;13(1):124-131. https://doi.org/10.1007/s13340-021-00513-6.
25. Lin WQ, Cai ZJ, Chen T et al. Cost-Effectiveness of Dipeptidylpeptidase-4 Inhibitors Added to Metformin in Patients With Type 2 Diabetes in China. Front Endocrinol (Lausanne). 2021; 13;12:684960. https://doi.org/10.3389/fendo.2021.684960.
26. Yin R, Xu Y, Wang X et al. Role of Dipeptidyl Peptidase 4 Inhibitors in Antidiabetic Treatment. Molecules. 2022;27(10):3055. https://doi.org/10.3390/molecules27103055.
27. Kumar S, Mittal A, Mittal A. A review upon medicinal perspective and designing rationale of DPP-4 inhibitors. Bioorg Med Chem. 2021;46:116354. https://doi.org/10.1016/j.bmc.2021.116354.
28. Baziar L, Emami L, Rezaei Z et al. Design, synthesis, biological evaluation and computational studies of 4-Aminopiperidine-3, 4-dihyroquinazoline-2-uracil derivatives as promising antidiabetic agents. Sci Rep. 2024;14(1):26538. https://doi.org/10.1038/s41598-024-77481-9.
29. Rahim K, Shan M, Ul Haq I et al. Revolutionizing Treatment Strategies for Autoimmune and Inflammatory Disorders: The Impact of Dipeptidyl-Peptidase 4 Inhibitors. J Inflamm Res. 2024;17:1897-1917. https://doi.org/10.2147/JIR.S442106.
30. Kushwaha RN, Haq W, Katti SB. Sixteen-years of clinically relevant dipeptidyl peptidase-IV (DPP-IV) inhibitors for treatment of type-2 diabetes: a perspective. Curr Med Chem. 2014;21(35):4013-45. https://doi.org/10.2174/0929867321666140915143309.
31. Subrahmanyan NA, Koshy RM, Jacob K, Pappachan JM. Efficacy and Cardiovascular Safety of DPP-4 Inhibitors. Curr Drug Saf. 2021;16(2):154-164. https://doi.org/10.2174/1574886315999200819150544.
32. Esposito K, Chiodini P, Capuano A et al. Baseline glycemic parameters predict the hemoglobin A1c response to DPP-4 inhibitors : meta-regression analysis of 78 randomized controlled trials with 20,053 patients. Endocrine. 2014;46(1):43-51. https://doi.org/10.1007/s12020-013-0090-0.
33. Takamiya Y, Kobayashi K, Kudo T et al. Comprehensive Efficacy of the Dipeptidyl Peptidase 4 Inhibitor Alogliptin in Practical Clinical Settings: A Prospective Multi-Center Interventional Observational Study. J Clin Med Res. 2020;12(7):423-430. https://doi.org/10.14740/jocmr4224.
34. Feng J, Zhang Z, Wallace MB et al. Discovery of alogliptin: a potent, selective, bioavailable, and efficacious inhibitor of dipeptidyl peptidase IV. J Med Chem. 2007;50(10):2297-300. https://doi.org/10.1021/jm070104l.
35. Ueki K, Tanizawa Y, Nakamura J et al. Long-term safety and efficacy of alogliptin, a DPP-4 inhibitor, in patients with type 2 diabetes: a 3-year prospective, controlled, observational study (J-BRAND Registry). BMJ Open Diabetes Res Care. 2021;9(1):e001787. https://doi.org/10.1136/bmjdrc-2020-001787.
36. Takebayashi K, Suzuki T, Naruse R et al. Long-Term Effect of Alogliptin on Glycemic Control in Japanese Patients With Type 2 Diabetes: A 3.5-Year Observational Study. J Clin Med Res. 2017;9(9):802-808. https://doi.org/10.14740/jocmr3118w.
37. Петунина Н.А., Эльмурзаева Э.А., Хачатуров М.В. Сравнение эффективности ингибиторов дипептидилпептидазы 4 в достижении целевого уровня гликированного гемоглобина: систематический обзор и сетевой метаанализ. Эффективная фармакотерапия. 2024; 20 (13): 38–49. https://doi.org/10.33978/2307-3586-2024-20-13-38-49.
38. Nishimura R, Osonoi T, Koike Y et al. A Randomized Pilot Study of the Effect of Trelagliptin and Alogliptin on Glycemic Variability in Patients with Type 2 Diabetes. Adv Ther. 2019;36(11):3096-3109. https://doi.org/10.1007/s12325-019-01097-z.
39. Nodari S, Fioretti F, Barilla F. Redefining diabetes mellitus treatments according to different mechanisms beyond hypoglycaemic effect. Heart Fail Rev. 2023;28(3):607-625. https://doi.org/10.1007/s10741-021-10203-9.
40. Lu S, Wang Q, Lu H et al. Lipids as potential mediators linking body mass index to diabetes: evidence from a mediation analysis based on the NAGALA cohort. BMC Endocr Disord. 2024;24(1):66. https://doi.org/10.1186/s12902-024-01594-5.
41. Kutoh E, Kaneoka N, Hirate M. Alogliptin: a new dipeptidyl peptidase-4 inhibitor with potential anti-atherogenic properties. Endocr Res. 2015;40(2):88-96. https://doi.org/10.3109/07435800.2014.952743.
42. Nishida Y, Takahashi Y, Tezuka K et al. Comparative effect of dipeptidyl-peptidase 4 inhibitors on laboratory parameters in patients with diabetes mellitus. BMC Pharmacol Toxicol. 2020;21(1):28. https://doi.org/10.1186/s40360-020-00407-4.
43. Barchetta I, Cimini FA, Dule S, Cavallo MG. Dipeptidyl Peptidase 4 (DPP4) as A Novel Adipokine: Role in Metabolism and Fat Homeostasis. Biomedicines. 2022;10(9):2306. https://doi.org/10.3390/biomedicines10092306.
44. Kutoh E, Kuto AN et al. Alogliptin: a DPP-4 inhibitor modulating adipose tissue insulin resistance and atherogenic lipid. Eur J Clin Pharmacol. 2023;79(7):947-959. https://doi.org/10.1007/s00228-023-03506-3.
45. Okada K, Kikuchi S, Kuji S et al. Impact of early intervention with alogliptin on coronary plaque regression and stabilization in patients with acute coronary syndromes. Atherosclerosis. 2022;360:1-7. https://doi.org/10.1016/j.atherosclerosis.2022.09.005.
46. Duan L, Rao X, Xia C et al. The regulatory role of DPP4 in atherosclerotic disease. Cardiovasc Diabetol. 2017 Jun 15;16(1):76. https://doi.org/10.1186/s12933-017-0558-y.
47. Lv Q, Yang Y, Lv Y et al. Long-term effects of different hypoglycemic drugs on carotid intima-media thickness progression: a systematic review and network meta-analysis. Front Endocrinol (Lausanne). 2024;15:1403606. https://doi.org/10.3389/fendo.2024.1403606.
48. Wakasugi S, Mita T, Katakami N et al. Associations between continuous glucose monitoring-derived metrics and arterial stiffness in Japanese patients with type 2 diabetes. Cardiovasc Diabetol. 2021;20(1):15. https://doi.org/10.1186/s12933-020-01194-2.
49. Kishimoto S, Kinoshita Y, Matsumoto T et al. Effects of the Dipeptidyl Peptidase 4 Inhibitor Alogliptin on Blood Pressure in Hypertensive Patients with Type 2 Diabetes Mellitus. Am J Hypertens. 2019;32(7):695-702. https://doi.org/10.1093/ajh/hpz065.
50. Kato S, Fukui K, Kirigaya H et al. Inhibition of DPP-4 by alogliptin improves coronary flow reserve and left ventricular systolic function evaluated by phase contrast cine magnetic resonance imaging in patients with type 2 diabetes and coronary artery disease. Int J Cardiol. 2016;223:770-775. https://doi.org/10.1016/j.ijcard.2016.08.306.
51. Zhang J, Chen Q, Zhong J et al. DPP-4 Inhibitors as Potential Candidates for Antihypertensive Therapy: Improving Vascular Inflammation and Assisting the Action of Traditional Antihypertensive Drugs. Front Immunol. 2019;10:1050. https://doi.org/10.3389/fimmu.2019.01050.
52. Sano M. Mechanism by which dipeptidyl peptidase-4 inhibitors increase the risk of heart failure and possible differences in heart failure risk. J Cardiol. 2019;73(1):28-32. https://doi.org/10.1016/j.jjcc.2018.07.004.
53. Cao F, Wu K, Zhu YZ, Bao ZW. Roles and Mechanisms of Dipeptidyl Peptidase 4 Inhibitors in Vascular Aging. Front Endocrinol (Lausanne). 2021;12:731273. https://doi.org/10.3389/fendo.2021.731273.
54. Thanapairoje K, Junsiritrakhoon S, Wichaiyo S et al. Anti-ageing effects of FDA-approved medicines: a focused review. J Basic Clin Physiol Pharmacol. 2023;34(3):277-289. https://doi.org/10.1515/jbcpp-2022-0242.
55. Shestakova MV, Shestakova EA, Kachko VA. Specific features of the use of alogliptin in various groups of patients with type 2 diabetes mellitus: additional results of the ENTIRE study. Probl Endokrinol (Mosk). 2020;66(2):49-60. Russian. https://doi.org/10.14341/probl12273.
56. Ruyatkina LA, Ruyatkin DS, Shcherbakova LV, Iskhakova IS. Vector of glycated hemoglobin in the formation of dysglycemia in postmenopause: Emphasis on early diagnosis and therapy. Meditsinskiy sovet = Medical Council. 2024;(16):135-147. (In Russ.) https://doi.org/10.21518/ms2024-394
57. Sanches CP, Vianna AGD, Barreto,FdC. The impact of type 2 diabetes on bone metabolism. Diabetol Metab Syndr. 2017; 9:85. https://doi.org/10.1186/s13098-017-0278-1.
58. Yousefzadeh N, Jeddi S, Kashfi K, Ghasemi A. Diabetoporosis: Role of nitric oxide. EXCLI J. 2021; 20:764-780. https://doi.org/10.17179/excli2021-3541.
59. Martiniakova M, Mondockova V, Kovacova V et al. Interrelationships among metabolic syndrome, bone-derived cytokines, and the most common metabolic syndrome-related diseases negatively affecting bone quality. Diabetol Metab Syndr. 2024;16(1):217. https://doi.org/10.1186/s13098-024-01440-7.
60. Rinonapoli G, Pace V, Ruggiero C et al. Obesity and Bone: A Complex Relationship. Int J Mol Sci. 2021;22(24):13662. https://doi.org/10.3390/ijms222413662.
61. Sheu A, White CP, Center JR. Bone metabolism in diabetes: a clinician's guide to understanding the bone-glucose interplay. Diabetologia. 2024;67(8):1493-1506. https://doi.org/10.1007/s00125-024-06172-x.
62. Rhee EJ. Extra-Glycemic Effects of Anti-Diabetic Medications: Two Birds with One Stone? Endocrinol Metab (Seoul). 2022;37(3):415-429. https://doi.org/10.3803/EnM.2022.304.
63. Wikarek A, Grabarczyk M, Klimek K et al. Effect of Drugs Used in Pharmacotherapy of Type 2 Diabetes on Bone Density and Risk of Bone Fractures. Medicina (Kaunas). 2024;60(3):393. https://doi.org/10.3390/medicina60030393.
64. Zaki MK, Abed MN, Alassaf FA. Antidiabetic Agents and Bone Quality: A Focus on Glycation End Products and Incretin Pathway Modulations. J Bone Metab. 2024;31(3):169-181. https://doi.org/10.11005/jbm.2024.31.3.169.
65. Yang Q, Fu B, Luo D et al. The Multiple Biological Functions of Dipeptidyl Peptidase-4 in Bone Metabolism. Front Endocrinol (Lausanne). 2022; 13:856954. https://doi.org/10.3389/fendo.2022.856954.
66. Prasad TN, Arjunan D, Pal R, Bhadada SK. Diabetes and Osteoporosis. Indian J Orthop. 2023;57(Suppl 1):209-217. https://doi.org/10.1007/s43465-023-01049-4.
67. Viggers R, Rasmussen NH, Vestergaard P. Effects of Incretin Therapy on Skeletal Health in Type 2 Diabetes-A Systematic Review. JBMR Plus. 2023;7(11):e10817. https://doi.org/10.1002/jbm4.10817.
68. Chang CH, Lu CH, Chung CH et al. Dipeptidyl peptidase-4 inhibitors attenuates osteoporosis in patients with diabetes: A nationwide, retrospective, matched-cohort study in Taiwan. J Chin Med Assoc. 2022;85(7):747-753. https://doi.org/10.1097/JCMA.0000000000000743.
69. Yang J, Huang C, Wu S et al. The effects of dipeptidyl peptidase-4 inhibitors on bone fracture among patients with type 2 diabetes mellitus: A network meta-analysis of randomized controlled trials. PLoS One. 2017;12(12):e0187537. https://doi.org/10.1371/journal.pone.0187537.
70. Huang CF, Mao TY, Hwang SJ. The Effects of Switching from Dipeptidyl Peptidase-4 Inhibitors to Glucagon-Like Peptide-1 Receptor Agonists on Bone Mineral Density in Diabetic Patients. Diabetes Metab Syndr Obes. 2023;16:31-36. https://doi.org/10.2147/DMSO.S389964.
71. Hansen MSS, Tencerova M, Frølich J et al. Effects of gastric inhibitory polypeptide, glucagon-like peptide-1 and glucagon-like peptide-1 receptor agonists on Bone Cell Metabolism. Basic Clin Pharmacol Toxicol. 2018;122(1):25-37. https://doi.org/10.1111/bcpt.12850.
72. Pechmann LM, Pinheiro FI, Andrade VFC, Moreira CA. The multiple actions of dipeptidyl peptidase 4 (DPP-4) and its pharmacological inhibition on bone metabolism: a review. Diabetol Metab Syndr. 2024;16(1):175. https://doi.org/10.1186/s13098-024-01412-x.
73. Gurgel Penaforte-Saboia J, Couri CEB, Vasconcelos Albuquerque N et al. Emerging Roles of Dipeptidyl Peptidase-4 Inhibitors in Delaying the Progression of Type 1 Diabetes Mellitus. Diabetes Metab Syndr Obes. 2021;14:565-573. https://doi.org/10.2147/DMSO.S294742.
74. Shao S, Xu Q, Yu X et al. Dipeptidyl peptidase 4 inhibitors and their potential immune modulatory functions. Pharmacol Ther. 2020;209:107503. https://doi.org/10.1016/j.pharmthera.2020.107503.
75. Buzzetti R, Tuomi T, Mauricio D et al. Management of Latent Autoimmune Diabetes in Adults: A Consensus Statement From an International Expert Panel. Diabetes. 2020;69(10):2037-2047. https://doi.org/10.2337/dbi20-0017.
76. Koufakis T, Zografou I, Doumas M, Kotsa K. The Current Place of DPP4 Inhibitors in the Evolving Landscape of Type 2 Diabetes Management: Is It Time to Bid Adieu? Am J Cardiovasc Drugs. 2023;23(6):601-608. https://doi.org/10.1007/s40256-023-00610-8.
77. Osawa S, Kawamori D, Katakami N et al. Significant elevation of serum dipeptidyl peptidase-4 activity in young-adult type 1 diabetes. Diabetes Res Clin Pract. 2016;113:135–142. https://doi.org/10.1016/j.diabres.2015.12.022.
78. Pinheiro MM, Pinheiro FMM. Type 1 diabetes prevention and treatment: Time to think outside the box. J Diabetes. 2023;15(12):1107-1108. https://doi.org/10.1111/1753-0407.13502.
79. Yan X, Li X, Liu B et al. Combination therapy with saxagliptin and vitamin D for the preservation of β-cell function in adult-onset type 1 diabetes: a multi-center, randomized, controlled trial. Signal Transduct Target Ther. 2023;8(1):158. https://doi.org/10.1038/s41392-023-01369-9.
80. Rabinovitch A, Koshelev D, Lagunas-Rangel FA et al. Efficacy of combination therapy with GABA, a DPP-4i and a PPI as an adjunct to insulin therapy in patients with type 1 diabetes. Front Endocrinol (Lausanne). 2023; 14:1171886. https://doi.org/10.3389/fendo.2023.1171886.
81. Penaforte-Saboia JG, Couri CEB, Albuquerque NV et al. PRE1BRAZIL Protocol: A Randomized Controlled Trial to Evaluate the Effectiveness and Safety of the DPP-4 Inhibitor Alogliptin in Delaying the Progression of Stage 2 Type 1 Diabetes. Diabetes Metab Syndr Obes. 2024;17:857-864. https://doi.org/10.2147/DMSO.S437635.
82. Jia L, Huang S, Sun B et al. Pharmacomicrobiomics and type 2 diabetes mellitus: A novel perspective towards possible treatment. Front Endocrinol (Lausanne). 2023 Mar 23;14:1149256. https://doi.org/10.3389/fendo.2023.1149256.
83. Liao X, Song L, Zeng B et al. Alteration of gut microbiota induced by DPP-4i treatment improves glucose homeostasis. EBioMedicine. 2019; 44:665-674. https://doi.org/10.1016/j.ebiom.2019.03.057.
84. Busek P, Duke-Cohan JS, Sedo A. Does DPP-IV Inhibition Offer New Avenues for Therapeutic Intervention in Malignant Disease? Cancers (Basel). 2022;14(9):2072. https://doi.org/10.3390/cancers14092072.
85. Buczyńska A, Kościuszko M, Krętowski AJ, Popławska-Kita A. Exploring the clinical utility of DPP-IV and SGLT2 inhibitors in papillary thyroid cancer: a literature review. Front Pharmacol. 2024;15:1323083. https://doi.org/10.3389/fphar.2024.1323083.
86. Sharma A, Virmani T, Sharma A et al. Potential Effect of DPP-4 Inhibitors Towards Hepatic Diseases and Associated Glucose Intolerance. Diabetes Metab Syndr Obes. 2022;15:1845-1864. https://doi.org/10.2147/DMSO.S369712.
87. Tuersun A, Hou G, Cheng G. Pancreatitis and Pancreatic Cancer Risk Among Patients With Type 2 Diabetes Receiving Dipeptidyl Peptidase 4 Inhibitors: An Updated Meta-Analysis of Randomized Controlled Trials. Clin Ther. 2024: S0149-2918(24)00190-5. https://doi.org/10.1016/j.clinthera.2024.06.015.
88. Salama RM, Mohamed AM, Hamed NS et al. Alogliptin: a novel approach against cyclophosphamide-induced hepatic injury via modulating SIRT1/FoxO1 pathway. Toxicol Res (Camb). 2020;9(4):561-568. https://doi.org/10.1093/toxres/tfaa059.
89. Salama RM, Nasr MM, Abdelhakeem JI et al. Alogliptin attenuates cyclophosphamide-induced nephrotoxicity: a novel therapeutic approach through modulating MAP3K/JNK/SMAD3 signaling cascade. Drug Chem Toxicol. 2022;45(3):1254-1263. https://doi.org/10.1080/01480545.2020.1814319.
90. Alsemeh AE, Abdullah DM. Protective effect of alogliptin against cyclophosphamide-induced lung toxicity in rats: Impact on PI3K/Akt/FoxO1 pathway and downstream inflammatory cascades. Cell Tissue Res. 2022;388(2):417-438. https://doi.org/10.1007/s00441-022-03593-1.
91. Meng J, Yan R, Zhang C et al. Lipids Health Dis. 2023;22(1):219. https://doi.org/10.1186/s12944-023-01985-y.
92. Jiang X, Li J, Yao X, Ding H, Gu A, Zhou Z. Neuroprotective effects of dipeptidyl peptidase 4 inhibitor on Alzheimer's disease: a narrative review. Front Pharmacol. 2024;15:1361651. https://doi.org/10.3389/fphar.2024.1361651.
93. Ngetich E, Lapolla P, Chandrashekar A et al. The role of dipeptidyl peptidase-IV in abdominal aortic aneurysm pathogenesis: A systematic review. Vasc Med. 2022;27(1):77-87. https://doi.org/10.1177/1358863X211034574.
Об авторах
Л. А. РуяткинаРоссия
Руяткина Людмила Александровна, д.м.н., профессор
630091, г. Новосибирск, Красный проспект, д. 52
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Д. С. Руяткин
Россия
Руяткин Дмитрий Сергеевич, к.м.н., доцент
Новосибирск
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Дополнительные файлы
|
|
1. Рисунок 1. Потенциальные механизмы ингибиторов дипептидилпептидазы-4 в регуляции артериального давления. Адаптировано по Zhang J. с соавт. [51]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Участие дипептидилпептидазы-4 в многочисленных физиологических и патологических процессах. Адаптировано по Ngetich E. и соавт. [93]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(766KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Руяткина Л.А., Руяткин Д.С. Спектр эффектов ингибиторов дипептидилпептидазы-4: внутри и за пределами гликемического контроля (часть 2). Сахарный диабет. 2025;28(5):451-459. https://doi.org/10.14341/DM13343
For citation:
Ruyatkina L.A., Ruyatkin D.S. Spectrum of effects of dipeptidyl peptidase-4 inhibitors: within and beyond glycemic control (part 2). Diabetes mellitus. 2025;28(5):451-459. (In Russ.) https://doi.org/10.14341/DM13343

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































