Перейти к:
Значение окисленных липопротеинов низкой плотности и их рецепторов LOX-1 при сахарном диабете 2 типа
https://doi.org/10.14341/DM13203
Аннотация
АКТУАЛЬНОСТЬ. Сахарный диабет 2 типа (СД2) встречается у 8,5% взрослого населения с тенденцией к увеличению, способствует утяжелению коморбидного фона пациента, приводит к инвалидизации. Возможной персонификации лечения СД2 могут способствовать высокоинформативные прогностические биомаркеры, поиск которых продолжает оставаться актуальным. Характерной особенностью СД2 является дислипидемия. Одним из ее проявлений является накопление в циркуляции повышенной концентрации окисленных липопротеинов низкой плотности (ox-LDL). Специфическими клеточными рецепторами молекул ox-LDL являются рецепторы LOX-1.
ЦЕЛЬ ОБЗОРА. Суммировать результаты исследований, представленных в публикациях 2010–2024 гг. (PubMed, RSCI) и свидетельствующих о патогенетической роли ox-LDL и их рецепторов LOX-1 в развитии и течении СД2.
МАТЕРИАЛЫ И МЕТОДЫ. Провели поиск более 2800 источников литературы (PubMed), в которых вместе с термином «сахарный диабет», встречаются ключевые слова: ox-LDL (1150 источников) или LOX-1 (159 источников), а также OLR1 (106 источников). Выделили более 60 источников, имеющих непосредственное отношение к СД2 и исследуемым функционально связанным маркерам — рецептору LOX-1 и его лиганду ox-LDL.
РЕЗУЛЬТАТЫ. LOX-1 представляет собой рецептор-мусорщик, который использует ox-LDL в качестве основного лиганда. LOX-1 кодируется геном OLR1, расположенным на хромосоме 12 человека. Продукты гена OLR1 характеризуются наличием изоформ, генерируемых в результате сплайсинга или однонуклеотидного полиморфизма. Взаимосвязь ox-LDL и СД2 имеет двунаправленный характер. Возникающая инсулинорезистентность прямо коррелирует со степенью окисления липопротеинов низкой плотности, которая наблюдается более чем у 80% больных и зависит от длительности СД2. Высокое содержание лиганда LOX-1 ox-LDL в плазме ассоциируется с увеличением риска СД2. Предполагается, что механизм такой ассоциации связан с функционально значимой экспрессией LOX-1 на клетках поджелудочной железы. Показано, что β-клетки поджелудочной железы в присутствии ox-LDL увеличивали продукцию индуцируемого раннего репрессора сигнального пути цАМФ — ICER. В результате действия ICER выработка и секреция инсулина прекращались. Увеличение концентрации ox-LDL является патогенетически значимым фактором развития атеросклеротических поражений сосудов, поскольку стимулирует генерацию пенистых клеток. ox-LDL-LOX-1-опосредованные взаимодействия на поверхности сосудов приводят к дисфункции эндотелия с последующим развитием гипоперфузии тканей и органных нарушений.
ЗАКЛЮЧЕНИЕ. Циркулирующий ox-LDL во взаимодействии с его рецептором LOX-1 вносит значительный вклад в развитие СД2, способствуя его прогрессированию. Увеличенная концентрация ox-LDL в циркуляторном русле повышает риск тяжелого течения СД2, приводя к дисфункции эндотелия и способствуя развитию атеросклеротического поражения сосудов.
Ключевые слова
Для цитирования:
Фетлам Д.Л., Чумаченко А.Г., Писарев В.М. Значение окисленных липопротеинов низкой плотности и их рецепторов LOX-1 при сахарном диабете 2 типа. Сахарный диабет. 2024;27(6):589-597. https://doi.org/10.14341/DM13203
For citation:
Fetlam D.L., Chumachenko A.G., Pisarev V.M. The Significance of Oxidized Low-Density Lipoproteins and Receptors LOX-1 in Type 2 Diabetes Mellitus. Diabetes mellitus. 2024;27(6):589-597. (In Russ.) https://doi.org/10.14341/DM13203
ВВЕДЕНИЕ
Распространение сахарного диабета (СД) среди взрослого населения в мире возросло с 4,7% в 1980 г. до 8,5% в 2014 г. с сохранением тенденции к увеличению [1]. По прогнозам, его распространенность к 2030 г. может достичь 552 млн человек [2]. У 90–95% взрослых с диабетом диагностируют СД 2 типа (СД2), который является наиболее распространенным заболеванием у пожилых людей (до 40% населения старше 65 лет) [3]. СД2 и его осложнения создают дополнительную нагрузку на здравоохранение во всех странах мира. В РФ численность пациентов с СД2 в 2021 г. составила 4,58 млн человек, при этом тренд к увеличению распространенности заболевания сохранился [4]. Высокая смертность при СД2 связана с выраженной коморбидностью, обусловленной преимущественно (свыше 50%) сердечно-сосудистыми заболеваниями (ССЗ) [4][5][6]. Острый инфаркт миокарда (ОИМ) является наиболее частой причиной смерти среди больных СД2, встречается в 3 раза чаще, чем без него, и отличается большей тяжестью течения, возникает у более молодых пациентов, что обусловлено комплексом факторов [7]. Поражение сосудов при СД обусловливает значительное снижение компенсаторных реакций организма. Это может снижать эффективность лечения, замедлять процесс выздоровления, приводить к переходу острого критического состояния в хроническое [8].
Другие сопутствующие заболевания также связаны с СД2: недавняя эпидемия COVID-19 вскрыла двунаправленные взаимодействия между СД2 и COVID-19 [9]. С одной стороны, описаны случаи развития СД2 вскоре после заражения SARS-CoV-2; с другой — COVID-19 протекал наиболее тяжело у пациентов с СД2 [10]. Сочетание COVID-19 и СД2 приводило к наибольшей летальности при дополнительных демографических и клинических параметрах (мужской пол, пожилой возраст, продолжительность СД более 10 лет, повышенный индекс массы тела (ИМТ) — свыше 30 кг/м², наличие атеросклеротических поражений сосудов) [11].
Одним из распространенных патогенетических факторов, связанных с развитием СД2, является дислипидемия. Являясь информативным биомаркером тяжести течения заболевания, дислипидемия ассоциируется и с развитием ССЗ [12]. Образ жизни, характер питания способствуют проявлению наследственных факторов, вклад которых в развитие СД2 составляет до 40% [13]. Некоторые особенности дислипидемии при СД2 носят наследственный характер и подробно исследуются в настоящее время [9]. Другие варианты исследованы недостаточно, и их потенциальный вклад в патогенез СД2 пока недостаточно оценен. К таким вариантам дислипидемий, ассоциированным с СД2 и с ССЗ, относится увеличение содержания в крови окисленных форм липопротеина низкой плотности (oxidized low density lipoprotein, ox-LDL).
ВКЛАД OX-LDL В РАЗВИТИЕ СД2
Ox-LDL и СД2 связаны двунаправленно. С одной стороны, степень окисления липопротеинов низкой плотности (low density lipoprotein, LDL) зависит от выраженности метаболического синдрома и длительности заболевания. С другой стороны, повышенная концентрация ox-LDL связана с повышенным риском возникновения СД2 из-за его воздействия на β-клетки [14].
Резистентность к инсулину способствует липолизу триглицеридов в адипоцитах и высвобождению свободных жирных кислот (СЖК) в кровоток. СЖК, поглощаемые гепатоцитами, включаются в метаболизм с образованием молекул липопротеинов очень низкой плотности (very low density lipoprotein, VLDL) [11]. Последующие превращения богатых триглицеридами VLDL под действием ферментов — белка-переносчика эфира холестерина, печеночной липазы и липопротеинлипазы способствует образованию высокоатерогенных электроотрицательных молекул LDL (sdLDL) [15]. Эти частицы долго циркулируют, в большей степени подвергаются модификациям — окислению и гликированию, легко образуют связи с протеогликанами в стенке артериального сосуда. Взаимодействие sdLDL с β2-гликопротеином I приводит к образованию провоспалительных комплексов, способных индуцировать аутоиммунные реакции. С другой стороны, развитие резистентности к инсулину при СД2 ассоциируется со снижением аффинности рецепторов LDL [16][17]. Как правило, диабетическая дислипидемия характеризуется низким уровнем липопротеидов высокой плотности (high density lipoproteins, HDL), гипертриглицеридемией и повышенной концентрацией sdLDL в плазме [18].
Окисление частиц LDL и sdLDL происходит с участием ферментов или неферментативным путем. К основным ферментам, активность которых приводит к окислению этих молекул, относятся миелопероксидаза, липоксигеназа, циклооксигеназа, цитохром Р450-зависимая оксигеназа [19][20][21]. Миелопероксидаза — единственный фермент у человека, образующий слабую хлорноватистую кислоту (HOCL). При ее диссоциации образуются ионы гипохлорита, окисляющие LDL/sdLDL [19]. Липоксигеназы, в том числе 5-липооксигеназа и 12/15-липооксигеназа, участвуют в окислении циркулирующих частиц LDL/sdLDL, способствуя атерогенезу [20]. НАДФН-оксидаза, образуя активные формы кислорода (АФК), потенциально тоже может участвовать в окислении частиц LDL, однако до сих пор доказательной базы для такого механизма не существует, несмотря на то, что взаимосвязь между двумя системами — oxLDL-LOX-1 и НАДФН-оксидазными комплексами NOX (преимущественно, NOX-2, NOX-4) — хорошо известна и подробно описана [22][23]. Пока сведения о механизмах окисления основываются на том, что наиболее чувствительными к окислению являются полиненасыщенные жирные кислоты в составе LDL/sdLDL, и основными ферментами, опосредующими их окисление, являются липоксигеназы, циклооксигеназы и цитохром Р450-зависимой оксигеназа [21].
Неферментативные пути окисления LDL/sdLDL определяются участием свободных ионов переходных металлов в катализе перекисного окисления липидов. Наиболее распространенными являются те, которые инициируются радикальной системой O2: перекись водорода, гидроксил NO и нерадикальными АФК (синглетный кислород и озон) [24]. Степень модификации LDL прямо пропорциональна скорости продукции O2 клетками. Гладкомышечные клетки артерий генерируют O2-модифицированные LDL, что приводит к их повышенному поглощению макрофагами и, таким образом, к образованию пенистых клеток и атерогенезу [14].
Процесс гликирования связан с аминокислотой ApoВ-100 лизином, которая подвергается гликированию в 2–17% случаев. Остаток лизина необходим для специфического распознавания рецепторов LDL. Гликирование этой аминокислоты способствует увеличению среднего периода полужизни гликированных LDL [25].
В результате структурных изменений при окислении у частиц ox-LDL, в отличие от исходных немодифицированных частиц, отсутствует способность связываться с рецепторами LDL. Зато появляется высокая аффинность к рецепторам-«мусорщикам» (скавенжерам) SR-A, SR-BI, CD36 и LOX- 1; взаимодействие последнего с лигандом инициирует сигнальные механизмы, активирующие Akt, JNK, Wnt и NF-kB [26][27], p38/MAPK/NF-kappaB [28]. Интересно, что запуск таких путей через LOX-1 приводит к образованию активных радикалов кислорода, которые способны и окислить LDL, и усилить экспрессию гена его рецептора, LOX-1. Такое взаимное усиление обеспечивает роль этой пары лиганд-рецептор — ox-LDL и LOX-1 — в патогенезе атеросклеротического поражения сосудов с образованием бляшек, развитием эндотелиальной дисфункции [29].
Безусловно, только таким взаимодействием не исчерпывается патогенетическая роль липидов при СД2. Изменение всего липидома при СД2 также имеет значение для патогенеза СД. Насыщенные жирные кислоты и специфические сфинголипиды, которые являются предшественниками церамидов, участвуют в построении клеточных мембран, регуляции апоптоза и в дифференцировке клеток [30][31]. Повышенная концентрация частиц LDL, модифицированных церамидом, при СД2 ассоциируются с тяжестью резистентности к инсулину и увеличением содержания ключевого провоспалительного цитокина — фактора некроза опухоли [32][33][34].
ГЕН OLR1 И ЕГО ПРОДУКТ LOX-1
LOX-1 представляет собой рецептор-«мусорщик», который использует ox-LDL в качестве основного лиганда. У человека белок LOX-1 кодируется геном OLR1, расположенным в дистальном отделе области 12р13.2-р12.3 короткого плеча хромосомы 12. Близость генетической структуры OLR1 к гену рецептора естественных клеток-киллеров (NK-клеток) и локализации в комплексе, кодирующем белки NK клеток, функциональная значимость его экспрессии в иммунных клетках указывают на то, что ген OLR1 относится к генам иммунной системы. Существуют различные варианты продуктов гена OLR1 — изоформы, индуцированные сплайсингом или однонуклеотидными полиморфизмами (SNP). Экспрессия этих изоформ оказывает различное влияние на развитие атеросклероза и сердечно-сосудистых заболеваний [35]. В частности, LOXIN, изоформа, лишенная части функционального домена, играет важную роль в защите от атеросклероза [36].
Существуют данные о благоприятном гаплотипе, при котором экспрессия LOXIN увеличена. Макрофаги, несущие этот гаплотип в гене OLR1, имеют повышенную экспрессию мРНК и белка LOXIN, что приводит к значительному снижению апоптоза в ответ на oxLDL. Данные о том, что повышение уровня LOXIN защищает клетки от апоптоза, вызванного LOX-1, закладывает основу для разработки терапевтических подходов для предотвращения нестабильности бляшек [37].
Лектиновый домен, который также называют доменом распознавания углеводов (CTLD), является функциональным доменом связывания LOX-1, участвующим в связывании отрицательно заряженных лигандов, таких как ox-LDL [38]. CTLD представляет собой спиральную структуру из 130 остатков в форме сердца, образованную антипараллельными β-листами, окруженными α-спиралями и стабилизированную 3 внутрицепочечными дисульфидными связями. Мономеры CTLD связаны 6 высококонсервативными цистеиновыми остатками, образующими межцепочечную дисульфидную связь, что способствует формированию центрального гидрофобного туннеля, охватывающего весь белок. Стороны этого туннеля окружены неполярными аминокислотами, такими как тирозин, что позволяет туннелю переносить липиды [39][40]. Другим функционально важным доменом LOX-1 является домен NECK. Домен NECK имеет проксимальную N-концевую часть, участвующую в высвобождении растворимой части молекулы — sLOX1 (примембранный участок белка LOX-1, высвобождающийся после расщепления протеазами), и дистальную часть, участвующую во взаимодействиях с CTLD, которые повышают его стабильность [39].
ТРАНСКРИПЦИЯ И СИГНАЛИНГ LOX-1
Низкий в обычных физиологических условиях, уровень экспрессии OLR1 и трансляция белка LOX-1 значительно повышается при воспалении и при атерогенезе [41]. Это происходит в результате связывания ведущего молекулярного компонента воспалительных реакций — транскрипционного фактора NF-kB с промоторной областью гена OLR1 [42][43]. Другие лиганды LOX-1 — белки L5, С-реактивный белок (СРБ), del-1, ряд гликированных белков [42]. Белок L5 обладает выраженным отрицательным зарядом, относится к LDL, обладает наибольшим проатерогенным действием [44]. Сторона связывания лиганда (B-сторона) СРБ связываясь с рецептором LOX-1, инициирует активацию А-стороны СРБ, что определяет запуск C1q-опосредованной активации системы комплемента. Это усиливает экспрессию гена OLR1 и вносит вклад в дальнейшем поглощении oxLDL. Важным патогенетическим элементом нарушения функционирования эндотелиальных клеток при воздействии циркулирующих ox-LDL является фосфолипид-связывающий домен. После связывания с ним oxLDL приобретает способность к ингибиции экспрессии эндотелина-1, моноцитарного хемоаттрактантного белка-1 и молекулы внутриклеточной адгезии-1 в эндотелиальных клетках.
Ox-LDL индуцирует экспрессию LOX-1 через последовательность транскрипционного фактора Oct-1 в положении −1556 нуклеотидов в промоторной области OLR1. Последующее увеличение числа рецепторов LOX-1 и их связывание лигандом ox-LDL запускает положительную обратную связь, увеличивая дальнейшую экспрессию LOX-1. Также ox-LDL индуцирует NF-κB, и нуклеотидный мотив NF-κB присутствуют в промоторе LOX-1.
Есть данные, что субъединица p65 NF-κB специфически взаимодействует с N-концевой частью Oct-1 (аминокислоты 1–270). Однако Oct-1 подавляет активацию NF-κB. Это ингибирование отражает антиатерогенную роль Oct-1, противоположную роли Oct-1 в проатерогенном усилении экспрессии LOX-1. Так как увеличение экспрессии LOX-1 посредством ox-LDL вносит решающий вклад в атерогенез, то транскрипционный фактор Oct-1 является важным фактором в его уменьшении.
Ангиотензин II (Ang II) является одним из важных регуляторов ренин-ангиотензиновой системы и стимулятором LOX-1. Ang II увеличивает экспрессию LOX-1 через нуклеотидный мотив NF-κB в положении nt −2158 промоторной области [45].
Эпигенетические механизмы, такие как модификация ДНК/комплекса ДНК-белок и некодирующие микроРНК, могут контролировать экспрессию LOX-1 на транскрипционном и посттранскрипционном уровнях соответственно. Модификация ДНК с помощью метилирования/деметилирования и ацетилирования/деацетилирования гистонов сиртуинами происходит путем добавления метильных групп к цитозиновым нуклеотидам в CpG-группах внутри промоторной области: в результате предотвращается транскрипция гена [41]. Транскрипция генов может предотвращаться и в случае деацетилирования гистоновых и негистоновых ядерных белков. Так, экспрессии гена RelA/p65-NF-kB, контролирующего синтез ключевого транскрипционного фактора NFkB, инициирующего экспрессию гена LOX-1, не происходит при деацетилировании ядерного белка, вызванного взаимодействием с сиртуином-1 (SIRT-1) [42]. Посттранскрипционная (трансляционная) регуляция активности гена LOX-1 осуществляется с помощью микроРНК (miRNA) — miR-155 и let-7g [43], а также miR-590-5P [44], специфически связывающегося c сайтом области 3’-UTR гена OLR1 [46]. Экспериментальное моделирование атеросклероза с использованием мышей с нокаутом по атерогенному гену Apo-/- выявило выраженный терапевтический эффект (снижение содержания липидов и провоспалительных цитокинов, уменьшение размера атеросклеротических бляшек) при внутривенном введении miR-590-5P [47].
Интересно, что те же miRNA let-7g, контролирующие экспрессию гена LOX-1, ассоциируются с экспрессией генов метаболизма глюкозы, воспаления и окислительного стресса в жировой ткани женщин с СД2 [48]. Продукция miRNA let-7g значительно подавлялась при действии эндотелина-1, содержание которого в плазме больных СД2 положительно коррелировало с концентрацией гликированного гемоглобина и продолжительностью течения болезни [49]. В культуре адипоцитов и миоцитов показали, что подавление продукции miRNA let-7g при воздействии эндотелина-1 сопровождалось увеличением содержания провоспалительных цитокинов — интерлейкина-6 и фактора некроза опухоли вследствие активации сигнального пути NFkB [49].
Исследования связи другого фактора регуляции экспрессии гена LOX-1 — молекул микроРНК miR155 при СД2 показали, что нарушение продукции miR155 ассоциировалось с развитием таких осложнений, как ретинопатия, нейропатия и нефропатия [50]. Роль этого фактора регуляции метаболизма трудно переоценить — описаны выраженные эффекты miR155 в отношении регуляции сигналинга инсулина, сохранения гомеостаза глюкозы, развития резистентности к инсулину [51]. Наконец, третий регулятор экспрессии LOX-1 — микроРНК miR-590-5P — тоже вовлечен в патогенез СД, участвуя в патогенезе диабетического остеопороза: показали, что его высокая экспрессия усиливала рост и дифференцировку остеобластов [52].
Изложенные факты подтверждают общность молекулярных механизмов, лежащих в основе патогенетически значимых нарушений с участием miRNA, общих для СД2, гипервоспалительных реакций и атеросклероза. По-видимому, множественность и патогенетическая значимость эффектов молекул miRNA лежит в основе их роли в развитии СД и его осложнений.
ПАТОГЕНЕТИЧЕСКАЯ ЗНАЧИМОСТЬ ВЗАИМОДЕЙСТВИЯ Ox-LDL — LOX-1 ПРИ СД2
Ox-LDL способствуют прогрессированию СД2 различными путями. β-клетки в присутствии ox-LDL увеличивали количество ICER, что препятствовало выработке и секреции инсулина. ICER — индуцируемый ранний репрессор сигнального пути цАМФ [53].
LOX-1 обнаруживают в эндотелиальных клетках, в которых он осуществляет свое участие в патогенезе диабетической васкулопатии [54]. Эндотелиальная дисфункция является одним из первых проявлений СД2 и ССЗ. Воздействие гипергликемии на эндотелиальные клетки сопровождается повышением их проницаемости и способствует субэндотелиальному накоплению модифицированных LDL [55].
Последующие эффекты ox-LDL, опосредованные взаимодействием с рецептором LOX-1 в клетках эндотелия, гладкомышечных клетках или клетках иммунной системы происходят в результате активации NADPH оксидазы (NOX) с последующей генерацией ею реактивных радикалов кислорода, активирующих транскрипционный фактор NFkB — ключевой регулятор экспрессии гена OLR1 (рис. 1) [56]. При патогенетически значимом выраженном воспалительном компоненте, в том числе при СД, окислительный стресс в клетках приводит к индукции нескольких сигнальных путей, запускающих продукцию и активацию и других транскрипционных факторов — OCT1, PPAR-gamma, AP-1, HIF1, усиливающих транскрипцию OLR1 [57]. С другой стороны, оксидантный стресс активирует сигнальные пути с участием PI3K/Akt, MAPK (p38, ERK и JNK), PKA, PKC, PTK и p66Shc), которые дополнительно активируют NFkB, увеличивающего экспрессию LOX-1; это приводит к дальнейшему усилению передачи сигналов с данного рецептора, увеличению продукции металлопротеиназ ММР-2 и ММР-9), развитию эндотелиальной дисфункции и индукции апоптоза клеток эндотелия [38][58].
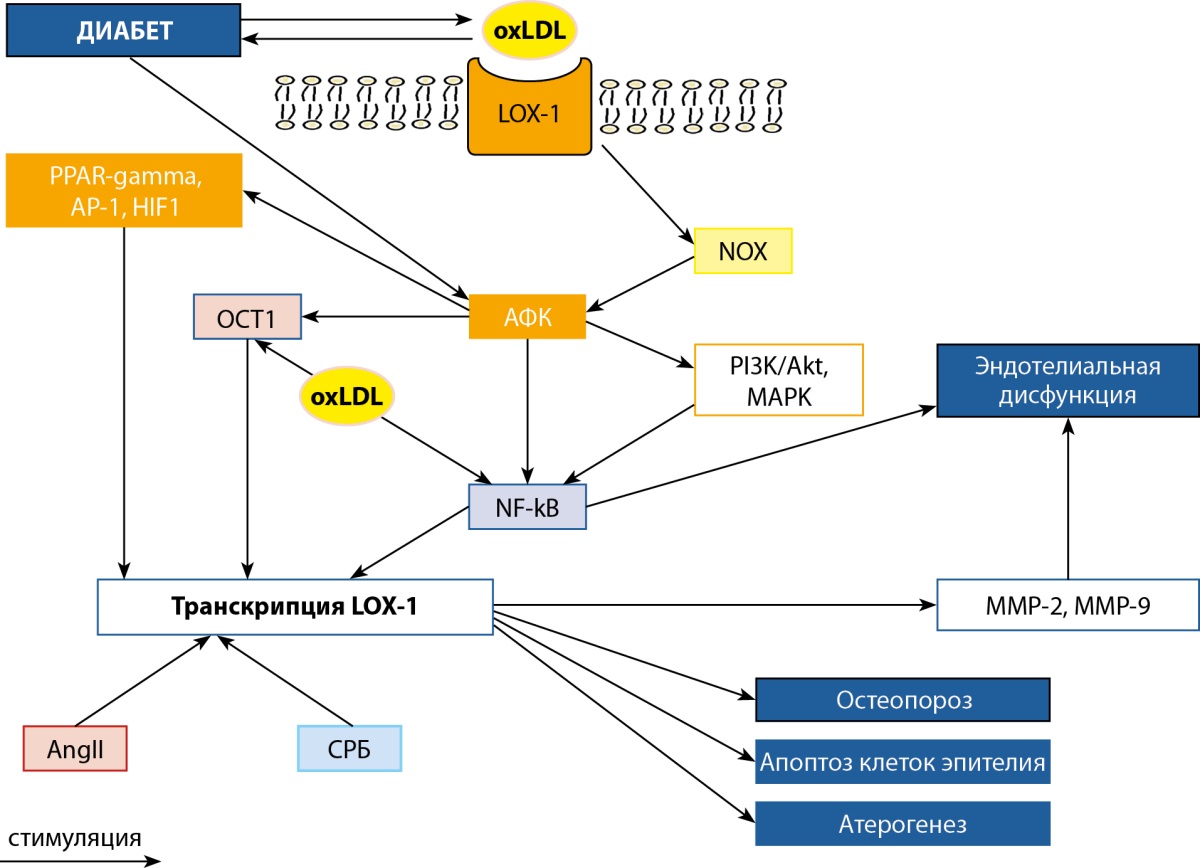
Рисунок 1. Схема взаимодействия ox-LDL с LOX-1.
Примечание. LOX1 — лектиноподобный окисленный рецептор липопротеина низкой плотности 1 (Lectin Like Oxidized Low Density Lipoprotein Receptor 1); oxLDL — окисленный липопротеин низкой плотности (Oxidized Low Density Lipoprotein); NOX — NADPH-оксидаза (NADPH (nicotinamide adenine dinucleotide phosphate hydrogen) oxidase); PI3K/Akt — сигнальный путь PI3K (фосфатидилинозитол3-киназа) — Akt (протеинкиназа B) (PI3K (Phosphoinositide 3-kinases)-Akt (RAC-alpha serine/threonine-protein kinase, Protein kinase B alpha) signaling pathway); MAPK — митоген-активируемая протеинкиназа (mitogen-activated protein kinase); NFkB — ядерный фактор «каппа-B» (nuclear factor kappa-light-chain-enhancer of activated B cells); OCT1 — октамерный транскрипционный фактор-1 (Octamer transcription factor 1); PPAR-gamma — рецептор, активируемый пероксисомным пролифератором гамма (Peroxisome proliferator-activated receptor gamma); AP-1 — трансрипционный фактор активирующий белок-1 (activating protein-1); HIF1 — фактор, индуцируемый гипоксией 1-альфа (Hypoxia-inducible factor 1-alpha); АФК — активные формы кислорода; ММР-2 — матриксная металлопротеиназа 2 (Matrix Metalloproteinase 2); ММР-9 — матриксная металлопротеиназа 9 (Matrix Metalloproteinase 9); Диабет — сахарный диабет; СРБ — С-реактивный белок; Ang II — ангиотензин II.
Повышенное образование ox-LDL у больных СД способствует прогрессированию заболевания. Механизм прогрессирования связан не только с обсуждаемыми выше сигнальными путями, активируемыми ox-LDL/LOX-1 в клетках эндотелия сосудов и иммунной системы, но и в результате непосредственной активации ox-LDL экспрессии модулятора сАМР-отвечающего элемента — CREM и индуцибельного раннего репрессора сАМР в бета-клетках поджелудочной железы [59]. В результате снижается экспрессия и инсулина, и противоапоптотического белка островков, приводя к прогрессированию СД2 [56]. Последствия взаимодействия ox-LDL с рецептором LOX-1 — эндоплазматический и оксидантный стресс, распространяются и на перициты, в которых нарушение функционирования митохондрий, аутофагия и последующая апоптотическая гибель манифестируют развитие диабетической ретинопатии при СД2, усиливающейся под влиянием ox-LDL-содержащих иммунных комплексов [60]. Такие комплексы образуются в результате повышения иммуногенности структурно модифицированных частиц ox-LDL, стимулирующих образование аутоантител. Показано, что такие комплексы могут стимулировать образование коллагена IV мезангиальными клетками почки, способствуя развитию диабетической нефропатии [61], причем независимо от LOX-1 — с помощью иных механизмов.
Интересно, что и LOX-1 обладает потенциалом инициировать патогенетически значимые сигнальные пути вне взаимодействия со своим основным лигандом, ox-LDL. Этому способствует тот факт, что дополнительными лигандами LOX-1 могут являться другие агенты. К ним относятся С-реактивный белок и гликированные белки, способствующие гипергликемии, белки теплового шока HSP60 и HSP70, кардиолипин, декстран сульфат, микробы и апоптотические клетки [62]. Можно полагать, что и они способны, независимо от ox-LDL, индуцировать патогенетически значимые повреждения в органах-мишенях при СД2. Так, пока не известно, какие лиганды LOX-1 могут вызывать морфологические повреждения в тубулоинтерстициальной области почки, ассоциируемые и с высокой экспрессией рецептора, и с развитием диабетической нефропатии у больных СД2 [63].
Патогенетическая связь OLR1 c СД2 подкрепляется и наличием сведений (хоть и немногочисленных) об ассоциации генетического полиморфизма OLR1, и развитием СД2. Есть данные, что OLR1 участвует в генетическом контроле развития метаболического синдрома — предшественника СД. На индийской популяции показано, что у носителей аллели T OLR1 rs3736234 (IVS4-73 C>T) риск развития метаболического синдрома почти в 15 раз выше. Также было обнаружено, что генотип риска TT OLR1 rs3736234 (IVS4-73 C>T) в значительной степени связан с высоким ИМТ, что указывает на связь гена OLR1 с ожирением [64]. В другом исследовании продемонстрировано, что полиморфизмы OLR1 rs1050283 (UTR188C/T) и OLR1 rs11053646 (K167N G501C) связаны с факторами риска (артериальное давление, уровень инсулина, индекс HOMA-IR) гестационного СД [65]. Более того, исследователи отмечают, что чувствительность к терапевтическому действию метформина при СД2 существенно зависит от генотипа OLR1 rs11053646 (G501C), причем чаще это происходит в комбинации с вариантом OCT1 rs12208357 (R61C). Маркером положительного ответа на лечение метформином в группе больных СД2 оказался вариант CC полиморфизма OCT1 rs12208357 (R61C). Также у пациентов с СД2 генотип OLR1 rs11053646 GC чаще сочетался с «метформин-позитивным» вариантом CC OCT1 rs12208357 [66]. Это исследование подчеркивает связь генов OLR1-OCT1 в патогенезе не только СД2, но и в терапевтической эффективности использования метформина. Не исключено, что в основе этого — одна и та же патогенетическая связь двух генов, проявляющаяся при развитии целого ряда метаболических нарушений, включая развитие СД2, а именно: резкое повышение экспрессии гена OCT1 — негативного регулятора экспрессии гена NFkB и положительного регулятора экспрессии гена OLR1.
Проведенный анализ обосновывает значение лиганда ox-LDL, его рецептора LOX-1 и генетических вариантов OLR1 как взаимодействующих или независимых участников развития СД2 и его осложнений, а также патогенетически значимых маркеров течения и исхода заболевания и потенциальных терапевтических мишеней для разработки препаратов лечения СД2.
ЗАКЛЮЧЕНИЕ
Циркулирующий ox-LDL, во взаимодействуя с его рецептором LOX-1 и независимо, вносит значительнoxый вклад в развитие СД2, способствуя его прогрессированию. Увеличенная концентрация ox-LDL в циркуляторном русле и повышенная экспрессия его рецептора в тканях-мишенях повышает риск тяжелого течения СД2, приводя к характерным для заболевания дисфункции эндотелия (диабетическая ангиопатия) и поражению почек (диабетическая нефропатия).
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Тема госзадания ФНКЦ РР «Полиморфные варианты генов врожденного иммунитета и структуры, ассоциированные с повреждением/патогеном, как факторы гетерогенности механизмов критических состояний и предиктивные биомаркеры прогноза их течения» FGWS-2022-0004.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы внесли существенный вклад в концепцию исследования и написание статьи.
Фетлам Д.Л. и Чумаченко А.Г. в равной степени участвовали в разработке концепции статьи, поиске статей и анализе фактических данных, написании текста статьи. Писарев В.М. редактировал текст статьи, дополнял текст новыми ссылками, проверял и утверждал текст статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Henning RJ. Type-2 diabetes mellitus and cardiovascular disease. Future Cardiol. 2018;14(6):491-509. https://doi.org/10.2217/fca-2018-0045
2. Неймарк М.И., Клостер Е.А., Булганин А.А., и др. Применение меглюмина натрия сукцината при диабетическом кетоацидозе. // Общая реаниматология. — 2023. — Т. 19. — №3. — С.12-19. https://doi.org/10.15360/1813-9779-2023-3-12-19
3. Kuzan A, Królewicz E, Kustrzeba-Wójcicka I, et al. How Diabetes and Other Comorbidities of Elderly Patients and Their Treatment Influence Levels of Glycation Products. Int J Environ Res Public Health. 2022;19(12):7524. https://doi.org/10.3390/ijerph19127524
4. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010 — 2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. https://doi.org/10.14341/DM13035
5. Ершова А.И., Аль Раши Д.О., Иванова А.А., и др. Вторичные гиперлипидемии: этиология и патогенез. // Российский кардиологический журнал. — 2019. — №5. — С. 74-81.
6. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021. // Сахарный диабет. — 2021. — Т. 24. — №3. — С. 204-221. https://doi.org/10.14341/DM12759
7. Корниенко Е.А. Профилактика реперфузионных осложнений в лечении острого инфаркта миокарда при сахарном диабете 2 типа. // Общая реаниматология. — 2019. — Т. 15. — №3. — С.4-18. https://doi.org/10.15360/1813-9779-2019-3-4-18
8. Чумаченко А.Г., Григорьев Е.К., Писарев В.М. Вклад полиморфизма промоторной области гена AGTR 1 в течение и исход сепсиса у пациентов с различной коморбидностью. // Общая реаниматология. — 2021. — Т.17. — №5. — С.35-51. https://doi.org/10.15360/1813-9779-2021-5-35-51
9. Артыкбаева Г.М., Саатов Т.С. Взаимосвязь тяжелого острого респираторного синдрома, вызванного вирусом SARS-CoV-2, и сахарного диабета (обзор литературы). // Сахарный диабет. — 2023. — Т.26. — №1. — С. 66-74. https://doi.org/10.14341/DM12900
10. Rey-Reñones C, Martinez-Torres S, Martín-Luján FM, et al. Type 2 Diabetes Mellitus and COVID-19: A Narrative Review. Biomedicines. 2022;10(9):2089. https://doi.org/10.3390/biomedicines10092089
11. Мокрышева Н.Г., Шестакова М.В., Викулова О.К., и др. Анализ рисков летальности 337 991 пациента с сахарным диабетом, перенесшего COVID-19, за период 2020–2022 гг.: всероссийское ретроспективное исследование // Сахарный диабет. — 2022. — Т. 25. — №5. — С. 404-417. https://doi.org/10.14341/DM12954
12. Vergès B. Pathophysiology of diabetic dyslipidaemia: where are we? Diabetologia. 2015;58(5):886-899. https://doi.org/10.1007/s00125-015-3525-8
13. Shojima N, Yamauchi T. Progress in genetics of type 2 diabetes and diabetic complications. J Diabetes Investig. 2023;14(4):503-515. https://doi.org/10.1111/jdi.13970
14. Bonilha I, Hajduch E, Luchiari B, Nadruz W, Le Goff W, Sposito AC. The Reciprocal Relationship between LDL Metabolism and Type 2 Diabetes Mellitus. Metabolites. 2021;11(12):807. https://doi.org/10.3390/metabo11120807
15. Ormazabal V, Nair S, Elfeky O, et al. Association between insulin resistance and the development of cardiovascular disease. Cardiovasc Diabetol. 2018;17(1):122. https://doi.org/10.1186/s12933-018-0762-4
16. Jin JL, Zhang HW, Cao YX, et al. Association of small dense low-density lipoprotein with cardiovascular outcome in patients with coronary artery disease and diabetes: a prospective, observational cohort study. Cardiovasc Diabetol. 2020;19(1):45. https://doi.org/10.1186/s12933-020-01015-6
17. Gerber PA, Thalhammer C, Schmied C, et al. Small, dense LDL particles predict changes in intima media thickness and insulin resistance in men with type 2 diabetes and prediabetes--a prospective cohort study. PLoS One. 2013;8(8):e72763. https://doi.org/10.1371/journal.pone.0072763
18. Dannecker C, Wagner R, Peter A, et al. Low-Density Lipoprotein Cholesterol Is Associated With Insulin Secretion. J Clin Endocrinol Metab. 2021;106(6):1576-1584. https://doi.org/10.1210/clinem/dgab147
19. Frangie C, Daher J. Role of myeloperoxidase in inflammation and atherosclerosis (Review). Biomed Rep. 2022;16(6):53. https://doi.org/10.3892/br.2022.1536
20. Takahashi Y, Zhu H, Yoshimoto T. Essential roles of lipoxygenases in LDL oxidation and development of atherosclerosis. Antioxid Redox Signal. 2005;7(3-4):425-431. https://doi.org/10.1089/ars.2005.7.425
21. Khatana C, Saini NK, Chakrabarti S, et al. Mechanistic Insights into the Oxidized Low-Density Lipoprotein-Induced Atherosclerosis. Oxid Med Cell Longev. 2020;2020:5245308. https://doi.org/10.1155/2020/5245308
22. Poznyak AV, Grechko AV, Orekhova VA, et al. NADPH Oxidases and Their Role in Atherosclerosis. Biomedicines. 2020;8(7):206. https://doi.org/10.3390/biomedicines8070206
23. Poznyak AV, Nikiforov NG, Markin AM, et al. Overview of OxLDL and Its Impact on Cardiovascular Health: Focus on Atherosclerosis. Front Pharmacol. 2021;11:613780. https://doi.org/10.3389/fphar.2020.61378
24. Iuliano L. Pathways of cholesterol oxidation via non-enzymatic mechanisms. Chem Phys Lipids. 2011;164(6):457-468. https://doi.org/10.1016/j.chemphyslip.2011.06.006
25. Toma L, Stancu CS, Sima AV. Endothelial Dysfunction in Diabetes Is Aggravated by Glycated Lipoproteins; Novel Molecular Therapies. Biomedicines. 2020;9(1):18. https://doi.org/10.3390/biomedicines9010018
26. Lin J. Low-Density Lipoprotein: Biochemical and Metabolic Characteristics and Its Pathogenic Mechanism. IntechOpen. 2020. https://doi.org/10.5772/intechopen.86872
27. Volobueva A, Zhang D, Grechko AV, Orekhov AN. Foam cell formation and cholesterol trafficking and metabolism disturbances in atherosclerosis. Cor et Vasa. 2019;61(1):48-55. https://doi.org/10.1016/j.crvasa.2018.06.006
28. Aoki Y, Dai H, Furuta F, et al. LOX-1 mediates inflammatory activation of microglial cells through the p38-MAPK/NF-κB pathways under hypoxic-ischemic conditions. Cell Commun Signal. 2023;21(1):126. https://doi.org/10.1186/s12964-023-01048-w
29. Munno M, Mallia A, Greco A, et al. Radical Oxygen Species, Oxidized Low-Density Lipoproteins, and Lectin-like Oxidized Low-Density Lipoprotein Receptor 1: A Vicious Circle in Atherosclerotic Process. Antioxidants (Basel). 2024;13(5):583. https://doi.org/10.3390/antiox13050583
30. Kim EJ, Ramachandran R, Wierzbicki AS. Lipidomics in diabetes. Curr Opin Endocrinol Diabetes Obes. 2022;29(2):124-130. https://doi.org/10.1097/MED.0000000000000704
31. Bandet CL, Tan-Chen S, Bourron O, et al. Sphingolipid Metabolism: New Insight into Ceramide-Induced Lipotoxicity in Muscle Cells. Int J Mol Sci. 2019;20(3):479. https://doi.org/10.3390/ijms20030479
32. Neeland IJ, Singh S, McGuire DK, et al. Relation of plasma ceramides to visceral adiposity, insulin resistance and the development of type 2 diabetes mellitus: the Dallas Heart Study. Diabetologia. 2018;61(12):2570-2579. https://doi.org/10.1007/s00125-018-4720-1
33. Gaggini M, Pingitore A, Vassalle C. Plasma Ceramides Pathophysiology, Measurements, Challenges, and Opportunities. Metabolites. 2021;11(11):719. https://doi.org/10.3390/metabo11110719
34. J Hoy AJ, Stark R, et al. Ceramides contained in LDL are elevated in type 2 diabetes and promote inflammation and skeletal muscle insulin resistance. Diabetes. 2013;62(2):401-410. https://doi.org/10.2337/db12-0686
35. Lubrano V, Balzan S, Papa A. LOX-1 variants modulate the severity of cardiovascular disease: state of the art and future directions. Mol Cell Biochem. 2023. https://doi.org/10.1007/s11010-023-04859-0
36. El-Hajjar L, Hindieh J, Andraos R, et al. Myeloperoxidase-Oxidized LDL Activates Human Aortic Endothelial Cells through the LOX-1 Scavenger Receptor. Int J Mol Sci. 2022;23(5):2837. https://doi.org/10.3390/ijms23052837
37. Mango R, Biocca S, del Vecchio F, et al. In vivo and in vitro studies support that a new splicing isoform of OLR1 gene is protective against acute myocardial infarction. Circ Res. 2005;97(2):152-8. https://doi.org/0.1161/01.RES.0000174563.62625
38. Barreto J, Karathanasis SK, Remaley A, Sposito AC. Role of LOX-1 (Lectin-Like Oxidized Low-Density Lipoprotein Receptor 1) as a Cardiovascular Risk Predictor: Mechanistic Insight and Potential Clinical Use. Arterioscler Thromb Vasc Biol. 2021;41(1):153-166. https://doi.org/10.1161/ATVBAHA.120.315421
39. Thakkar S, Wang X, Khaidakov M, et al. Structure-based Design Targeted at LOX-1, a Receptor for Oxidized Low-Density Lipoprotein. Sci Rep. 2015;5:16740. https://doi.org/10.1038/srep16740
40. Kattoor AJ, Goel A, Mehta JL. LOX-1: Regulation, Signaling and Its Role in Atherosclerosis. Antioxidants (Basel). 2019;8(7):218. https://doi.org/10.3390/antiox8070218
41. Akhmedov A, Sawamura T, Chen CH, et al. Lectin-like oxidized low-density lipoprotein receptor-1 (LOX-1): a crucial driver of atherosclerotic cardiovascular disease. Eur Heart J. 2021;42(18):1797-1807. https://doi.org/10.1093/eurheartj/ehaa770
42. Stein S, Matter CM. Protective roles of SIRT1 in atherosclerosis. Cell Cycle. 2011;10(4):640-647. https://doi.org/10.4161/cc.10.4.14863
43. Shao D, Di Y, Lian Z, et al. Grape seed proanthocyanidins suppressed macrophage foam cell formation by miRNA-9 via targeting ACAT1 in THP-1 cells. Food Funct. 2020;11(2):1258-1269. https://doi.org/10.1039/c9fo02352f
44. Dai Y, Zhang Z, Cao Y, et al. MiR-590-5p Inhibits Oxidized- LDL Induced Angiogenesis by Targeting LOX-1. Sci Rep. 2016;6:22607. https://doi.org/10.1038/srep22607.41
45. Hermonat PL, Zhu H, Cao M, Mehta JL. LOX-1 transcription. Cardiovasc Drugs Ther. 2011;25(5):393-400. https://doi.org/10.1007/s10557-011-6322-8
46. Luo P, Zhang WF, Qian ZX, et al. MiR-590-5p-meidated LOX-1 upregulation promotes Angiotensin II-induced endothelial cell apoptosis. Biochem Biophys Res Commun. 2016;471(4):402-408. https://doi.org/10.1016/j.bbrc.2016.02.074
47. He PP, OuYang XP, Li Y, et al. MicroRNA-590 inhibits lipoprotein lipase expression and prevents atherosclerosis in apoE knockout mice. PLoS ONE. 2015;10,e0138788. https://doi.org/10.1371/journal.pone.0138788
48. Wróblewski A, Strycharz J, Oszajca K, et al. Dysregulation of Inflammation, Oxidative Stress, and Glucose Metabolism-Related Genes and miRNAs in Visceral Adipose Tissue of Women with Type 2 Diabetes Mellitus. Med Sci Monit. 2023;29:e939299. https://doi.org/10.12659/MSM.939299
49. Tsai CH, Huang PJ, Lee IT, et al. Endothelin-1-mediated miR-let-7g-5p triggers interlukin-6 and TNF-α to cause myopathy and chronic adipose inflammation in elderly patients with diabetes mellitus. Aging (Albany NY). 2022;14(8):3633-3651. https://doi.org/10.18632/aging.204034
50. Jankauskas SS, Gambardella J, Sardu C, et al. Functional Role of miR-155 in the Pathogenesis of Diabetes Mellitus and Its Complications. Noncoding RNA. 2021;7(3):39. https://doi.org/10.3390/ncrna7030039
51. Papadopoulos KI, Papadopoulou A, Aw TC. MicroRNA-155 mediates endogenous angiotensin II type 1 receptor regulation: implications for innovative type 2 diabetes mellitus management. World J Diabetes. 2023;14(9):1334-1340. https://doi.org/10.4239/wjd.v14.i9.1334
52. Chen Y, Sun C, Lu J, et al. MicroRNA-590-5p antagonizes the inhibitory effect of high glucose on osteoblast differentiation by suppressing Smad7 in MC3T3-E1 cells. J Int Med Res. 2019;47(4):1740-1748. https://doi.org/10.1177/0300060519830212
53. Favre D, Niederhauser G, Fahmi D, et al. Role for inducible cAMP early repressor in promoting pancreatic beta cell dysfun ction evoked by oxidative stress in human and rat islets. Diabetologia. 2011;54(9):2337-2346. https://doi.org/10.1007/s00125-011-2165-x
54. Foroumandi E, Kheirouri S, Nosrati R, Ghodsi R. Association of dietary intake, medication and anthropometric indices with serum levels of advanced glycation end products, caspase-3, and matrix metalloproteinase-9 in diabetic patients. J Diabetes Metab Disord. 2021;20(1):719-725. https://doi.org/10.1007/s40200-021-00803-5
55. Janjusevic M, Fluca AL, Gagno G, et al. Old and Novel Therapeutic Approaches in the Management of Hyperglycemia, an Important Risk Factor for Atherosclerosis. Int J Mol Sci. 2022;23(4):2336. https://doi.org/10.3390/ijms23042336
56. Shaw DJ, Seese R, Ponnambalam S, Ajjan R. The role of lectin-like oxidised low-density lipoprotein receptor-1 in vascular pathology. Diab Vasc Dis Res. 2014;11(6):410-8. https://doi.org/10.1177/1479164114547704
57. Xu S, Ogura S, Chen J, et al. LOX-1 in atherosclerosis: biological functions and pharmacological modifiers. Cell Mol Life Sci. 2013;70(16):2859-2872. https://doi.org/10.1007/s00018-012-1194-z
58. Balzan S, Lubrano V. LOX-1 receptor: A potential link in atherosclerosis and cancer. Life Sci. 2018;198:79-86. https://doi.org/10.1016/j.lfs.2018.02.024
59. Bonilha I, Hajduch E, Luchiari B, et al. The Reciprocal Relationship between LDL Metabolism and Type 2 Diabetes Mellitus. Metabolites. 2021;11(12):807. https://doi.org/10.3390/metabo11120807
60. Fu D, Yu JY, Wu M, et al. Immune complex formation in human diabetic retina enhances toxicity of oxidized LDL towards retinal capillary pericytes. J Lipid Res. 2014;55(5):860-869. https://doi.org/10.1194/jlr.M045401
61. Abdelsamie SA, Li Y, Huang Y, et al. Oxidized LDL immune complexes stimulate collagen IV production in mesangial cells via Fc gamma receptors I and III. Clin Immunol. 2011;139(3):258-66. https://doi.org/10.1016/j.clim.2011.01.016
62. Truthe S, Klassert TE, Schmelz S, et al. Role of Lectin-Like Oxidized Low-Density Lipoprotein Receptor-1 in Inflammation and Pathogen-Associated Interactions. J Innate Immun. 2024;16(1):105-132. https://doi.org/10.1159/000535793
63. Yamamoto N, Toyoda M, Abe M, et al. Lectin-like oxidized LDL receptor-1 (LOX-1) expression in the tubulointerstitial area likely plays an important role in human diabetic nephropathy. Intern Med. 2009;48(4):189-194. https://doi.org/10.2169/internalmedicine.48.1251
64. Jamatia E, Lali P, Koner BC, et al. OLR1 Gene Polymorphism and Oxidized LDL Levels in Metabolic Syndrome in Indian Population. Indian J Endocrinol Metab. 2018;22(4):530-534. https://doi.org/10.4103/ijem.IJEM_112_18
65. Aydemir B, Baykara O, Cinemre FB, et al. LOX-1 gene variants and maternal levels of plasma oxidized LDL and malondialdehyde in patients with gestational diabetes mellitus. Arch Gynecol Obstet. 2016;293(3):517-27. https://doi.org/10.1007/s00404-015-3851-6
66. Berstein LM, Iyevleva AG, Vasilyev D, et al. Genetic polymorphisms potentially associated with response to metformin in postmenopausal diabetics suffering and not suffering with cancer. Cell Cycle. 2013;12(23):3681-8. https://doi.org/10.4161/cc.26868
Об авторах
Д. Л. ФетламРоссия
Фетлам Дмитрий Леонидович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Г. Чумаченко
Россия
Чумаченко Анастасия Геннадьевна - к.б.н.; ResearcherID: B-1531-2015; Scopus Author ID: 357211375453.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. М. Писарев
Россия
Писарев Владимир Митрофанович - д.м.н., профессор; ResearcherID: E-1373-2012; Scopus Author ID: 7006540472.
107031, Москва, ул. Петровка, 25, стр. 2
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Схема взаимодействия ox-LDL с LOX-1. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(529KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Фетлам Д.Л., Чумаченко А.Г., Писарев В.М. Значение окисленных липопротеинов низкой плотности и их рецепторов LOX-1 при сахарном диабете 2 типа. Сахарный диабет. 2024;27(6):589-597. https://doi.org/10.14341/DM13203
For citation:
Fetlam D.L., Chumachenko A.G., Pisarev V.M. The Significance of Oxidized Low-Density Lipoproteins and Receptors LOX-1 in Type 2 Diabetes Mellitus. Diabetes mellitus. 2024;27(6):589-597. (In Russ.) https://doi.org/10.14341/DM13203

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































