Перейти к:
Ретроспективный анализ особенностей постковидного периода у пациентов с сахарным диабетом 2 типа, заболевших в разные вариант-ассоциированные периоды COVID-19
https://doi.org/10.14341/DM13179
Аннотация
ОБОСНОВАНИЕ. С момента появления коронавирусной инфекции в клинической практике особое внимание уделялось ее острой фазе. Однако на сегодняшний день остается открытым вопрос прямого и косвенного воздействия на пациентов с сахарным диабетом 2 типа (СД2) после выздоровления от коронавирусной инфекции.
ЦЕЛЬ. Определить клинико-лабораторные особенности постковидного периода у больных СД2 в разные периоды инфекции.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено описательное ретроспективное исследование с использованием электронных медицинских карт 134 пациентов, перенесших коронавирусную инфекцию.
РЕЗУЛЬТАТЫ. Большую часть пациентов составили женщины, распределение по возрасту и по полу в группах не различалось (р=0,384 и p=0,207). В периоде «Омикрон» наблюдалось меньшее количество сопутствующих заболеваний и меньшее количество госпитализированных пациентов по сравнению с другими группами (р<0,0167). При изучении состояний, связанных с сахарным диабетом, частое мочеиспускание присутствовало только у пациентов периода «Альфа», а частота гипогликемии, гипергликемии, степень хронической болезни почек (ХБП) и проявлений полинейропатии не различались между группами (р>0,0167). При изучении впервые выявленных заболеваний разница оказалась статистически значимой только в отношении заболеваний опорно-двигательного аппарата (16,7% «Альфа» против 30,2% «Дельта» против 3,7% «Омикрон», р=0,015). При изучении лабораторных показателей была обнаружена разница в отношении тромбоцитов и АЧТВ: медианы тромбоцитов были статистически значимо ниже в группах «Альфа» и «Дельта» по сравнению с группой «Омикрон» (210 (179,2–249,7) 10⁹/л и 218 (196,5–281) 10⁹/л против 255 (208–327) 10⁹/л соответственно, p=0,016); АЧТВ был статистически значимо более продолжительным для «Альфа» и «Дельта» по сравнению с «Омикрон» 28 (23,6–31,3) сек против 30,3 (26,1–34,9) сек против 27,1 (22,4–30,3) сек соответственно (p=0,013).
ЗАКЛЮЧЕНИЕ. Данные реальной клинической практики позволяют проследить за развитием новой симптоматики и новых заболеваний пациента в постковидном периоде. Пациенты с СД во временной вариант-ассоциированный период «Омикрон» имели меньший риск развития новых симптомов и заболеваний. Необходимо внедрять решения для контроля целевых показателей HbA1c через медицинские информационные системы и повышать стандарты качества репортирования симптоматики пациентов для более точного анализа данных реальной клинической практики (Real world data, RWD).
Для цитирования:
Алтынбекова С.А., Фадеев В.В., Абылайулы Ж., Большакова С.В. Ретроспективный анализ особенностей постковидного периода у пациентов с сахарным диабетом 2 типа, заболевших в разные вариант-ассоциированные периоды COVID-19. Сахарный диабет. 2024;27(5):441-450. https://doi.org/10.14341/DM13179
For citation:
Altynbekova S.A., Fadeev V.V., Abilayuly Z., Bolshakova S.V. Retrospective Analysis of the Characteristics of the Post-COVID Period in Patients with Type 2 Diabetes, Infected During Different Variant-Associated Periods of COVID-19. Diabetes mellitus. 2024;27(5):441-450. (In Russ.) https://doi.org/10.14341/DM13179
Обоснование
В настоящее время признано, что SARS-CoV-2 ответственен не только за острую фазу инфекции, но и за многие долгосрочные симптомы после выздоровления [1–4]. Сообщения о распространенности сохраняющихся симптомов после заражения COVID-19 варьируются от 32,6 до 87% госпитализированных пациентов [3][4]. Известно, что наличие ряда сопутствующих заболеваний осложняет течение COVID-19 [5], и для пациентов с сахарным диабетом 2 типа (СД2) характерны более высокая частота осложнений и смертность от COVID-19 [6].
Для пациентов с СД2 риски повышаются и при состоянии «long COVID-19» [7]. Состояние «long-COVID-19», или «постковидный синдром», характеризуется развитием клинических симптомов и синдромов, которые развиваются во время или после заражения SARS-COV-2, продолжаются более 12 недель и не объясняются альтернативной причиной [1][8]. Проявления постковидного синдрома могут включать усталость, одышку, постуральную тахикардию, аритмию, когнитивные нарушения, нарушения сна, симптомы посттравматического стрессового расстройства, мышечную боль, проблемы с концентрацией внимания и головную боль [9–11]. Имеются систематические обзоры, описывающие более 50 симптомов, связанных с постковидным синдромом [12]. В связи с этим представляется интересным изучение его особенностей у пациентов с СД2.
Известно, что у трети пациентов с коморбидными состояниями развивается постковидный синдром [13], при этом у пациентов с СД2 он наиболее продолжительный и непредсказуемый [14][15].
Имеются данные о том, что для варианта SARS-CoV-2 «Омикрон» характерно более быстрое восстановление и короткий период постковидного синдрома по сравнению с другими вариантами COVID-19 [16–19], что позволяет говорить о вариант-ассоциированных периодах инфекции. При этом в имеющихся целевых обзорных работах о пациентах с СД2 и постковидным синдромом не отображена информация о связи тяжести состояния пациентов с разными вариантами вируса [7]. Для ее получения возможно использование записей медицинских информационных систем [20]. Данные из реальной клинической практики (Real world data, RWD) в литературе обычно определяют как данные, которые не собираются в обычных рандомизированных контролируемых исследованиях (РКИ) [21], и предполагается, что они собираются из таких источников, как базы данных, обзоры медицинских карт пациентов и реестры, а также проспективные и ретроспективные исследования [22][23]. Они признаются ценными источниками информации, которая дополняет данные РКИ [20–23].
Для сбора и анализа данных об имеющихся заболеваниях и симптомах у пациентов с СД2 в постковидный период, заболевших в различные вариант-ассоциированные периоды COVID-19, было принято решение о проведении данного RWD-исследования с последующим формированием подхода к оценке этих пациентов.
Цель ИССЛЕДОВАНИЯ
В связи с вышеизложенным, целью нашего исследования был сбор и анализ данных о существующих заболеваниях и симптомах, возникающих у пациентов с СД2 в постковидный период, заболевших в разные вариант-ассоциированные периоды COVID-19.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. RWD-исследование с использованием данных пациентов, обратившихся после коронавирусной инфекции КГП на ПХВ «Городская поликлиника №4» г. Алматы, Казахстан.
Время исследования. Изучены данные пациентов в период с 2020 по 2022 гг.
Изучаемые популяции
Пациенты были разделены на 3 группы наблюдения согласно вариант-ассоциированным периодам заболеваемости. Для получения данных использовалась медицинская информационная система (МИС) Damumed. Использовалась возможность просмотреть записи о пациенте, совершенные в других стационарах и структурах первичного звена здравоохранения.
Вариант-ассоциированные периоды COVID-19
Периоды были разделены на три группы: «Альфа» — с июня 2020 по июнь 2021 г., «Дельта» — с июля 2021 по декабрь 2021 г. и «Омикрон» — с февраля 2022 до июня 2022 г.
Критерии включения
(1) Установленный диагноз СД2, возраст ≥18 лет; (2) положительный ПЦР-тест на коронавирус, исследование проводилось на этапе диагностики коронавирусной инфекции и по окончании домашнего карантина пациента, в соответствии с клиническим протоколом диагностики и лечения коронавирусной инфекции.
Критерии исключения
(1) Отсутствие записей о последующих визитах пациента к врачу, которые следовали после установления диагноза COVID-19 в МИС, (2) смерть от всех причин в течение периода наблюдения.
Способ формирования выборки из изучаемой популяции
При формировании выборки использовался способ простого случайного отбора.
Дизайн исследования
Проведено одноцентровое ретроспективное сравнительное неконтролируемое исследование.
Методы
Для изучения постковидного периода у пациентов с СД2 в разные периоды инфекции анализировались: (1) пол, (2) возраст, (3) принадлежность к вариант-ассоциированному периоду COVID-19, (4) наличие коморбидных состояний, (5) следующие лабораторные показатели: (а) клинический анализ крови (гемоглобин, эритроциты, лейкоциты, гематокрит, MCH, MCHC, MCV, RDW, тромбоциты), (b) биохимический анализ крови (общий белок, креатинин, мочевина, АлТ, АсТ, общий билирубин, холестерин, глюкоза, HbA1c, СРБ), (c) коагулограмма (АЧТВ, ПТИ, фибриноген, МНО) и D-димер.
Первичные конечные точки: (1) группа исходов, связанная с СД2: уровень глюкозы, гипогликемия, гипергликемия, хроническая болезнь почек (ХБП), креатинин, СКФ, онемение нижних конечностей, частое мочеиспускание.
Вторичные конечные точки: (1) впервые выявленные заболевания, (2) зарегистрированные симптомы.
Определение гипогликемии и гипергликемии
В некоторых РКИ подтвержденные гипогликемические события определялись как уровень глюкозы в крови <3,1 ммоль/л (РКИ, n=14; RWD, n=7), а в других исследованиях — как уровень глюкозы в крови <3,9 ммоль/л с симптомами или без них (РКИ, n=4; RWD, n=2), и считались подтвержденными или легкими/умеренными событиями [20]. Американская диабетическая ассоциация (American Diabetes Association, ADA) определяет гипогликемию как концентрацию глюкозы в крови <3,9 ммоль/л [24], однако различные документы рассматривают гипогликемию в диапазоне от <3,9 до <3,0 ммоль/л [25]. У здоровых людей уровень глюкозы в крови часто падает ниже 3,9 ммоль/л; следовательно, уровни 3,5–4,0 ммоль/л вряд ли будут иметь клиническое значение [25][26]. Учитывая разнообразные аргументы, в рамках данного исследования гипергликемия определялась, как ≥7,0 ммоль/л, гипогликемия <3,9 ммоль/л, что соответствует консенсусам по RWD-исследованиям и данным клинических рекомендаций Республики Казахстан [20][27].
Оценка других лабораторных показателей
Для оценки были взяты нормы, применяемые в лаборатории КГП на ПХВ «Городская поликлиника №4»: гемоглобин: мужчины — 130–160 г/л, женщины — 120–140 г/л; эритроциты: мужчины — 4,0–5,1×10¹²/л, женщины — 3,7–4,7×10¹²/л; лейкоциты: 4–9×10⁹/л; гематокрит: мужчины — 40–52%, женщины — 36–48%; MCV: 80–100 фл; MCHC: 310–370 г/л; MCH: 27–34 пг; RDW: 11,5–14,5%; тромбоциты: 180–320×10⁹/л; СОЭ: мужчины — 1–10 мм/ч, женщины — 2–15 мм/ч; общий белок: 65–85 г/л; мочевина: 2,5–8,3 ммоль/л; креатинин: мужчины — 62–115 мкмоль/л, женщины — 53–97 мкмоль/л; АлТ: 7–56 Ед/л; АсТ: 10–40 Ед/л; общий билирубин: 3,4–17,1 мкмоль/л; общий холестерин: менее 5,2 ммоль/л; СРБ: менее 5 мг/л; АЧТВ: 21,1–36,5 сек; фибриноген: 2,0–4,0 г/л; ПТИ: 80–120%; МНО: 0,8–1,2; D-димер: менее 500 нг/мл.
Зарегистрированные симптомы
Клинические симптомы, такие как слабость, потливость, кашель, боль в суставах, кардиологические симптомы (боль за грудиной и аналогичные описания, которые можно определить, как боль за грудиной, учащенное сердцебиение, одышка при физической нагрузке и другие описания, которые можно было бы отнести к кардиологическим симптомам), неврологические симптомы (головная боль, головокружение, шаткость при ходьбе, боль в спине, судороги в конечностях и другие, которые можно было счесть неврологическими симптомами), и другие жалобы были проанализированы однократно в течение первых трех месяцев при первичном приеме врача после перенесенной коронавирусной инфекции.
Статистический анализ
Описательная статистика представлялась в виде пропорций (%) для категориальных переменных и в виде медианы с межквартильными размахами (25-й и 75-й процентили) для количественных данных. Нормальность распределения количественных переменных проверяли с помощью критериев Шапиро-Уилка и Колмогорова-Смирнова с построением нормального вероятностного графика. Поскольку распределение величин показателей не соответствовало нормальному, для определения статистической значимости в независимых группах использовали критерий множественного сравнения Краскела-Уоллиса. Частоты качественных признаков сравнивались между собой с помощью критерия Хи-квадрат (χ²) и точного критерия Фишера. Учитывая множественное сравнение, различия считали статистически значимыми с поправкой Бонферрони (р≤0,0167). Все анализы проводились с использованием программного обеспечения Statistical Package for the Social Sciences (SPSS), версия 19.0.
Этическая экспертиза
Исследование одобрено Комитетом по этике исследований НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова» (№2 (125) от «23» февраля 2022 г).
Результаты
В данное исследование были включены 134 пациента с СД2. Большую часть пациентов во всех исследуемых группах составили женщины, половое распределение в группах значимо не различалось (p=0,207). Группы отличались по структурам заболеваний: артериальная гипертензия и группа «другие хронические заболевания» реже встречались у пациентов в вариант-ассоциированный период «Омикрон» (p=0,0001 и p=0,0001). Получаемая сахароснижающая терапия включала инсулин и другие гипогликемические препараты, применение которых было сопоставимо между группами (p=0,758). При этом отмечено, что большая часть пациентов периода «Омикрон» находилась на амбулаторном лечении (70,4%), тогда как в период «Альфа» и «Дельта» большая часть пациентов находилась на стационарном лечении — 77,8 и 69,8% соответственно (табл. 1).
Таблица 1. Демографические данные
|
Варианты COVID-19 Характеристика |
Альфа, n (%) (n=54) |
Дельта, n (%) (n=53) |
Омикрон, n (%) (n=27) |
p |
|
Пол, n (%) •мужской •женский |
18 (33,3) 36 (66,7) |
14 (26,4) 39 (53) |
4 (14,8) 23 (85,2) |
0,207 |
|
Возраст, Ме [ Q1; Q3], лет |
63,5 [ 58,75; 72] |
69 [ 60; 75] |
68 [ 54; 76] |
0,384 |
|
Сопутствующее заболевание |
||||
|
АГ, n (%) |
45 (83,3) |
49 (92,5) |
14 (51,9) |
0,0001 |
|
ИБС, n (%) |
30 (55,6) |
25 (47,2) |
6 (22,2) |
0,017 |
|
Другие хронические заболевания, n (%) |
34 (63) |
31 (58,5) |
4 (14,8) |
0,0001 |
|
ССП |
||||
|
Инсулинотерапия, n (%) |
13 (24,1) |
10 (18,9) |
5 (18,5) |
0,758 |
|
Другие ССП, n (%) |
41 (75,9) |
43 (81,1) |
22 (81,5) |
|
|
Госпитализация, n (%) •не потребовалась •потребовалась |
12 (22,2) 42 (77,8) |
16 (30,2) 37 (69,8) |
19 (70,4) 8 (29,6) |
0,0001 |
Примечание. Статистическая значимость различий качественных данных оценивалась с использованием критерия χ² и точного критерия Фишера с поправкой Бонферрони (p≤0,0167). Различия количественных показателей между группами оценивались с использованием критерия Краскела-Уоллиса с поправкой Бонферрони (p≤0,0167).
Аббревиатуры. АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ССП — сахароснижающие препараты.
В отношении состояний, связанных с течением СД2, было выявлено, что частота гипогликемий (уровень глюкозы менее 3,9 ммоль/л) и гипергликемий (7 ммоль/л и более) натощак статистически не отличались внутри популяций. Показатели функции почек также представлены однородно (p>0,0167), признаки нейропатии в жалобах были отмечены только для пациентов в периоде «Дельта» (p=0,212), при этом частое мочеиспускание присутствовало в качестве жалобы только у пациентов периода «Альфа» (7,4%, p=0,047), что может косвенно свидетельствовать о худшем контроле заболевания. Однако после применения поправки Бонферрони статистическая значимость между группами не была установлена (p>0,0167) (табл. 2).
Таблица 2. Показатели и состояния, связанные с течением сахарного диабета
|
COVID-19 Показатели |
Альфа, n (%) (n=54) |
Дельта, n (%) (n=53) |
Омикрон, n (%) (n=27) |
p |
|
Глюкоза, Ме [ Q1; Q3], ммоль/л |
7,3 [ 5,8; 10,7] |
7,5 [ 5,4; 9,8] |
6,7 [ 4,9; 9,6] |
0,277 |
|
Категории уровня глюкозы |
||||
|
Гипогликемия, n (%) |
1 (1,9) |
2 (3,8) |
1 (3,7) |
0,905 |
|
Гипергликемия, n (%) |
31 (57,4) |
30 (56,6) |
13 (48,1) |
|
|
Норма, n (%) |
22 (40,7) |
21 (39,6) |
13 (48,1) |
|
|
ХБП |
||||
|
Креатинин, Ме [ Q1; Q3], мкмоль/л |
70 [ 58; 91] |
72 [ 61,5; 85,5] |
78 [ 64; 84] |
0,377 |
|
рСКФ, Ме [ Q1; Q3], мл/мин/1,73 м² |
87 [ 71; 98] |
82,4 [ 69,9; 95,1] |
86,2 [ 62; 97,9] |
0,619 |
|
ХБП, n (%) 2 стадия 3А стадия 3Б стадия 4 стадия 5 стадия |
24 (44,4) 4 (7,4) 1 (1,9) 1 (1,9) 0 (0) |
26 (49,1) 2 (3,8) 3 (5,7) 2 (3,8) 1 (1,9) |
13 (48,1) 1 (3,7) 2 (7,4) 0 (0) 0 (0) |
0,841 |
|
Онемение в н/к, n (%) |
0 (0) |
2 (3,8) |
0 (0) |
0,212 |
|
Частое мочеиспускание, n (%) |
4 (7,4) |
0 (0) |
0 (0) |
0,047 |
Примечание. Статистическая значимость различий качественных данных оценивалась с использованием критерия χ² и точного критерия Фишера с поправкой Бонферрони (p≤0,0167). Различия количественных показателей между группами оценивались с использованием критерия Краскела-Уоллиса с поправкой Бонферрони (p≤0,0167).
Аббревиатуры. ХБП — хроническая болезнь почек, рСКФ — расчетная скорость клубочковой фильтрации.
По итогам годового наблюдения за пациентами были определены паттерны впервые зарегистрированных заболеваний. Оценивались коды зарегистрированных заболеваний и диагнозы, внесенные в историю болезни пациента. Статистически значимой разница оказалась только в отношении заболеваний опорно-двигательной системы (16,7% период «Альфа» против 30,2% в период «Дельта» и 3,7% в период «Омикрон», p=0,015) (табл. 3).
Таблица 3. Заболевания, зарегистрированные после COVID-19 (впервые выявленные) в течение 12 месяцев
|
Впервые зарегистрированные заболевания |
Альфа, n (%) (n=54) |
Дельта, n (%) (n=53) |
Омикрон, n (%) (n=27) |
p |
|
ССС, n (%) |
17 (31,5) |
10 (18,9) |
3 (11,1) |
0,085 |
|
ЦНС, n (%) |
4 (7,4) |
1 (1,9) |
3 (11,1) |
0,218 |
|
ЖКТ, n (%) |
1 (1,9) |
1 (1,9) |
0 (0) |
0,774 |
|
МПС, n (%) |
1 (1,9) |
1 (1,9) |
0 (0) |
0,774 |
|
Опорно-двигательная система , n (%) |
9 (16,7) |
16 (30,2) |
1 (3,7) |
0,015 |
|
Эндокринная система, n (%) |
1 (1,9) |
1 (1,9) |
1 (3,7) |
0,847 |
|
Онкозаболевания, n (%) |
3 (5,6) |
1 (1,9) |
4 (3,0) |
0,319 |
|
Органы дыхания, n (%) |
3 (5,6) |
2 (3,8) |
0 (0) |
0,461 |
Примечание. Статистическая значимость различий качественных данных оценивалась с использованием критерия хи-квадрат (χ²) и точного критерия Фишера с поправкой Бонферрони (p≤0,0167).
Аббревиатуры. ССС — сердечно-сосудистая система, ЦНС — центральная нервная система, ЖКТ — желудочно-кишечный тракт, МПС — мочеполовая система.
При анализе симптомов было обнаружено, что они репортировались в МИС надлежащим образом в течение первых 3–5 месяцев после выписки. В связи с этим было принято решение ограничить сбор данных о декларируемых пациентом симптомах до 3 месяцев. Было отмечено, что кардиологические симптомы чаще регистрировались в группе «Дельта» (24,5%), чем в группе «Альфа» (14,8%), и не были зарегистрированы в группе «Омикрон» (p=0,017). Также было замечено, что неврологические симптомы чаще регистрировались в группах «Дельта» и «Альфа» по сравнению с группой «Омикрон» (25,9% и 30,2% против 3,7%, p=0,024). Однако после применения поправки Бонферрони статистическая значимость между группами не была установлена (p>0,0167) (рис. 1).
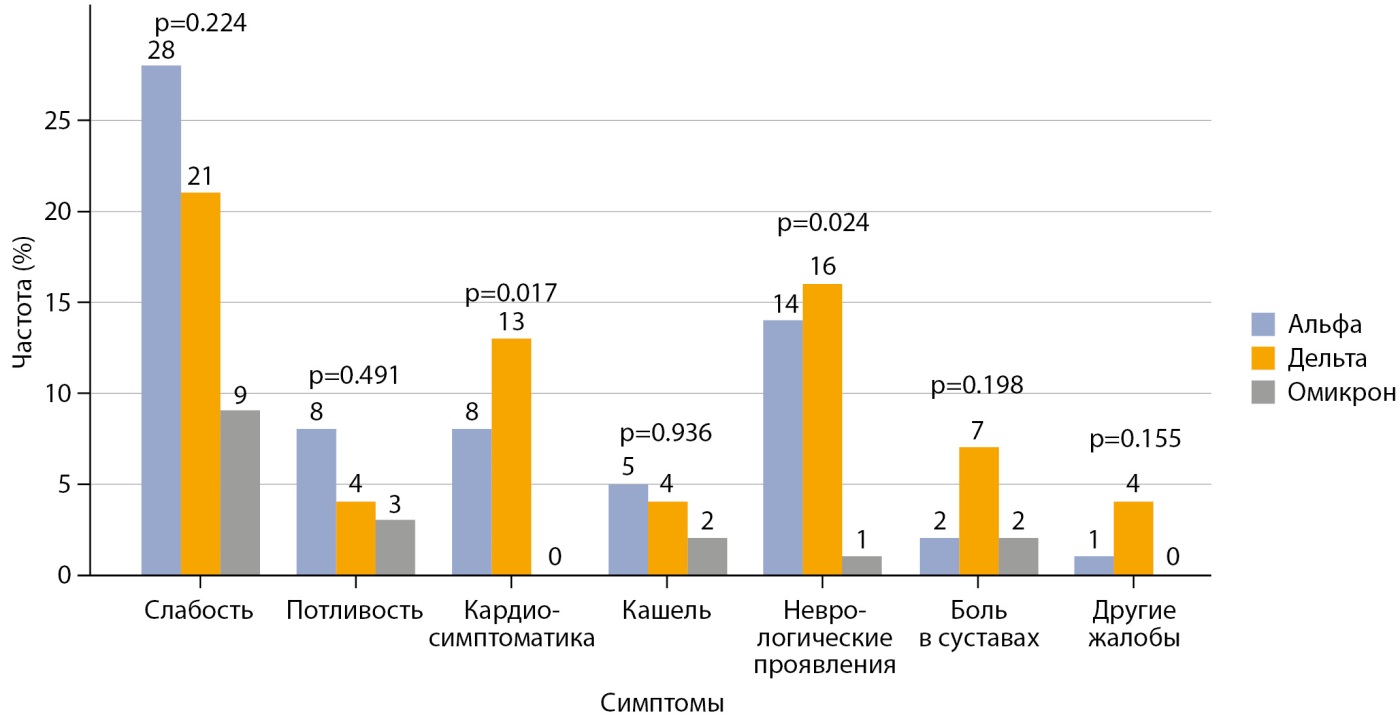
Рисунок 1. Распределение симптомов у пациентов в разные периоды инфекции Covid-19.
Примечание. Статистическая значимость различий качественных данных оценивалась с использованием критерия хи-квадрат (χ²) и точного критерия Фишера с поправкой Бонферрони (p≤0,0167).
При изучении лабораторных показателей была обнаружена разница только в отношении двух исследуемых параметров. Показатели количества тромбоцитов были значимо ниже в группах «Альфа» и «Дельта» по сравнению с группой «Омикрон» (210 (179,2–249,7) и 218 (196,5–281) х10⁹/л против 255 (208–327) х10⁹/л, соответственно, p=0,016). Отмечено удлинение АЧТВ для «Альфа» и «Дельта» по сравнению с группой «Омикрон»(28 (23,6–31,3) сек против 30,3 (26,1–34,9) сек против 27,1 (22,4–30,3) сек для «Омикрона» (p=0,013) (табл. 4).
Таблица 4. Лабораторные показатели
|
Показатели |
Альфа, (n=54) |
Дельта, (n=53) |
Омикрон, (n=27) |
р |
|
Гемограмма |
||||
|
Гемоглобин, г/л |
145 [ 133; 154,2] |
139 [ 132; 154] |
136 [ 127; 148] |
0,196 |
|
Лейкоциты, x10⁹/л |
6,9 [ 5,9; 8,6] |
6,9 [ 5,5; 8,6] |
7 [ 6,4; 8] |
0,761 |
|
Эритроциты, x10¹²/л |
4,8 [ 4,5; 5,2] |
4,7 [ 4,3; 5,3] |
4,7 [ 4,2; 5,1] |
0,583 |
|
Гематокрит, % |
0,42 [ 0,39; 0,46] |
0,41 [ 0,38; 0,43] |
0,41 [ 0,39; 0,45] |
0,147 |
|
MCV, фл |
87,7 [ 85,3; 91,1] |
87,4 [ 81,9; 90,2] |
85,4 [ 80; 90] |
0,130 |
|
MCHC, г/л |
338,5 [ 327; 346,2] |
341 [ 330; 352] |
334 [ 327; 349] |
0,387 |
|
MCH, пг |
29,9 [ 28,1; 31,3] |
29,9 [ 28,5; 31,2] |
28,9 [ 26,6; 30,4] |
0,116 |
|
RDW, % |
13 [ 12,4; 13,9] |
13,2 [ 12,4; 14,2] |
13,7 [ 12,7; 15,1] |
0,070 |
|
Тромбоциты, x10⁹/л |
210 [ 179,2; 249,7] |
218 [ 196,5; 281] |
255 [ 208; 327] |
0,016 |
|
СОЭ, мм/ч |
10 [ 7; 18] |
12 [ 7,5; 19,5] |
16 [ 10; 23] |
0,110 |
|
Биохимический анализ |
||||
|
Общ белок, г/л |
73,9 [ 69; 76,6] |
72,4 [ 69,6; 77,2] |
69,9 [ 65,5; 75,6] |
0,353 |
|
Мочевина, ммоль/л |
5,5 [ 4,6; 7,3] |
5,9 [ 4,8; 7,2] |
4,9 [ 4,2; 6,8] |
0,361 |
|
АлТ, Ед/л |
15,9 [ 13,1; 28,7] |
17 [ 13,7; 26] |
16,3 [ 11,7; 21,2] |
0,610 |
|
АсТ, Ед/л |
19 [ 15,6; 24,7] |
18,9 [ 14,2-24,2] |
17,6 [ 15,9; 21,7] |
0,765 |
|
Билирубин, мкмоль/л |
9,4 [ 7; 13,9] |
8 [ 6-12,4] |
8,2 [ 7; 12,6] |
0,248 |
|
Холестерин, ммоль/л |
5,6 [ 4,7; 6,6] |
5 [ 4,3; 6,3] |
4,8 [ 4,3; 6,2] |
0,182 |
|
СРБ, мг/л |
2,4 [ 2; 9,6] |
3,5 [ 1,4; 14,5] |
1,6 [ 1,3; 3] |
0,316 |
|
Коагулограмма |
||||
|
АЧТВ, сек |
28 [ 23,6; 31,3] |
30,3 [ 26,1; 34,9] |
27,1 [ 22,4; 30,3] |
0,013 |
|
Фибриноген, г/л |
3,4 [ 2,8; 4,1] |
3,35 [ 2,9; 3,9] |
3,3 [ 2,6; 3,8] |
0,449 |
|
ПТИ, % |
96,7 [ 83,6; 102] |
94 [ 80,4; 102,5] |
96,3 [ 80,4; 106] |
0,797 |
|
МНО |
1 [ 0,93; 1,1] |
1 [ 0,94; 1,14] |
0,98 [ 0,97; 1,0] |
0,850 |
|
D-димер, нг/мл |
306 [ 112; 546] |
463 [ 233; 608] |
520 [ 310; 987] |
0,159 |
Примечание. В таблице статистическая значимость различий показателей между группами рассчитана по критерию Краскела-Уоллиса с поправкой Бонферрони (р≤0,0167); значения представлены в виде Ме(Q2) (Q1–Q3).
Аббревиатуры. MCV — средний объем эритроцита, MCHC — средняя концентрация (насыщенность) гемоглобина в эритроците, MCH — среднее содержание гемоглобина в эритроците, RDW представляет собой степень отклонения размера эритроцитов от нормального и измеряется в процентах, СОЭ — скорость оседания эритроцитов, АлТ — аланинаминотрансфераза, АсТ — аспартатаминотрансфераза, СРБ — С-реактивный белок, АЧТВ — Активированное частичное тромбопластиновое время, ПТИ — протромбиновый индекс, МНО — международное нормализованное отношение.
В отношении других лабораторных показателей было установлено, что уровни эритроцитов, гемоглобина, лейкоцитов, МНО и ПТИ не отличались в разных вариант-ассоциированных периодах (p>0,0167). Для пациентов был характерен эритроцитоз (37–50% в зависимости от группы), нормальный уровень лейкоцитов (75,5–81,5%), высокий и нормальный уровни гемоглобина (от 40,7% до 49,1% для нормы, от 35,8% до 50% для повышенного уровня), нормальный уровень АЧТВ (73,6%–81,5%) и нормальный уровень МНО (от 81,5% до 94,4%). При этом распределение медианы АЧТВ статистически значимо различалось между группами (p=0,013), с самым высоким показателем в группе «Дельта». Статистически значимо отличался уровень тромбоцитов (p=0,01), тромбоцитопения была выявлена в следующих соотношениях: 13 (24,1%) в группе «Альфа» против 7 (13,2%) в группе «Дельта» против 1 (3,7%) в группе «Омикрон». Тромбоцитоз наблюдался в 7 (13%) случаев в группе «Альфа» против 8 (15,1%) в группе «Дельта» против 9 (33,3%) в группе «Омикрон».
Обсуждение
Впервые в Казахстане проведено исследование, в котором изучались клинические и лабораторные изменения после COVID-19 среди пациентов с СД2, а также развитие впервые диагностированных заболеваний в разные периоды заражения. Также впервые была применена методология обработки данных в реальной клинической практике (RWD) с использованием медицинской информационной системы для проверки гипотез о различии клинической картины после перенесенного заболевания COVID-19 в разные вариант-ассоциированные периоды по отношению к пациентам с СД2.
Данное исследование развивает тезисы, заложенные в предшествующих публикациях, о том, что клиническая картина COVID-19 и постковидного периода может отличаться в зависимости от вариант-зависимого периода времени [16–19]. В рамках данного исследования мы увидели, что пациенты отличаются по демографическим данным — популяция «Омикрон» менее коморбидная, чем популяции «Альфа» и «Дельта». Отмечено, что у пациентов в группах «Альфа» и «Дельта» впервые выявленные заболевания развивались чаще в течение 12 месяцев, чем у пациентов в группе «Омикрон». Неясно, связано это с вариант-зависимым периодом заболевания или с большей коморбидностью отобранной группы пациентов. Однако эти выводы хорошо согласуются с предшествующими данными [16–19]. С другой стороны, 90-дневная смертность, приписываемая COVID-19, последовательно снизилась с 42% для штамма «Альфа» до 9% и до 2% для вариантов «Дельта» и «Омикрон» соответственно [19]. Это позволяет утвердить более легкое течение периода «Омикрон».
Развитие заболеваний опорно-двигательной системы выше в группе пациентов, заболевших в вариант-ассоциированный период «Дельта». Исследователи предположили несколько объяснений этим различным жалобам со стороны опорно-двигательного аппарата, и одной из основных причин является экспрессия поверхностного рецептора ангиотензинпревращающего фермента 2 (ACE2), рецептора для связывания человеческих клеток SARS-CoV-2, в некоторых тканях, таких как мышцы, хрящи, кости и синовиальная оболочка [28]. Ревматические скелетно-мышечные проявления COVID-19 можно классифицировать как возникающие во время инфекции, вызванные лекарствами, используемыми для лечения COVID-19, после введения вакцины, а также вызванные длительным COVID-19 [29]. Однако сравнительных данных о влиянии различных геномных вариантов SARS-CoV-2 на опорно-двигательный аппарат нет. По настоящим данным можно предположить, что вариант «Дельта» оказывает наибольшее влияние на развитие заболеваний опорно-двигательного аппарата по сравнению с другими вариантами SARS-CoV-2. По остальным впервые зарегистрированным заболеваниям статистически значимой разницы обнаружено не было.
При оценке впервые выявленной симптоматики через 3 месяца после перенесенного COVID-19 было отмечено большее количество кардиологических и неврологических жалоб у пациентов «Альфа» и «Дельта» временных периодов по сравнению с периодом «Омикрон», что в целом соответствует большей заболеваемости пациентов первых двух групп. Ранее в систематическом обзоре Moussaoui El и соавт. отмечалось, что постковидный синдром может включать до 50 симптомов, самыми распространенными из которых являются усталость (58%), головная боль (44%), нарушение внимания (27%), выпадение волос (25%) и одышка (24%) [30]. С учетом того, что чаще выявлялась кардиосимптоматика, по данным обзора коморбидных патологий при COVID-19 Silaghi-Dumitrescu R и соавт. [31], сердечно-сосудистые заболевания (ССЗ) обычно связаны с тяжестью COVID-19. Косвенно манифестация кардиологической симптоматики в группах, связанных с более тяжелыми периодами COVID-19, может говорить о двунаправленности этого утверждения. Данные о распространенности неврологической симптоматики согласуются с доказательствами того, что SARS-CoV-2 оказывает долгосрочное воздействие на неврологическую систему, включая инсульт, энцефалит и другие тяжелые заболевания центральной нервной системы [32–34].
Более того, согласно данным Российского регистра СД, наибольший прирост смертности среди пациентов с СД за последние 13 лет наблюдался в 2020–2021 гг., в период пандемии новой коронавирусной инфекции. Основными причинами смертности пациентов, не связанных непосредственно с диабетом, являлись ССЗ, онкологические заболевания и коронавирусная инфекция [35]. Эти данные позволяют предположить, что коронавирусная инфекция может влиять на развитие или ухудшение заболеваний ССЗ и других органов.
Лабораторные показатели
Исследования, приведенные в обзоре о появлении новых состояний или заболеваний [36], выявили значительное повышение уровня триглицеридов, холестерина ЛПНП и общего холестерина у пациентов через 3–6 месяцев после выписки из больницы по поводу COVID-19 по сравнению с теми, кто не нуждался в госпитализации или перенес более легкое течение заболевания [37–39]. Таких изменений у пациентов не наблюдалось в рамках данного исследования.
Согласно данным исследования, у пациентов в периоде «Альфа» тромбоцитопения встречалась в 2 раза чаще, чем в периоде «Дельта» и в 7,5 раза чаще, чем в периоде «Омикрон», что может говорить о том, что в ранних периодах заболевания нарушения гемостаза были более выраженными, чем в поздних. В начале коронавирусной инфекции тромбоцитопения являлась предиктором неблагоприятного исхода и использовалась в качестве показателя тяжести заболевания при госпитализации [40][41].
Показатели АЧТВ также были выше в группе «Дельта» по сравнению с другими группами. Эти данные согласуются с результатами других исследований, где отмечена тенденция к увеличению показателей АЧТВ у пациентов с тяжелым течением инфекции [42][43]. В то же время некоторые исследователи сообщают об отсутствии разницы между пациентами, переведенными в отделение интенсивной терапии, и теми, кому не понадобилась интенсивная терапия [44][45]. Тем не менее известно, что увеличение показателя АЧТВ у пациентов с COVID-19 может быть связано с наличием волчаночного антикоагулянта, действие которого заключается в одновременном увеличении показателя АЧТВ и осложнении течения заболевания тромбозами [46]. В целом следует отметить, что в периоде «Альфа» было больше госпитализированных пациентов, чем в периоде «Омикрон», в том числе заявление о завершении пандемии было сделано 5 мая 2023 г. во время вариант-ассоциированного периода «Омикрон».
По данным Varghese J и соавт., лимфопения и низкий уровень сывороточного IgA ассоциированы с сохранением симптомов COVID-19 [47]. В то же время другие авторы отметили, что количество лимфоцитов, уровень СРБ, СОЭ и концентрация глюкозы были выявлены как ключевые маркеры для диагностики и мониторинга постковидного синдрома [48]. Однако в данном исследовании не выявлено статистически значимой разницы между группами по показателям, отражающим воспалительные процессы. Возможно, это связано с естественным снижением уровня СРБ. По данным исследования Washirasaksiri C и соавт., среднее значение СРБ значительно снизилось между 3- и 6-месячными визитами и распространенность долгосрочных отклонений СРБ составила только у 14,8% пациентов [49]. Кроме того, в другом исследовании было выявлено, что у пациентов, инфицированных вариантом «Дельта», наблюдалось более низкое количество лимфоцитов и уровень СОЭ. Это позволяет предположить, что вариант «Дельта» может нарушать иммунную функцию и вызывать менее выраженную неспецифическую воспалительную реакцию [50]. В связи с вышеизложенным, дальнейшие проспективные исследования должны сосредоточиться на детальном анализе лабораторных изменений, связанных с постковидным синдромом, в контексте различных периодов, ассоциированных с доминированием различных вариантов коронавирусной инфекции. Это позволит более глубоко понять потенциальные различия в патофизиологических механизмах и клинических проявлениях постковидного состояния, обусловленных циркулирующими вариантами SARS-CoV-2.
Ограничения исследования
Одним из ограничений исследования стало недостаточное репортирование данных, что могло быть обусловлено различными факторами, включая особенности работы с МИС, возможные ограничения во времени у врачей или неполное предоставление информации пациентами. В результате период сбора данных о симптомах был сокращен до 3 месяцев. Однако, поскольку заболевания фиксировались по кодам МКБ, трудностей при анализе заболеваемости в первый год после COVID-19 не возникло. Также важным ограничением оказался переход пациентов под наблюдение клиник, которые пользуются другими медицинскими информационными системами. Это также было фактором потери данных, потому что в Республике Казахстан в настоящее время не сформирован единый цифровой контур. Отмечалось также недостаточное репортирование целевых уровней HbA1c для менеджмента СД2, что привело к отсутствию статистики по HbA1c в диабет-ассоциированной аналитике.
Заключение
Таким образом, данные реальной клинической практики позволяют проследить за развитием новой симптоматики и новых заболеваний пациента в постковидном периоде. Пациенты с СД2 во временной вариант-ассоциированный период «Омикрон» имели меньший риск развития новых симптомов и заболеваний, по сравнению с остальными периодами. Необходимо внедрять решения для контроля целевых показателей HbA1c через медицинские информационные системы и повышать стандарты качества репортирования симптоматики пациентов для более точного RWD-анализа.
Дополнительная информация
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Алтынбекова С.А. — разработка дизайна исследования, выгрузка данных, подготовка статистических таблиц, анализ и интерпретация данных, написание статьи; Фадеев В.В. — разработка концепции и дизайна исследования, внесение в рукопись существенных правок; Абылайулы Ж. — разработка концепции и дизайна исследования, анализ и интерпретация данных, написание статьи; Большакова С.В. — разработка концепции и дизайна исследования, внесение в рукопись финальной правки.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. National Institute for Health and Care Excellence (NICE). COVID-19 rapid guideline: managing the long-term effects of COVID-19 (NG188). URL: https://www.nice.org.uk/guidance/ng188
2. Oronsky B, Larson C, Hammond TC, et al. A Review of Persistent Post-COVID-19 Syndrome (PPCS). Clin Rev Allergy Immunol. 2021;20:1-9. https://doi.org/10.1007/s12016-021-08848-3
3. Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome. Nat. Med. 2021;27:601–615. https://doi.org/10.1038/s41591-021-01283-z
4. Bell ML, Catalfamo CJ, Farland LV, et al. Post-acute sequelae of COVID-19 in a non-hospitalized cohort: results from the Arizona CoVHORT. PLoS One. 2021;16. https://doi.org/10.1371/journal.pone.0254347
5. de Almeida-Pititto B, Dualib PM, Zajdenverg L, et al. Brazilian Diabetes Society Study Group (SBD). Severity and mortality of COVID-19 in patients with diabetes, hypertension and cardiovascular disease: a meta-analysis. Diabetol Metab Syndr. 2020;12:75. https://doi.org/10.1186/s13098-020-00586-4
6. Huang I, Lim MA, Pranata R. Diabetes mellitus is associated with increased mortality and severity of disease in COVID-19 pneumonia - a systematic review, meta-analysis, and meta-regression. Diabetes Metab Syndr. 2020;14:395–403. https://doi.org/10.1016/j.dsx.2020.04.018
7. Vigili de Kreutzenberg S. Long COVID-19 and diabetes mellitus: a short review. Metabolism and Target Organ Damage. 2023;3(1):4. doi: http://dx.doi.org/10.20517/mtod.2022.30
8. Состояние после COVID-19 (постковидный синдром) у взрослых. Клинический протокол диагностики и лечения РК 2023 год
9. Chen C, Haupert SR, Zimmermann L, Shi X, Fritsche LG, Mukherjee B. Global Prevalence of Post-Coronavirus Disease 2019 (COVID-19) Condition or Long COVID: A Meta-Analysis and Systematic Review. J Infect Dis. 2022;226(9):1593-1607. https://doi.org/10.1093/infdis/jiac136
10. Fernández-de-las-Peñas C, Palacios-Ceña D, Gómez-Mayordomo V, et al. Prevalence of post-COVID-19 symptoms in hospitalized and non-hospitalized COVID-19 survivors: A systematic review and meta-analysis. Eur J Intern Med. 2021;92:55-70. https://doi.org/10.1016/j.ejim.2021.06.009
11. Subramanian A, Nirantharakumar K, Hughes S, et al. Symptoms and risk factors for long COVID in non-hospitalized adults. Nat Med. 2022;28(8):1706-1714. https://doi.org/10.1038/s41591-022-01909-w
12. Lopez-Leon S, Wegman-Ostrosky T, Perelman C, et al. More than 50 long-term effects of COVID-19: a systematic review and meta-analysis. Sci Rep. 2021;11(1):16144. https://doi.org/10.1038/s41598-021-95565-8
13. Liang L, Yang B, Jiang N, et al. Three-month follow-up study of survivors of coronavirus disease 2019 after discharge. J Korean Med Sci. 2020;35:e418. https://doi.org/10.3346/jkms.2020.35.e418
14. Huang C, Huang L, Wang Y, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397:220-32. https://doi.org/10.1016/S0140-6736(20)32656-8
15. Pavli A, Theodoridou M, Maltezou HC. Post-COVID syndrome: incidence, clinical spectrum, and challenges for primary healthcare professionals. Arch Med Res. 2021;52:575-81. https://doi.org/10.1016/j.arcmed.2021.03.010
16. Antonelli M, Pujol JC, Spector TD, Ourselin S, Steves CJ. Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2. Lancet. 2022;399:2263–2264. https://doi.org/10.1016/S0140-6736(22)00941-2
17. Cortellini A, Tabernero J, Mukherjee U, Salazar R, Sureda A, et al. SARS-CoV-2 omicron (B.1.1.529)-related COVID-19 sequelae in vaccinated and unvaccinated patients with cancer: results from the OnCovid registry. Lancet Oncol. 2023;24:335–346. https://doi.org/10.1016/S1470-2045(23)00056-6
18. Kahlert CR, Strahm C, Güsewell S, Cusini A, Brucher A, et al. Post-Acute Sequelae After Severe Acute Respiratory Syndrome Coronavirus 2 Infection by Viral Variant and Vaccination Status: A Multicenter Cross-Sectional Study. Clin. Infect. Dis. 2023;77:194–202. https://doi.org/10.1093/cid/ciad143
19. Willan J, Agarwal G, Bienz N. Mortality and burden of post-COVID-19 syndrome have reduced with time across SARS-CoV-2 variants in haematology patients. Br. J. Haematol. 2023;201:640–644. https://doi.org/10.1111/bjh.18700
20. Elliott L, Fidler C, Ditchfield A, Stissing T. Hypoglycemia Event Rates: A Comparison Between Real-World Data and Randomized Controlled Trial Populations in Insulin-Treated Diabetes. Diabetes Ther. 2016;7(1):45-60. https://doi.org/10.1007/s13300-016-0157-z
21. Liebl A, Prager R, Binz K, Kaiser M, Bergenstal R, Gallwitz B. Comparison of insulin analogue regimens in people with type 2 diabetes mellitus in the PREFER Study: a randomized controlled trial. Diabetes Obes Metab. 2009;11(1):45–52. https://doi.org/10.1111/j.1463-1326.2008.00915.x
22. Ligthelm RJ, Borzi V, Gumprecht J, Kawamori R, Wenying Y, Valensi P. Importance of observational studies in clinical practice. Clin Ther. 2007;29(6 Pt 1):1284–1292. https://doi.org/10.1016/j.clinthera.2007.07.004
23. Gough SCL, Bhargava A, Jain R, Mersebach H, Rasmussen S, Bergenstal RM. Low volume insulin degludec 200 U/ml once-daily improves glycaemic control similar to insulin glargine with a low risk of hypoglycemia in insulin-naïve patients with type 2 diabetes: a 26-week, randomized, controlled, multinational, treat-to-target trial: the BEGIN™ LOW VOLUME trial. Diabetes Care. 2013;36(9):2536–2542. https://doi.org/10.2337/dc12-2329
24. American Diabetes Association Workgroup on Hypoglycemia Defining and reporting hypoglycemia in diabetes: a report from the American Diabetes Association Workgroup on Hypoglycemia. Diabetes Care. 2005;28(5):1245–1249. https://doi.org/10.2337/diacare.28.5.1245
25. Amiel SA, Dixon T, Mann R, Jameson K. Hypoglycaemia in Type 2 diabetes. Diabet Med. 2008;25(3):245–254. https://doi.org/10.1111/j.1464-5491.2007.02341.x
26. Swinnen SG, Mullin s P, Miller M, Hoekstra JB, Holleman F. Changing the glucose cut-off values that define hypoglycaemia has a major effect on reported frequencies of hypoglycaemia. Diabetologia. 2009;52(1):38–41. https://doi.org/10.1007/s00125-008-1147-0
27. Клинический протокол диагностики и лечения сахарного диабета РК 2022 г.
28. Pal A, Roongta R, Mondal S, Sinha D, Sinhamahapatra P, Ghosh A, et al. Does post-COVID-19 reactive arthritis exist ? Experience of a tertiary care centre with a review of the literature. Reumatol Clin. 2023;19:67–73. https://doi.org/10.1016/j.reuma.2022.03.004
29. Jafarzadeh A, Gosain R, Mortazavi SMJ, Nemati M, Jafarzadeh S, Ghaderi A. SARS-CoV-2 Infection: A Possible Risk Factor for Incidence and Recurrence of Cancers. Int J Hematol Stem Cell Res. 2022. https://doi.org/10.18502/ijhoscr.v16i2.9205
30. El Moussaoui R, Opmeer BC, de Borgie CA, et al. Long-term symptom recovery and health-related quality of life in patients with mild-to-moderate-severe community-acquired pneumonia. Chest. 2006;130(4):1165-1172. https://doi.org/10.1378/chest.130.4.1165
31. Radu Silaghi-Dumitrescu, Iulia Patrascu, Maria Lehene and Iulia Bercea. Comorbidities of COVID-19 Patients. Medicina (Kaunas). 2023; 59(8):1393. https://doi.org/10.3390/medicina59081393
32. Cleret de Langavant L, Petit A, Nguyen QTR, et al. Clinical description of the broad range of neurological presentations of COVID-19: A retrospective case series. Rev Neurol (Paris). 2021;177(3):275-282. https://doi.org/10.1016/j.neurol.2021.01.004
33. García-Azorín D, Abildúa MJA, Aguirre MEE, et al. Neurological presentations of COVID-19: Findings from the Spanish Society of Neurology neuroCOVID-19 registry. J Neurol Sci. 2021;423:117283. https://doi.org/10.1016/j.jns.2020.117283
34. U Farooque, S Shabih, S Karimi, AK Lohano, S Kataria. Coronavirus Disease 2019-Related Acute Ischemic Stroke: a Case Report Cureus, 2020;12(9)(). https://doi.org/10.7759/cureus.10310
35. Dedov II, Shestakova MV, Vikulova OK, Zheleznyakova AV, et al. Diabetes mellitus in the Russian Federation: dynamics of epidemiological indicators according to the Federal Register of Diabetes Mellitus for the period 2010–2022. Diabetes mellitus. 2023; 26(2):104-123. https://doi.org/10.14341/DM13035
36. Wrona M, Skrypnik D. New-Onset Diabetes Mellitus, Hypertension, Dyslipidaemia as Sequelae of COVID-19 Infection-Systematic Review. Int J Environ Res Public Health. 2022;19(20):13280. https://doi.org/10.3390/ijerph192013280
37. Gameil MA, Marzouk RE, Elsebaie AH. Rozaik SE, Journal EL. Long-Term clinical and biochemical residue after COVID-19 recovery. Egypt Liver J. 2021;11:74. https://doi.org/10.1186/s43066-021-00144-1
38. Dennis A, Wamil M, Alberts J, Oben J, Cuthbertson DJ, et al. Multiorgan impairment in low-Risk individuals with post-COVID-19 syndrome: A prospective, community-Based study. BMJ Open. 2021;11:e048391. https://doi.org/10.1136/bmjopen-2020-048391
39. Li W, Moore MJ, Vasllieva N, Sui J, Wong SK, Berne MA. Angiotensin-Converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;426:450–454. https://doi.org/10.1038/nature02145
40. Bitsadze V, Khizroeva J, Makatsariya A, et al. COVID-19, septic shock and syndrome of disseminated intravascular coagulation syndrome. Part 2. Vestn Ross Akad Meditsinskikh Nauk. 2020. https://doi.org/10.15690/vramn1336
41. Lippi G, Plebani M, Henry MB. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: a meta-analysis. Clin Chim Acta. 2020;506:145−148. https://doi.org/10.1016/j.cca.2020.03.022.
42. Wan S, Xiang Y, Fang W, et al. Clinical features and treatment of COVID‐19 patients in northeast Chongqing. J Med Virol. 2020;92(7):797-806. https://doi.org/10.1002/jmv.25783
43. 43. Guo T, Fan Y, Chen M, et al. Cardiovascular Implications of Fatal Outcomes of Patients with Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020. https://doi.org/10.1001/jamacardio.2020.1017
44. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844-847. https://doi.org/10.1111/jth.14768
45. Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. https://doi.org/10.1016/S0140-6736(20)30183-5
46. Helms J, Tacquard C, Severac F, et al. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6):1089-1098. https://doi.org/10.1007/s00134-020-06062-x
47. Varghese J, Sandmann S, Ochs K, et al. Persistent symptoms and lab abnormalities in patients who recovered from COVID-19. Sci Rep. 2021;11(1):12775. https://doi.org/10.1038/s41598-021-91270-8
48. Robu Popa D, Melinte OE, Dobrin M-E, et al. Laboratory Diagnostics Accuracy for COVID-19 versus Post-COVID-19 Syndrome in Lung Disease Patients with Multimorbidity. J Pers Med. 2024;14(2):171. https://doi.org/10.3390/jpm14020171
49. Washirasaksiri C, Sayabovorn N, Ariyakunaphan P, et al. Long-term multiple metabolic abnormalities among healthy and high-risk people following nonsevere COVID-19. Sci Rep. 2023;13(1):14336. https://doi.org/10.1038/s41598-023-41523-5
50. Fanglin Li, Jiayi Deng, Canbin Xie, Guyi Wang, Min Xu, Chenfang Wu, Jinxiu Li. The differences in virus shedding time between the Delta variant and original SARS-CoV-2 infected patients. Front Public Health. 2023;11:1132643. https://doi.org/10.3389/fpubh.2023.1132643
Об авторах
С. А. АлтынбековаКазахстан
Алтынбекова Сауле Абайкызы - магистр медицинских наук, докторант.
Алматы, 050031, Райымбек 522/1-190
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. В. Фадеев
Россия
Фадеев Валентин Викторович - д.м.н., профессор, член-корр. РАН.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ж. Абылайулы
Казахстан
Абылайулы Жангентхан - д.м.н., профессор.
Алматы
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. В. Большакова
Казахстан
Большакова Светлана Викторовна - к.м.н., доцент.
Алматы
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Распределение симптомов у пациентов в разные периоды инфекции Covid-19. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(191KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Алтынбекова С.А., Фадеев В.В., Абылайулы Ж., Большакова С.В. Ретроспективный анализ особенностей постковидного периода у пациентов с сахарным диабетом 2 типа, заболевших в разные вариант-ассоциированные периоды COVID-19. Сахарный диабет. 2024;27(5):441-450. https://doi.org/10.14341/DM13179
For citation:
Altynbekova S.A., Fadeev V.V., Abilayuly Z., Bolshakova S.V. Retrospective Analysis of the Characteristics of the Post-COVID Period in Patients with Type 2 Diabetes, Infected During Different Variant-Associated Periods of COVID-19. Diabetes mellitus. 2024;27(5):441-450. (In Russ.) https://doi.org/10.14341/DM13179

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































