Перейти к:
Частота и характеристика осложнений и сопутствующих заболеваний у детей с сахарным диабетом 1 типа, заболевших в дошкольном возрасте
https://doi.org/10.14341/DM13136
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет 1 типа (СД1) — хроническое заболевание, основными причинами инвалидизации, смертности и снижения качества жизни при котором являются острые и хронические осложнения. Возникновение СД1 в детском возрасте связано со значительным снижением продолжительности жизни и более высоким риском сердечно-сосудистых осложнений. Кроме того, хроническое течение СД1 часто сопровождают и другие аутоиммунные заболевания (аутоиммунный тиреоидит (АИТ), целиакия), а также сопутствующие состояния (задержка роста, дислипидемия и др.), имеющие самостоятельное значение.
ЦЕЛЬ. Оценить частоту и дать клиническую характеристику осложнений, сопутствующих заболеваний и состояний у детей с СД1, заболевших в дошкольном возрасте.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое одномоментное исследование, включающее данные 396 детей в возрасте 4–18 лет с ранее диагностированным СД1, длительностью не менее 3 и не более 10 лет, находящихся на интенсифицированной инсулинотерапии. В зависимости от возраста диагностики СД1 участники исследования были распределены на две группы: с манифестацией СД1 моложе 7 лет и с манифестацией СД1 старше 7 лет.
РЕЗУЛЬТАТЫ. Медиана возраста составила 11,9 [9,3; 14,9] года, длительности заболевания — 5,2 [3,9; 6,9] года, уровня гликированного гемоглобина — 7,9 [7,2; 9,2]%. Группы пациентов не различались по полу, продолжительности заболевания и SDS индекса массы тела. Уровень гликированного гемоглобина (р=0,011) и SDS роста (р=0,041) были выше у детей с манифестацией СД1 старше 7 лет. По результатам регрессионного анализа, с учетом коррекции на возраст детей на момент обследования, установлена прямая зависимость между манифестацией СД1 в дошкольном возрасте и ретинопатией (β=4,95), микроальбуминурией (β=2,64) и задержкой роста (SDS роста менее 2) (β=1,22). Напротив, снижение скорости клубочковой фильтрации было связано с более старшим возрастом манифестации СД1 (р=0,012). После коррекции на возраст частота АИТ, целиакии и дислипидемии значимо не различалась в зависимости от возраста диагностики СД1.
ЗАКЛЮЧЕНИЕ. Полученные данные указывают на важное значение манифестации СД1 в дошкольном возрасте как независимого фактора риска сосудистых осложнений у детей и замедления линейного роста. Несмотря на то, что точные причины на сегодняшний день не вполне понятны, эти данные диктуют необходимость к более тщательному и строгому контролю СД1 у маленьких детей, начиная с самого начала заболевания.
Для цитирования:
Лаптев Д.Н., Еремина И.А., Гончарова Н.А., Федоринин А.А. Частота и характеристика осложнений и сопутствующих заболеваний у детей с сахарным диабетом 1 типа, заболевших в дошкольном возрасте. Сахарный диабет. 2025;28(5):416-423. https://doi.org/10.14341/DM13136
For citation:
Laptev D.N., Eremina I.A., Goncharova N.A., Fedorinin A.A. Frequency and characteristics of complications and concomitant diseases in children with type 1 diabetes mellitus who fell ill in preschool age. Diabetes mellitus. 2025;28(5):416-423. (In Russ.) https://doi.org/10.14341/DM13136
ВВЕДЕНИЕ
Сахарный диабет 1 типа (СД1) — хроническое заболевание, основными причинами инвалидизации, смертности и снижения качества жизни при котором являются острые и хронические осложнения. Считается, что возникновение СД1 в детском возрасте связано со значительным снижением продолжительности жизни и более высоким риском сердечно-сосудистых осложнений [1].
СД1 в дошкольном возрасте характеризуется более выраженными колебаниями гликемии, что связано с более лабильным образом жизни (питание, двигательная активность, психоэмоциональное состояние и пр.), а также техническими ограничениями, связанными с введением инсулина и измерением уровня глюкозы [2]. Возникновение хронических осложнений СД1 определяется длительностью воздействия и уровнем гипергликемии, а также вариабельностью гликемии [3–5]. Так как у детей с СД1, диагностированным в дошкольном возрасте, ожидается большая длительность заболевания, данные обстоятельства могут указывать на повышенный риск формирования хронических осложнений в данной возрастной группе. В то же время наихудшие показатели гликемического контроля отмечаются, напротив, у детей подросткового возраста [6]. Подростковый возраст является самостоятельным фактором риска возникновения сосудистых осложнений [7]. Все это создает неопределенность в отношении риска возникновения сосудистых осложнений у детей с СД1 в разном возрасте.
В настоящее время использование новых препаратов инсулина у детей, широкое распространение современных технологий (инсулиновых помп, в том числе с обратной гибридной связью, систем мониторирования глюкозы) позволяют достигать целей лечения у большего количества детей с СД1. В связи с этим актуальными представляются исследования частоты и выраженности осложнений СД1 у детей в современных условиях.
Помимо сосудистых осложнений, хроническое течение СД1 часто сопровождают и другие аутоиммунные заболевания (аутоиммунный тиреоидит (АИТ), целиакия), а также сопутствующие состояния (задержка роста, дислипидемия и др.), имеющие самостоятельное значение [8]. Необходимо учитывать эти состояния при наблюдении детей с СД1, для чего важно определить факторы риска их возникновения, включая возраст манифестации заболевания.
ЦЕЛЬ
Оценить частоту и дать клиническую характеристику осложнений, сопутствующих заболеваний и состояний у детей с СД1, заболевших в дошкольном возрасте.
МЕТОДЫ
Место и время проведения исследования
Набор пациентов, биохимические, гормональные и иммунологические исследования проводились в детском отделении сахарного диабета Института детской эндокринологии ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России.
Время исследования. В исследование включены пациенты, проходившие стационарное обследование с января 2016 по июль 2021 гг.
Изучаемые популяции
В исследование было включено 396 детей в возрасте 4–18 лет с ранее диагностированным СД1 согласно общепринятым критериям, длительностью не менее 3 и не более 10 лет, находящихся на интенсифицированной инсулинотерапии.
Нижняя граница включения по длительности заболевания (не менее 3 лет) была обусловлена длительностью, при которой вероятно обнаружение осложнений, а верхняя — для сопоставимости групп: максимальная длительность СД1 при манифестации в возрасте 7 лет не будет превышать 10 лет.
Анализ в подгруппах
В зависимости от возраста диагностики СД1 пациенты были распределены на две группы: с манифестацией СД1 моложе 7 лет и с манифестацией СД1старше 7 лет.
Дизайн исследования
Одноцентровое одномоментное исследование.
Регистрируемые данные
Общеклинические данные включали показатели возраста диагностики СД1, возраст на момент обследования пациентов, рост, вес, индекс массы тела (ИМТ), Z-оценку (SDS) роста и ИМТ.
Гликированный гемоглобин (HbA1c) определялся методом жидкостной ионообменной хроматографии на анализаторе Diastat (BioRad, США).
Лабораторное обследование включало определение в крови общего холестерина, холестерина липопротеинов высокой (ЛПВП) и низкой плотности (ЛНПН), триглицеридов, креатинина с расчетом скорости клубочковой фильтрации (рСКФ). Указанные биохимические исследования проводили на аппарате Beckman-Coulter AU-480 (Япония) с использованием тест-систем производителя аппарата.
Наличие дислипидемии устанавливалось при выявлении двух и более «высоких» и/или «низких» показателей: общий холестерин ≥5,2 ммоль/л, триглицериды >1,3 (для детей до 10 лет); ≥1,7 (для детей старше 10 лет) ммоль/л, ЛПВП≤0,9 (мальчики) и ≤1,03 (девочки) ммоль/л, ЛПНП≥3,0 ммоль/л.
СКФ рассчитывалась по формуле Шварца (модификация Bedside) [9]. Несмотря на то, что это общепринятый способ расчета, он может быть не оптимальным для детей с рСКФ>75 мл/мин/1,73 м² [10], поэтому в этой работе снижением рСКФ считался уровень менее 75 мл/мин/1,73 м².
Экскрецию альбумина с мочой, соотношение альбумин/креатинин определяли в утренней порции мочи иммунотурбидиметрическим методом с использованием стандартного набора на автоматическом анализаторе Beckman Couter по методике производителя. Наличие микроальбуминурии (МАУ) подтверждалось соотношением альбумин/креатинин от 3 до 30 мг/ммоль как минимум в двух из трех образцов.
Определение аутоантител к тиреопероксидазе (АТ к ТПО) проводилось методом хемилюминесцентного иммуноанализа на автоматическом анализаторе ARCHITECT i2000 (Abbott). Положительным результатом считался уровень АТ к ТПО выше 5,6 ЕД/мл. Определение антител к трансглутаминазе и глиадину проводили методом иммуноферментного анализа (ELISA) с помощью коммерческих наборов ORGENTEC, Германия. Измерение оптической плотности проводили на счетчике 1420 Multilabel Counter VICTOR2 (Perkin Elmer).
АИТ устанавливался на основании наличия АТ к ТПО и характерных ультразвуковых изменений структуры щитовидной железы. Предположительный диагноз целиакии устанавливался на основании повышения уровня антител к глиадину IgA и тканевой трансглутаминазе IgA.
При осмотре неврологом проводилось исследование периферической чувствительности (в том числе температурной, вибрационной, тактильной). Дистальная диабетическая нейропатия диагностировалась при снижении чувствительности на стопах по общепринятой методике.
Диагностика диабетической ретинопатии осуществлялась офтальмологом по общепринятой методике.
Статистический анализ
Статистическая обработка проводилась в Python 3.10.2 с использованием открытой библиотеки SciPy 1.11.3 [11].
Непрерывные данные представлены в виде медианы (Me), нижнего и верхнего квартилей [ Q1; Q3], если не указано другого. Различие между непрерывными признаками оценивалось с помощью критерия Манна-Уитни. Номинативные данные описывались в виде абсолютной (n) и относительной частот (%). Доверительный интервал (ДИ) для биноминальных пропорций (частот) рассчитывался с использованием точного метода Клоппера-Пирсона. Для сравнения частот в изучаемых группах использовались таблица кросстабуляции и статистика χ² с поправкой на непрерывность, когда это необходимо (количество ожидаемых наблюдений в любой из ячеек <5). Статистически значимыми считались различия при p<0,05.
В случаях, когда признаки имели зависимость от возраста пациентов и возраста манифестации СД1, была выполнена корректировка на конфаундеры (возраст) с использованием логистической регрессии.
Этическая экспертиза
Протокол исследования одобрен локальным комитетом по этике ФГБУ «НМИЦ эндокринологии» Минздрава России (выписка из протокола №26 от 22.12.2021). Родители пациентов дали добровольное согласие на их участие в исследовании.
РЕЗУЛЬТАТЫ
Во всей выборке медиана возраста составила 11,9 [ 9,3; 14,9] года, длительности заболевания — 5,2 [ 3,9; 6,9] года, уровня гликированного гемоглобина — 7,9 [ 7,2; 9,2]%.
Характеристика пациентов в группах
Пациенты в группах исследования не различались между собой по полу и продолжительности заболевания. Уровень гликированного гемоглобина был выше у детей с манифестацией СД1 в старшем возрасте (р=0,011) (табл. 1).
Таблица 1. Характеристика пациентов в группах в зависимости от возраста манифестации сахарного диабета 1 типа
|
Показатель |
Манифестация СД1 старше 7 лет n=179 |
Манифестация СД1 до 7 лет n=217 |
p |
|
Общая характеристика |
|||
|
Пол, муж, n (%) |
52,5 (44,9–60,0) |
51,6 (44,8–58,4) |
0,858 |
|
Возраст, годы |
15,3 [ 13,6; 16,8] |
9,7 [ 7,4; 11,1] |
<0,001 |
|
Длительность СД1, годы |
5,0 [ 3,7; 7,0] |
5,4 [ 4,1; 6,9] |
0,261 |
|
Возраст манифестации СД1, годы |
9,2 [ 8,2; 10,6] |
3,7 [ 2,1; 5,6] |
<0,001 |
|
HbA1c, % |
8,1 [ 7,3; 9,7] |
7,8 [ 7,1; 8,8] |
0,011 |
|
Антропометрические показатели |
|||
|
Рост, SDS |
0,5 [ -0,2; 1,0] |
0,1 [ -0,5; 1,0] |
0,041 |
|
ИМТ, SDS |
0,4 [ -0,7; 1,0] |
0,2 [ -0,4; 0,7] |
0,114 |
|
Инсулинотерапия |
|||
|
СДИ, Ед/кг |
0,9 [ 0,7; 1,1] |
0,9 [ 0,7; 1,0] |
0,318 |
Примечание: данные представлены в виде медианы и квартилей (Me [ Q1; Q3]) или % (95% ДИ). HbA1c — гликированный гемоглобин; ИМТ — индекс массы тела; СД1 — сахарный диабет 1 типа; СДИ — суточная доза инсулина.
SDS роста был выше у детей, заболевших СД1 в возрасте старше 7 лет (р=0,041), а SDS ИМТ не различался между группами (р=0,114).
Общая суточная доза инсулина была больше у детей, заболевших СД1 в старшем возрасте (p<0,001), в то же время суточная доза инсулина в пересчете на килограмм веса значимо не различалась между группами (р=0,318).
Распространенность осложнений и сопутствующих заболеваний
При анализе частоты осложнений было установлено, что у детей с манифестацией СД1 в дошкольном возрасте отмечается меньшая частота нейропатии, в то же время частота ретинопатии, микроальбуминурии и снижения рСКФ менее 75 мл/мин/1,73 м² значимо не различались между группами (рис. 1).
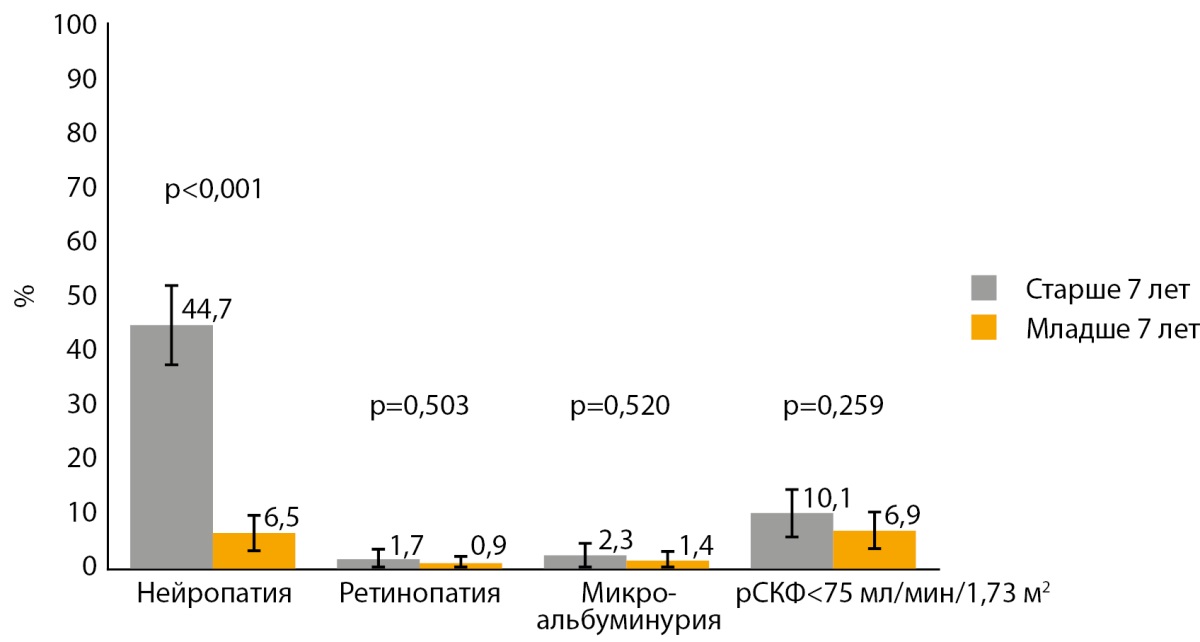
Рисунок 1. Частота осложнений у детей в зависимости от возраста манифестации сахарного диабета 1 типа.
Примечание: данные представлены в виде % (столбцы) и 95%ДИ. рСКФ — расчетная скорость клубочковой фильтрации.
Учитывая более младший возраст, у детей с манифестацией СД1 в дошкольном возрасте отмечалась тенденция к меньшей распространенности сопутствующих заболеваний и состояний, однако статистической значимости данная тенденция не имела. В то же время среди детей с манифестацией СД1 в дошкольном возрасте имелась не значимая (р=0,098) тенденция к большей частоте SDS роста менее 2 (рис. 2).
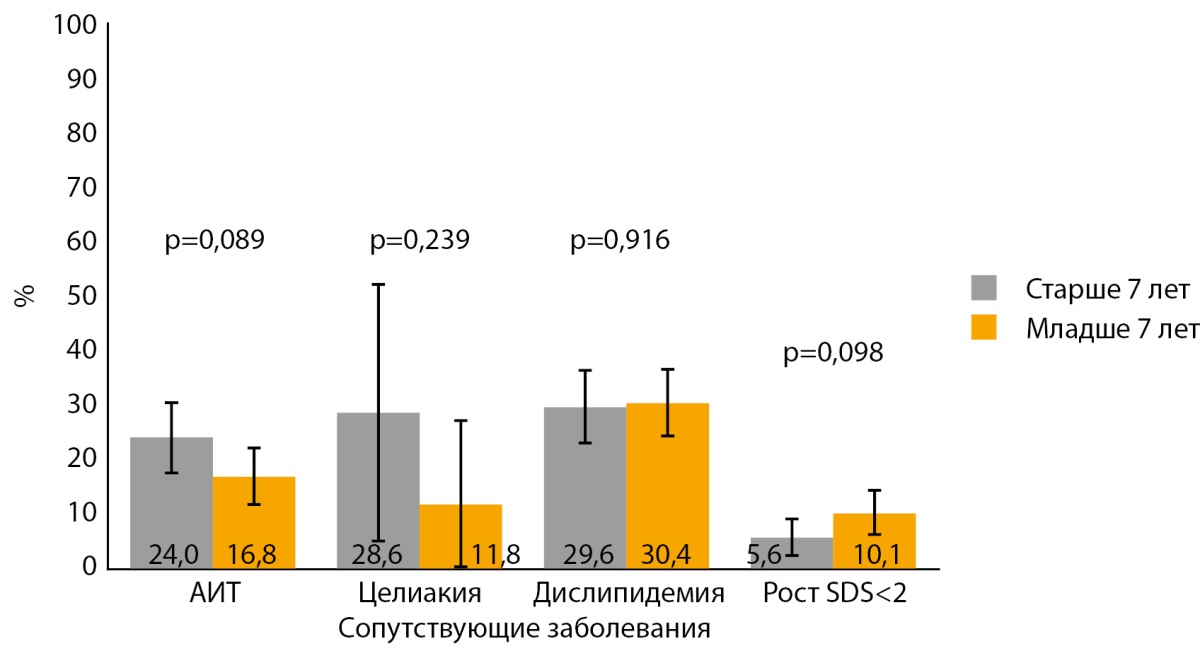
Рисунок 2. Частота сопутствующих заболеваний и состояний у детей в зависимости от возраста манифестации сахарного диабета 1 типа.
Примечание: данные представлены в виде % (столбцы) и 95%ДИ. АИТ — аутоиммунный тиреоидит.
Регрессионный анализ
Для оценки независимого влияния возраста манифестации на осложнения и сопутствующие состояния был проведен регрессионный анализ.
По результатам регрессионного анализа (табл. 2), с учетом коррекции на возраст детей на момент обследования, возраст манифестации СД1 в дошкольном возрасте был значимо связан с более высоким риском развития ретинопатии (р=0,014), МАУ (р=0,043) и снижением роста менее 2 SDS (р=0,036). Напротив, снижение рСКФ было связано с более старшим возрастом манифестации СД1 (р=0,012).
Таблица 2. Результаты многомерной логистической регрессии между возрастом манифестации и осложнениями сахарного диабета 1 типа и сопутствующими состояниями
|
Осложнение |
Возраст манифестации до 7 лет |
||||
|
Бета-коэфф. |
Станд. ошиб. |
Р |
Бета 95% ДИ |
R² |
|
|
Нейропатия |
0,12 |
0,45 |
0,794 |
-0,76; 0,99 |
0,35 |
|
Ретинопатия |
4,95 |
2,02 |
0,014 |
0,98; 8,91 |
0,36 |
|
МАУ |
2,64 |
1,30 |
0,043 |
0,08; 5,20 |
0,13 |
|
Рост SDS<2 |
1,22 |
0,58 |
0,036 |
0,08; 2,35 |
0,01 |
|
Снижение рСКФ |
-1,51 |
0,60 |
0,012 |
-2,68; -0,34 |
0,04 |
|
АИТ |
-0,34 |
0,41 |
0,396 |
-1,14; 0,45 |
0,01 |
|
Целиакия |
-0,87 |
1,45 |
0,547 |
-3,71; 1,97 |
0,05 |
|
Дислипидемия |
0,51 |
0,44 |
0,165 |
-0,18; 1,06 |
0,01 |
Примечание: для каждого анализа: в качестве зависимой переменной — осложнение, в качестве независимых переменных — возраст манифестации (до или после 7 лет) и возраст (в годах). ДИ — доверительный интервал для бета-коэффициента регрессии; АИТ — аутоиммунный тиреоидит; ДИ — доверительный интервал; МАУ — микроальбуминурия; рСКФ — расчетная скорость клубочковой фильтрации.
После коррекции на возраст пациентов частота сопутствующих заболеваний и состояний — АИТ, целиакии и дислипидемии —значимо не различались в группах с разным возрастом манифестации СД1.
ОБСУЖДЕНИЕ
В нашей работе представлены результаты анализа клинических характеристик, частоты осложнений и сопутствующих заболеваний у детей с манифестацией СД1 в дошкольном возрасте. Критерии включения позволили добиться сопоставимости групп по длительности СД1, что значительно облегчило дальнейший анализ. Вместе с тем другим значимым фактором, влияющим на возникновение осложнений СД1, является возраст, что потребовало проведения дополнительного регрессионного анализа.
Общие характеристики групп исследования в зависимости от возраста манифестации СД1 существенно не различалась между собой. С учетом различного возраста у детей с манифестацией СД1 в дошкольном возрасте были ниже антропометрические показатели и общая среднесуточная доза инсулина. Показатели, различия между которыми не объясняются возрастом, включали в себя более низкий уровень НbА1с и SDS роста у детей с манифестацией СД1 в дошкольном возрасте.
Возрастные особенности уровня НbА1с уже хорошо описаны: наиболее высокие показатели отмечаются в подростковом возрасте, что связано с биологическими и психосоциальными изменениями на фоне полового созревания [12][13].
При первом рассмотрении частота осложнений существенно не различалась между группами, более того, за исключением SDS роста, отмечалась тенденция к большему риску осложнений у детей с манифестацией СД1 в более старшем возрасте. Однако такой анализ, очевидно, не учитывал влияния возраста участников на момент исследования на развитие осложнений. Дети из группы с манифестацией СД1 в возрасте более 7 лет были старше, как следствие, среди них чаще встречались дети подросткового возраста. Хорошо известно, что подростковый возраст является самостоятельным фактором риска формирования сосудистых осложнений СД1. С одной стороны, это происходит из-за ухудшения гликемического контроля вследствие сочетания таких факторов, как физиологическая инсулинорезистентность, влияние половых гормонов, рост мышечной массы тела, приводящий к увеличению потребности в инсулине, психосоциальные и поведенческие изменения, которые приводят к снижению приверженности к лечению в сочетании со снижением физической активности [15][16]. Помимо этого, само по себе половое созревание увеличивает риск развития диабетических осложнений, независимо от уровня гликемического контроля. Имеющиеся данные свидетельствуют о повышенном риске сосудистых осложнений у детей с манифестацией СД1 в пубертатном возрасте по сравнению с постпубертатной манифестацией. Этот повышенный риск объясняется влиянием инсулинорезистентности в период полового созревания, изменениями в уровне гормон роста (ГР)/инсулиноподобный фактор роста (ИФР-1), андрогенами и большей жировой массой, наблюдаемым в подростковом возрасте [17].
Таким образом, учитывая очевидное влияние возраста на риск формирования осложнений СД1, нами был проведен регрессионный анализ взаимосвязи осложнений и сопутствующих состояний с возрастом манифестации СД1 с поправкой на текущий возраст. По результатам проведенного анализа была установлена прямая зависимость между манифестацией СД1 в дошкольном возрасте и ретинопатией (β=4,95), МАУ (β=2,64) и задержкой роста (SDS роста менее 2) (β=1,22). В то же время снижение рСКФ менее 75 мл/мин 1,73 м² наоборот было связано с более старшим возрастом постановки диагноза. И напротив, ни одно из исследуемых сопутствующих состояний не было связано с возрастом манифестации СД1 или возрастом детей.
Очевидно, что длительность СД1 и подростковый возраст являются важнейшими факторами, определяющими формирование осложнений заболевания, в то же время роль возраста манифестации может быть неочевидной из-за заметно большей длительности СД1 у детей, заболевших в дошкольном возрасте, что «скрывает» собой влияние возраста при постановке диагноза.
Проблема длительных последствий раннего заболевания СД1 в последнее время привлекает больше внимания, благодаря данным полученным при анализе больших регистров. Эти данные указывают на значительное сокращение ожидаемой продолжительности жизни и кратный рост сердечно-сосудистой заболеваемости при более ранней диагностике СД1. Так, при манифестации заболевания в возрасте до 10 лет, по сравнению со здоровыми сверстниками, у пациентов с СД1 общая смертность выше в 4 раза, в т.ч. сердечно-сосудистая — в 7 раз, от инфарктов и инсультов — в 11 раз, от ишемической болезни сердца или инфаркта миокарда — в 30 раз, что в целом в 5 раз выше при диагностике СД1 в возрасте 26–30 лет [1]. Это указывает на наличие механизмов формирования и прогрессирования осложнений, связанных с возрастом манифестации.
Точные причины, определяющие дополнительный риск осложнений при манифестации СД1 в более раннем возрасте, не установлены и могут включать в себя общую гликемическую нагрузку, включая вариабельность гликемии и гипогликемию, различие в патогенетических и аутоиммунных механизмах СД1, возрастные особенности ведения детей с СД1 и др.
Вследствие неустойчивой повседневной деятельности (питание, двигательная активность, сон и пр.) дошкольный возраст характеризуется более выраженными колебаниями показателей глюкозы — вариабельностью гликемии, что проявляется более частыми эпизодами гипогликемии и повышенным риском тяжелой гипогликемии. При этом вариабельность гликемии и гипогликемии могут быть самостоятельными факторами риска осложнений, приводя к повышенным уровням окислительного стресса [18][19].
Более ранние рекомендации по терапии СД1 у детей включали в себя более высокие гликемические цели (HbA1c и показатели глюкозы) для детей в более младшем возрасте [20], что было обусловлено предполагаемым высоким риском тяжелой гипогликемии и ее последствий для маленьких детей при низких уровнях HbA1c. Однако за последние годы благодаря интенсивному внедрению технологий данная взаимосвязь становится неочевидной и более практически не прослеживается [21][22]. Установление единых, более низких целевых показателей HbA1c для всех детей с СД1 может способствовать снижению риска осложнений, что будет понятно спустя время, необходимое для оценки.
Задержка роста может быть результатом длительного дефицита инсулина или задержкой наступления пубертата в группе с манифестацией СД1 в дошкольном возрасте, что связано с общим гликемическим контролем. Нарушение роста может объясняться изменениями в оси ГР/ИФР-1 с более низкими уровнями ИФР-1 и повышенными уровнями ИФР-1 связывающего белка, наблюдаемыми из-за снижения концентрации инсулина в портальной вене [23]. Учитывая дизайн исследования, неизвестно, насколько эти изменения будут стойкими, и имеются данные, что даже при нарушении роста в подростковом возрасте во взрослом возрасте рост обычно нормальный [23].
Наиболее частыми из ассоциированных с СД1 аутоиммунных заболеваний являются аутоиммунные болезни щитовидной железы, в первую очередь АИТ. Распространенность антитиреоидных аутоантител у детей в дебюте СД1 составляет около 20% и увеличивается с возрастом [24]. Показано, что сочетание СД1 с аутоиммунными заболеваниями щитовидной железы ассоциировано с женским полом и более поздним возрастом манифестации СД1 [25]. В нашем исследовании у детей с манифестацией СД1 в дошкольном возрасте отмечалась тенденция к меньшей распространенности АИТ, однако статистической значимости данная тенденция не имела.
Целиакия, как клиническая, так и носительство аутоантител, у пациентов с СД1 наблюдается значимо чаще, чем в общей популяции. Предыдущие исследования не выявили явных различий в распространенности целиакии среди пациентов с СД1 в зависимости от возраста, пола и уровня HbA1c, отмечено лишь некоторое снижение распространенности целиакии у взрослых по сравнению с детьми [26]. Эти данные соотносятся и с результатами нашего исследования.
Полученные нами данные указывают на важное значение манифестации СД1 в дошкольном возрасте как независимого фактора риска сосудистых осложнений у детей и замедления линейного роста. Несмотря на то, что точные причины на сегодняшний день не вполне понятны, эти данные диктуют необходимость в более тщательном и строгом контроле СД1 у маленьких детей, начиная с самого начала заболевания. Учитывая ее значение, большая роль в контроле диабета у детей дошкольного возраста должна отводиться использованию современных технологий, включая непрерывный мониторинг глюкозы и помповую терапию [6][13][27–30]. Распространенность же сопутствующих аутоиммунных заболеваний значимо не различается у детей с разным возрастом манифестации СД1.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено в рамках исполнения государственного задания № 123021000040-9.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Лаптев Д.Н. — концепция и дизайн исследования, набор материала, написание и редактирование текста, получение, анализ, статистическая обработка и интерпретация полученных данных; Еремина И.А. — концепция и дизайн исследования, набор материала, написание и редактирование текста, получение, анализ, статистическая обработка и интерпретация полученных данных; Гончарова Н.А., Федоринин А.А. — концепция и дизайн исследования, набор материала, написание текста, получение, анализ, статистическая обработка и интерпретация полученных данных. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Rawshani A, Sattar N, Franzén S, et al. Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: a nationwide, registerbased cohort study. Lancet. 2018;392(10146):477-486. doi: https://doi.org/10.1016/S0140-6736(18)31506-X
2. Sundberg F, deBeaufort C, Krogvold L, et al. ISPAD Clinical Practice Consensus Guidelines 2022: Managing diabetes in preschoolers. Pediatr Diabetes. 2022;23(8):1496-1511. doi: https://doi.org/10.1111/pedi.13427
3. Writing Group for the DCCT/EDIC Research Group, Orchard TJ, Nathan DM, et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality. JAMA. 2015;313(1):45-53. doi: https://doi.org/10.1001/jama.2014.16107
4. Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group. Risk Factors for Cardiovascular Disease in Type 1 Diabetes. Diabetes. 2016;65(5):1370-1379. doi: https://doi.org/10.2337/db15-1517
5. Writing Team for the DCCT/EDIC Research Group, Gubitosi- Klug RA, Sun W, et al. Effects of Prior Intensive Insulin Therapy and Risk Factors on Patient-Reported Visual Function Outcomes in the Diabetes Control and Complications Trial/ Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Cohort. JAMA Ophthalmol. 2016;134(2):137-145. doi: https://doi.org/10.1001/jamaophthalmol.2015.4606
6. Beck RW, Tamborlane WV, Bergenstal RM, et al. The T1D Exchange clinic registry. J Clin Endocrinol Metab. 2012;97(12):4383-4389. doi: https://doi.org/10.1210/jc.2012-1561
7. Gregory JW, Cameron FJ, Joshi K, et al. ISPAD Clinical Practice Consensus Guidelines 2022: Diabetes in adolescence. Pediatr Diabetes. 2022;23(7):857-871. doi: https://doi.org/10.1111/pedi.13408
8. Fröhlich-Reiterer E, Elbarbary NS, Simmons K, et al. ISPAD Clinical Practice Consensus Guidelines 2022: Other complications and associated conditions in children and adolescents with type 1 diabetes. Pediatr Diabetes. 2022;23(8):1451-1467. doi: https://doi.org/10.1111/pedi.13445
9. Schwartz GJ, Muñoz A, Schneider MF, et al. New equations to estimate GFR in children with CKD. J Am Soc Nephrol. 2009;20(3):629-637. doi: https://doi.org/10.1681/ASN.2008030287
10. Pottel H, Dubourg L, Goffin K, Delanaye P. Alternatives for the Bedside Schwartz Equation to Estimate Glomerular Filtration Rate in Children. Adv Chronic Kidney Dis. 2018;25(1):57-66. doi: https://doi.org/10.1053/j.ackd.2017.10.002
11. Virtanen P, Gommers R, Oliphant TE, et al. SciPy 1.0: fundamental algorithms for scientific computing in Python. Nat Methods. 2020;17(3):261-272. doi: https://doi.org/10.1038/s41592-019-0686-2
12. Cameron FJ, Garvey K, Hood KK, Acerini CL, Codner E. ISPAD Clinical Practice Consensus Guidelines 2018: Diabetes in adolescence. Pediatr Diabetes. 2018;19 Suppl 27:250-261. doi: https://doi.org/10.1111/pedi.12702
13. Foster NC, Beck RW, Miller KM, et al. State of Type 1 Diabetes Management and Outcomes from the T1D Exchange in 2016-2018. Diabetes Technol Ther. 2019;21(2):66-72. doi: https://doi.org/10.1089/dia.2018.0384
14. Inshaw JRJ, Cutler AJ, Crouch DJM, Wicker LS, Todd JA. Genetic Variants Predisposing Most Strongly to Type 1 Diabetes Diagnosed Under Age 7 Years Lie Near Candidate Genes That Function in the Immune System and in Pancreatic β-Cells. Diabetes Care. 2020;43(1):169-177. doi: https://doi.org/10.2337/dc19-0803
15. Rausch JR, Hood KK, Delamater A, et al. Changes in treatment adherence and glycemic control during the transition to adolescence in type 1 diabetes. Diabetes Care. 2012;35(6):1219-1224. doi: https://doi.org/10.2337/dc11-2163
16. Kelsey MM, Zeitler PS. Insulin Resistance of Puberty. Curr Diab Rep. 2016;16(7):64. doi: https://doi.org/10.1007/s11892-016-0751-5
17. Fröhlich-Reiterer EE, Rosenbauer J, Bechtold-Dalla Pozza S, et al. Predictors of increasing BMI during the course of diabetes in children and adolescents with type 1 diabetes: data from the German/ Austrian DPV multicentre survey. Arch Dis Child. 2014;99(8):738-743. doi: https://doi.org/10.1136/archdischild-2013-304237
18. Monnier L, Wojtusciszyn A, Molinari N, Colette C, Renard E, Owens D. Respective Contributions of Glycemic Variability and Mean Daily Glucose as Predictors of Hypoglycemia in Type 1 Diabetes: Are They Equivalent? Diabetes Care. 2020;43(4):821-827. doi: https://doi.org/10.2337/dc19-1549
19. Hirsch IB. Glycemic Variability and Diabetes Complications: Does It Matter? Of Course It Does!. Diabetes Care. 2015;38(8):1610-1614. doi: https://doi.org/10.2337/dc14-2898
20. Дедов И.И., Петеркова В.А., Кураева Т.Л. Российский консенсус по терапии сахарного диабета у детей и подростков // Сахарный диабет. — 2010. — Т. 13. — №5. — С. 1-8. doi: https://doi.org/10.14341/2072-0351-6048
21. Haynes A, Hermann JM, Miller KM, et al. Severe hypoglycemia rates are not associated with HbA1c: a cross-sectional analysis of 3 contemporary pediatric diabetes registry databases. Pediatr Diabetes. 2017;18(7):643-650. doi: https://doi.org/10.1111/pedi.12477
22. Birkebaek NH, Drivvoll AK, Aakeson K, et al. Incidence of severe hypoglycemia in children with type 1 diabetes in the Nordic countries in the period 2008-2012: association with hemoglobin A 1c and treatment modality. BMJ Open Diabetes Res Care. 2017;5(1):e000377. doi: https://doi.org/10.1136/bmjdrc-2016-000377
23. Mitchell DM. Growth in patients with type 1 diabetes. Curr Opin Endocrinol Diabetes Obes. 2017;24(1):67-72. doi: https://doi.org/10.1097/MED.0000000000000310 24. Kawasaki E. Anti-Islet Autoantibodies in Type 1 Diabetes. Int J Mol Sci. 2023;24(12):10012. doi: https://doi.org/10.3390/ijms241210012
24. Horie I, Kawasaki E, Ando T, et al. Clinical and genetic characteristics of autoimmune polyglandular syndrome type 3 variant in the Japanese population. J Clin Endocrinol Metab. 2012;97(6):E1043-E1050. doi: https://doi.org/10.1210/jc.2011-3109
25. Mohammedsaeed WM, Alghamdi ZJ. Autoimmune diseases and their prevalence in Saudi Arabian patients with type 1 diabetes mellitus. Saudi Med J. 2023;44(8):751-760. doi: https://doi.org/10.15537/smj.2023.44.8.20230240
26. Blackman SM, Raghinaru D, Adi S, et al. Insulin pump use in young children in the T1D Exchange clinic registry is associated with lower hemoglobin A1c levels than injection therapy. Pediatr Diabetes. 2014;15(8):564-572. doi: https://doi.org/10.1111/pedi.12121
27. Лаптев Д.Н., Безлепкина О.Б., Демина Е.С., и др. Результаты клинической апробации системы FreeStyle Libre у детей с сахарным диабетом 1 типа: улучшение гликемического контроля в сочетании со снижением риска тяжелой гипогликемии и диабетического кетоацидоза // Проблемы Эндокринологии. — 2022. — Т. 68. — №3. — С. 86-92. doi: https://doi.org/10.14341/probl12877
28. Лаптев Д.Н., Переверзева С.В., Емельянов А.О., Петеркова В.А. Мониторинг применения помповой инсулинотерапии у детей, подростков и молодых пациентов с сахарным диабетом 1 типа в Российской Федерации // Проблемы Эндокринологии. — 2018. — Т. 64. — №2. — С. 85-92. doi: https://doi.org/10.14341/probl8756
29. Лаптев Д.Н., Емельянов А.О., Медведева Е.Д., Переверзева С.В., Петеркова В.А. Длительный гликемический контроль и факторы, ассоциированные с ответом на помповую инсулинотерапию у детей // Сахарный диабет. — 2021. — Т. 24. — №2. — С.122-132. doi: https://doi.org/10.14341/DM12530
Об авторах
Д. Н. ЛаптевРоссия
Лаптев Дмитрий Никитич, д.м.н.
117292, Москва, ул. Дм. Ульянова, д. 11
Scopus Author ID: 24341083800
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
И. А. Еремина
Россия
Еремина Ирина Александровна, к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Н. А. Гончарова
Россия
Гончарова Наталья Андреевна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
А. А. Федоринин
Россия
Федоринин Артем Альбертович
Москва
Scopus Author ID: 57224524155
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Частота осложнений у детей в зависимости от возраста манифестации сахарного диабета 1 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(211KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Частота сопутствующих заболеваний и состояний у детей в зависимости от возраста манифестации сахарного диабета 1 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(224KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Лаптев Д.Н., Еремина И.А., Гончарова Н.А., Федоринин А.А. Частота и характеристика осложнений и сопутствующих заболеваний у детей с сахарным диабетом 1 типа, заболевших в дошкольном возрасте. Сахарный диабет. 2025;28(5):416-423. https://doi.org/10.14341/DM13136
For citation:
Laptev D.N., Eremina I.A., Goncharova N.A., Fedorinin A.A. Frequency and characteristics of complications and concomitant diseases in children with type 1 diabetes mellitus who fell ill in preschool age. Diabetes mellitus. 2025;28(5):416-423. (In Russ.) https://doi.org/10.14341/DM13136

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































