Перейти к:
Хроническая болезнь почек у пациентов с длительным течением сахарного диабета 1 типа
https://doi.org/10.14341/DM13108
Аннотация
ОБОСНОВАНИЕ. Пациенты с сахарным диабетом 1 типа (СД1) имеют более ранний возраст дебюта и длительное течение заболевания, уже к среднему возрасту у них наблюдается развитие микрои макрососудистых диабетических осложнений, снижающих качество и продолжительность жизни.
ЦЕЛЬ. Изучить распространенность хронической болезни почек (ХБП) и других поздних осложнений СД в зависимости от почечной дисфункции в популяции пациентов с СД1 (длительность заболевания 20 и более лет), проходивших обследование и лечение в ФГБУ «НМИЦ эндокринологии» Минздрава России.
МАТЕРИАЛЫ И МЕТОДЫ. На основании базы данных ФГБУ «НМИЦ эндокринологии» Минздрава России было проведено одномоментное одноцентровое эпидемиологическое нерандомизированное исследование с изучением историй болезни 500 пациентов с СД1 длительного течения (20 и более лет) без поражения почек и с ХБП на разных стадиях (ХБП С1–С5, С5Д, С5Т), проходивших обследование и лечение с 2011 по 2023 гг.
РЕЗУЛЬТАТЫ. Сохранная функция почек, согласно критериям постановки диагноза ХБП, наблюдалась у 10,8% пациентов (n=54). Терминальной стадии ХБП достигли 28,0% (n=140), из которых 12,4% находились на заместительной почечной терапии программным гемодиализом, а 12,0% были после изолированной трансплантации почки или сочетанной трансплантации почки и поджелудочной железы, остальные находились на различных стадиях ХБП. Нормоальбуминурия отмечалась у 15,4% (n=77) пациентов из 500. Распространенность поздних осложнений СД среди обследованных пациентов была высокой и нарастающей по мере прогрессирования почечной дисфункции: диабетическая ретинопатия диагностирована у 96%, дистальная диабетическая полинейропатия — у 97% пациентов, различные формы автономной нейропатии — более чем у половины пациентов. Около 60% пациентов имели диагностированный атеросклероз артерий нижних конечностей, около трети — атеросклероз брахиоцефальных артерий, 23% — подтвержденную ишемическую болезнь сердца, 19% — перенесенные сердечно-сосудистые события (инфаркт миокарда, острое нарушение мозгового кровообращения), около половины из которых имели ХБП различной степени выраженности. Факторы повышения риска развития сердечно-сосудистых заболеваний: расчетная скорость клубочковой фильтрации (рСКФ)<60 мл/мин/1,73 м2 (отношение шансов (ОШ)=7,1; 95% доверительный интервал (ДИ) 3,6–8,4; p<0,001), рСКФ<30 мл/мин/1,73 м2 (ОШ=8,7; 95% ДИ 2,8–8,4; p<0,001), рСКФ<15 мл/мин/1,73 м2 (ОШ=14; 95% ДИ 6,3–31,3; p<0,001); альбуминурия более 30 мг/г (ОШ=2,4; 95% ДИ 1,6–3,6; p<0,001), диализ (ОШ=14,1; 95% ДИ 6,2–32,1; p<0,001), трансплантация почки (ОШ=11,7; 95% ДИ 5,4–24,9; p<0,001). Манифестация СД1 в 1996–2002 гг. снижала риск развития ХБП в 10,75 раза (95% ДИ 4,37–27,03) vs манифестация СД1 ранее. Возраст дебюта СД1 в 6–17 лет повышал риск достижения терминальной ХБП (тХБП) vs возраст дебюта >18 лет (ОШ=2,4; 95% ДИ 1,22–5,022; р=0,012).
ЗАКЛЮЧЕНИЕ. Несмотря на значительное снижение риска развития ХБП у лиц с дебютом СД1 в 1996–2002 гг., почечная дисфункция является частым осложнением у пациентов с длительным течением заболевания, сочетающимся с другими поздними осложнениями и способствующим высокому риску тХБП и сердечно-сосудистых событий. Ранний возраст дебюта СД1 повышает риск тХБП.
Ключевые слова
Для цитирования:
Евлоева М.И., Арутюнова М.С., Северина А.С., Трубицына Н.П., Зайцева Н.В., Шамхалова М.Ш., Шестакова М.В. Хроническая болезнь почек у пациентов с длительным течением сахарного диабета 1 типа. Сахарный диабет. 2023;26(6):504-514. https://doi.org/10.14341/DM13108
For citation:
Yevloyeva M.I., Arutyunova M.S., Severina A.S., Trubitsyna N.P., Zaitseva N.V., Shamhalova M.S., Shestakova M.V. Chronic kidney disease in patients with long-term type 1 diabetes mellitus. Diabetes mellitus. 2023;26(6):504-514. (In Russ.) https://doi.org/10.14341/DM13108
ВВЕДЕНИЕ
Сахарный диабет (СД) — общепризнанная неинфекционная эпидемия XX и XXI вв., значение которой давно распространилось за пределы интересов медицинской науки, затрагивая социальные и экономические аспекты жизни современной цивилизации. Безусловно, столь высокая распространенность и интенсивный ежегодный прирост пациентов с СД обеспечиваются за счет популяции пациентов с СД 2 типа (СД2), но, несмотря на это, пациенты с СД 1 типа (СД1) заслуживают не меньшего внимания. В силу раннего дебюта к достижению самого активного социоэкономического возраста (30–40 лет) пациенты с СД1 уже имеют длительный опыт заболевания с поздними микро- и макрососудистыми диабетическими осложнениями, зачастую инвалидизирующими и ограничивающими сферу деятельности пациентов и необратимо снижающими качество и продолжительность жизни [1].
В мире на 2022 г. численность пациентов с СД1 составляет 8,75 млн [2]. По прогнозам мировых экспертов, число больных СД1 в перспективе на ближайшие 20 лет будет только увеличиваться: их ожидаемая численность к 2040 г. составит от 13,5 до 17,4 млн [1].
Хроническая болезнь почек (ХБП) является частым осложнением СД1 — до 30–40% среди популяции пациентов. Почечная патология развивается преимущественно через 10 лет и более после дебюта заболевания. Максимальная частота ХБП у пациентов с дебютом СД1 в возрасте 11–20 лет связана с патологическим воздействием на почки возрастной гормональной перестройки растущего организма [3]. Риск развития ХБП у детей и подростков в позднем возрасте значимо возрастает и в случае перенесенного эпизода острого повреждения почек (ОПП) при диабетическом кетоацидозе (ДКА) [4].
По данным Федерального регистра сахарного диабета (ФРСД), на 01.01.2023 г. с учетом всех стадий ХБП во всех возрастных группах частота патологии у лиц с СД1 составила 22,8%. Оценка распространенности ХБП в динамике за период 2010–2022 гг. у взрослых пациентов с СД1 показала увеличение показателя с 21,5 до 27,1% (в 1,3 раза) при стабилизации и/или снижении частоты большинства других диабетических осложнений. Увеличение распространенности ХБП связано с улучшением диагностики осложнения на ранних стадиях, снижением риска сердечно-сосудистых событий и терминальной ХБП (тХБП) [5].
Пациенты с СД1 и почечной патологией подвержены высокому риску развития тХБП и сердечно-сосудистых заболеваний (ССЗ). В когортном исследовании DCCT/EDIC, охватывающем наблюдение более 30 лет, среди пациентов с СД1 (n=1441) по крайней мере одно сердечно-сосудистое событие произошло у 184 участников, а у 98 участников развилось значимое снижение расчетной скорости клубочковой фильтрации (рСКФ). По сравнению с нормоальбуминурией, устойчивая микроальбуминурия, преходящая микроальбуминурия и макроальбуминурия были связаны с более высоким риском сердечно-сосудистых событий (отношение рисков (ОР) (95% ДИ): 1,79 (1,13–2,85), 2,62 (1,68–2,85) и 2,65 (1,68–4,19) соответственно) и снижением рСКФ (ОР (95% ДИ): 5,26 (2,43–11,4), 4,36 (1,80–10,6) и 54,35 (30,79–95,9) соответственно) [6].
В популяционном ретроспективном когортном исследовании стратифицированной случайной выборки (n=1500) всех лиц с диагнозом СД1 в возрасте до 15 лет в 1970–1999 гг. (база данных Финского института здравоохранения и социального обеспечения) показано развитие почечной недостаточности (лечение диализом или трансплантация почки) у 36% пациентов через 15 лет после дебюта значимой альбуминурии. Важно отметить, что кумулятивная заболеваемость выраженной альбуминурией в когорте 1980–1989 гг. снизилась примерно вдвое по сравнению с когортой 1970–1979 гг. (ОР 0,55 (95% ДИ 0,42–0,72), p<0,0001), тогда как между когортами 1980–1989 гг. и 1990–1999 гг. дальнейшего снижения не наблюдалось (ОР 0,83 (0,54–1,26), p=0,38) [7]. Улучшение, наблюдаемое в когорте 1980-х годов, совпало с появлением блокаторов ренин-ангиотензин-альдостероновой системы (РААС), но заметное отсутствие дальнейших положительных изменений после 1980-х годов подчеркивает острую необходимость в новых органозащитных препаратах для лиц с СД1. Именно ССЗ, по данным ФРСД, являются основными причинами смерти пациентов с СД1 (38,6%), тогда как тХБП занимает значительно меньшую долю в структуре смертности (5,6%) [5].
Популяция пациентов с СД1 и ХБП достаточно гомогенна в отличие от пациентов с СД2, у которых специфическое поражение почек накладывается на исходно имеющиеся почечные заболевания и/или структурные и функциональные возрастные изменения почек, нередко отсутствие умеренно чувствительного маркера — диабетической ретинопатии (ДР) и, что особенно важно, патологической альбуминурии при снижении рСКФ (нормоальбуминурический вариант ХБП). Поэтому изучение распространенности, факторов риска и эволюции осложнения наиболее эффективно именно у пациентов с СД1 при длительном анамнезе заболевания.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить распространенность ХБП и других поздних осложнений СД в зависимости от почечной дисфункции в популяции пациентов с СД1 и длительностью заболевания 20 и более лет, проходивших обследование и лечение в ФГБУ «НМИЦ эндокринологии» Минздрава России.
МАТЕРИАЛЫ И МЕТОДЫ
Было проведено одномоментное одноцентровое эпидемиологическое нерандомизированное исследование с изучением историй болезни 500 пациентов с длительным течением СД1 (20 и более лет) без поражения почек и с ХБП на разных стадиях (ХБП С1–С5, С5Д, С5Т), проходивших обследование и лечение в ФГБУ «НМИЦ эндокринологии» Минздрава России с 2011 по 2023 гг. В рамках работы была проведена оценка распространенности ХБП и других поздних осложнений СД (ДР, диабетическая дистальная полинейропатия, диабетическая автономная нейропатия, диабетическая нейроостеоартропатия, диабетические макроангиопатии) в зависимости от почечной дисфункции, проведен анализ анамнестических данных, рутинных клинико-лабораторных и инструментальных исследований.
Оценка контроля углеводного обмена проводилась исходя из определения уровня гликированного гемоглобина (HbA1c) методом жидкостной ионообменной хроматографии под низким давлением на анализаторе Diastat (BioRad, США) с использованием набора того же производителя по унифицированной методике с учетом индивидуальных целевых значений. Функциональное состояние почек оценивалось путем определения рСКФ по уровню креатинина сыворотки крови и альбуминурии. Расчет СКФ проводился по формуле CKD-EPI:
СКФ (мл/мин/1,73 м²)=141 х [min креатинин плазмы (мг/дл)/ k или 1]α х [max креатинин плазмы (мг/дл)/k или 1]-1,209 х 0,993возраст (лет) х 1,018 (для женщин) х 1,159 (для представителей негроидной расы),
где k — 0,7 для женщин и 0,9 для мужчин, α — (-0,329) для женщин и (-0,411) для мужчин, креатинин (мкмоль/л) = креатинин (мг/дл) х 88,4.
Альбуминурия оценивалась в утренней порции мочи на автоматическом анализаторе Architect plus C 4000 по методике производителя (норма менее 20 мг/л) иммунотурбидиметрическим методом при использовании стандартного набора. Основные биохимические показатели оценивались при помощи автоматического биохимического анализатора Architect plus C 4000 (Abbott Diagnostics, США) по стандартным методикам с использованием реагентов производителя.
Эхокардиографическое исследование осуществлялось на аппарате iE 33 Xmatrix (Agilent Technologist, США). С целью оценки распространенности атеросклеротического поражения периферических артерий всем пациентам было проведено ультразвуковое дуплексное сканирование брахиоцефальных артерий (БЦА), артерий нижних конечностей (АНК) на аппарате Voluson expert E8 (General Electric Medical Systems). Ключевым критерием для диагностики гемодинамически значимого стеноза являлось сужение просвета артерии более чем на 50%.
Офтальмологическое исследование проводилось всем пациентам на базе «Лечебно-диагностического отделения диабетической ретинопатии и офтальмохирургии» ФГБУ «НМИЦ эндокринологии». Диагноз ДР верифицировался согласно действующей классификации стадий ДР.
Статистический анализ
Статистический анализ проведен в программном пакете Statistica v.13 (StatSoft, США). Для определения соответствия распределения количественных данных нормальному закону использовался критерий Колмогорова–Смирнова. Описательная статистика количественных показателей представлена медианами, первым и третьим квартилями в виде Me [Q1; Q3], качественных — в виде абсолютных и относительных частот. В качестве количественной меры эффекта при сравнении относительных показателей использовали показатель отношения шансов (ОШ (Exp B)) с 95% ДИ с использованием модели Кокса. Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с помощью метода логистической регрессии. Критический уровень статистической значимости при проверке статистических гипотез принят равным 0,05.
Этическая экспертиза
Протокол исследования №18 от 12 октября 2022 г. был рассмотрен локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава РФ, принято положительное решение. Поскольку исследование являлось ретроспективным, проводился анализ данных медицинской документации пациентов, проходивших обследование и лечение в ФГБУ «НМИЦ эндокринологии», подписание пациентами информированного согласия не требовалось.
РЕЗУЛЬТАТЫ
В исследование были включены 500 пациентов с СД1 (длительность 20 и более лет), из них 181 мужчина (36,2%) и 319 женщин (63,8%). В табл.1 и рис.1 представлена общая характеристика пациентов, включенных в исследование.
Таблица 1. Общая характеристика обследованных пациентов
|
Параметры |
Значение |
|
М/Ж, n (%) |
181 (36,2) / 319 (63,8) |
|
Возраст, годы, Me [ Q1; Q3] |
42,0 [ 35; 53] |
|
ИМТ, кг/м², Me [ Q1; Q3] |
22,0 [ 20,2; 24,9] |
|
Возраст дебюта СД1, годы, Me [ Q1; Q3] |
13 [ 8; 20] |
|
Длительность СД1, годы, Me [ Q1; Q3] |
28 [ 23; 33] |
|
Начало ХБП после дебюта СД1, годы, Me [ Q1; Q3] |
12 [ 8; 17] |
|
Длительность ХБП, Me [ Q1; Q3] |
16 [ 10; 18] |
|
Диабетическая ретинопатия, n (%) |
479 (95,8) |
|
Диабетическая нейропатия, n (%): дистальная автономная |
485 (97,0) 449 (89,8) |
|
ИБС, n (%) |
115 (23,0) |
|
ОИМ, n (%) ОНМК, n (%) |
63 (12,6) 33 (6,8) |
|
Атеросклероз периферических артерий, n (%) |
472 (94,4) |
|
АГ, n (%) |
411 (82,2) |
|
Длительность АГ, годы, Me [ Q1; Q3] |
10 [ 3; 15] |
|
Ингибиторы РААС, n (%) |
342 (68,4) |
|
Статины, n (%) |
415 (83,0) |
|
Антиагреганты, n (%) |
281 (56,2) |
Примечание. ИБС — ишемическая болезнь сердца,
ОИМ — острый инфаркт миокарда,
ОНМК — острое нарушение мозгового кровообращения,
АГ — артериальная гипертензия,
РААС — ренин-ангиотензин-альдостероновая система.
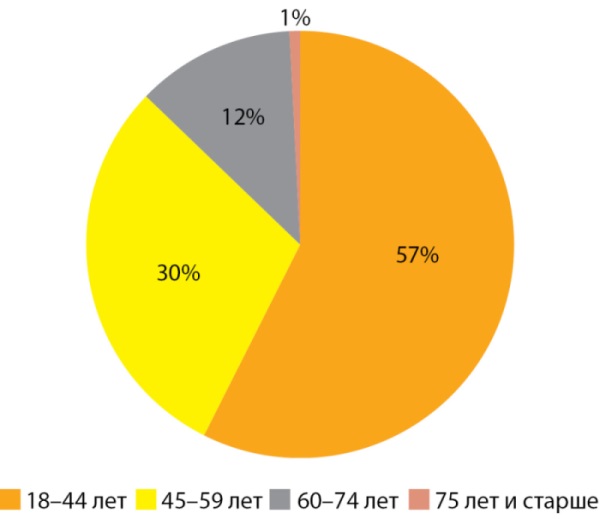
Рисунок 1. Возрастная характеристика исследуемой выборки.
При анализе возраста манифестации СД1 нами были получены следующие данные: у 16,4% пациентов дебют заболевания пришелся на детский дошкольный возраст (до 7 лет), у 54,2% — период с 7 до 18 лет, в возрасте старше 18 лет СД1 манифестировал у 29,4% пациентов.
У 12,9% (n=64) пациентов СД1 манифестировал с ДКА, еще у 49 пациентов (9,8%) известно хотя бы об одном эпизоде ОПП в анамнезе.
Число пациентов, чей уровень HbA1с соответствовал индивидуальным целевым значениям, составил всего 20%; у 80% пациентов данный показатель составлял более 8,0%, а медиана HbA1с — 8,4% [ 7,5; 9,4]. Обучение в «Школе самоконтроля для больных СД1» прошли 47,8% исследуемых (n=239).
На рис. 2 представлено распределение пациентов с СД1 в соответствии с рСКФ и альбуминурией.

Рисунок 2. Распределение пациентов
с длительным (более 20 лет) сахарным диабетом 1 типа
в соответствии с расчетной скоростью клубочковой фильтрации и альбуминурией.
Примечание. ХБП — хроническая болезнь почек;
А — степень альбуминурии.
Нормоальбуминурия и рСКФ более 60 мл/мин/1,73 м² наблюдались у 10,8 % пациентов (n=54). 28,0% (n=140) достигли тХБП, из которых 62 пациента находились на заместительной почечной терапии программным гемодиализом, а 60 — после изолированной трансплантации почки или сочетанной трансплантации почки и поджелудочной железы. Нормоальбуминурия отмечалась у 15,4% (n=77) среди 500 пациентов, у 84,6% соответственно верифицировалась повышенная экскреция альбумина с мочой, при этом у 41,8% (n=209) экскреция альбумина находилась в пределах 30–300 мг/г (А2), у 30,4% (n=152) — более 300 мг/г (А3).
Из осложнений ХБП нефрогенная анемия встречалась у 14,8% (n=74) пациентов с ХБП С3–С5, среди которых противоанемическую терапию препаратами железа и средствами, стимулирующими эритропоэз, получали 66,2% (n=49). Минерально-костные нарушения при ХБП выявлены у 32% (n=160), где у 20% (n=32) зафиксировано повышение уровня фосфора крови.
Оценка частоты развития поздних осложнений СД продемонстрировала высокую распространенность диабетической дистальной нейропатии, которая выявлялась у 97% пациентов, 15,2% (n=76) пациентов имели диабетическую нейроостеоартропатию. На рис. 3 отображена распространенность различных форм диабетической автономной нейропатии, которая нарастала по мере прогрессирования почечной дисфункции.

Рисунок 3. Распространенность форм диабетической автономной нейропатии
у обследуемой группы пациентов.
У подавляющего большинства пациентов (95,8%, n=479), включенных в наше исследование, течение диабета осложнялось наличием ДР с разной степенью выраженности микрососудистых изменений глазного дна (рис. 4). Наиболее продвинутые стадии ДР определялись у лиц с ХБП С3 и выше (рис. 5).

Рисунок 4. Распространённость диабетической ретинопатии
среди обследуемых пациентов.

Рисунок 5. Распространенность различных стадий
диабетической ретинопатии у обследуемой группы пациентов
в зависимости от стадий хронической болезни почек.
Примечание. ХБП — хроническая болезнь почек,
ДР — диабетическая ретинопатия,
А — степень альбуминурии.
Результат оценки распространенности макрососудистых осложнений в исследуемой группе пациентов и их распределение с учетом стадии ХБП представлены на рис. 6 и 7. Больше половины пациентов имели диагностированный АНК, около трети — атеросклероз БЦА, 23,0% — подтвержденную ишемическую болезнь сердца (ИБС), и перенесенные сердечно-сосудистые события (острое нарушение мозгового кровообращения (ОНМК), инфаркт миокарда (ИМ)) — 19,4% пациентов, около половины из которых имели ХБП различной степени выраженности. Также следует отметить, что каждому 10-му пациенту (10,4%) проводилось оперативное вмешательство по поводу диабетической стопы, преимущественно в объеме ампутации или экзартикуляции пальцев.
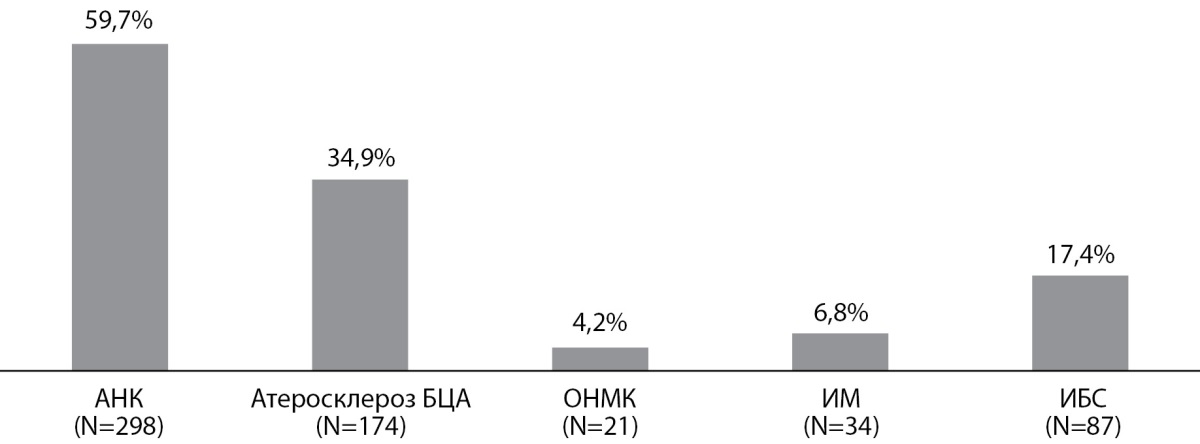
Рисунок 6. Распространенность макрососудистых осложнений
у обследуемой группы пациентов.
Примечание. АНК — атеросклероз артерий нижних конечностей,
БЦА — брахиоцефальные артерии,
ОНМК — острое нарушение мозгового кровообращения,
ИМ — инфаркт миокарда,
ИБС — ишемическая болезнь сердца.

Рисунок 7. Распределение пациентов с макрососудистыми осложнениями
(обследуемая группа) в зависимости от стадии хронической болезни почек.
Примечание. АНК — артерии нижних конечностей,
БЦА — брахиоцефальные артерии,
ОНМК — острое нарушение мозгового кровообращения,
ИМ — инфаркт миокарда,
ИБС — ишемическая болезнь сердца,
ХСН — хроническая сердечная недостаточность,
ХБП — хроническая болезнь почек.
Анализ состояния ССЗ выявил достаточно высокую распространенность артериальной гипертензии (АГ) — 82,3%. АГ III стадии регистрировалась у 57,8% по отношению к общему числу больных, АГ II стадии — у трети больных (30,5%) и АГ I стадии — всего у 9,0% пациентов от общего числа лиц, включенных в исследование. Медиана длительности АГ составила 10 лет [ 3; 15]. Ожидаемо была получена высокая распространенность гипертрофии миокарда левого желудочка — у 60,4%, при этом концентрическая гипертрофия регистрировалась у 28,2%, у 15,2% — эксцентрическая гипертрофия, и у 17,0% — концентрическое ремоделирование. На рис. 8 изображено распределение пациентов с АГ в соответствии с почечной дисфункцией. Хроническую сердечную недостаточность (ХСН) имели 16,5% пациентов, а нарушения сердечного ритма диагностировались у 3,0% среди лиц, включенных в исследование.
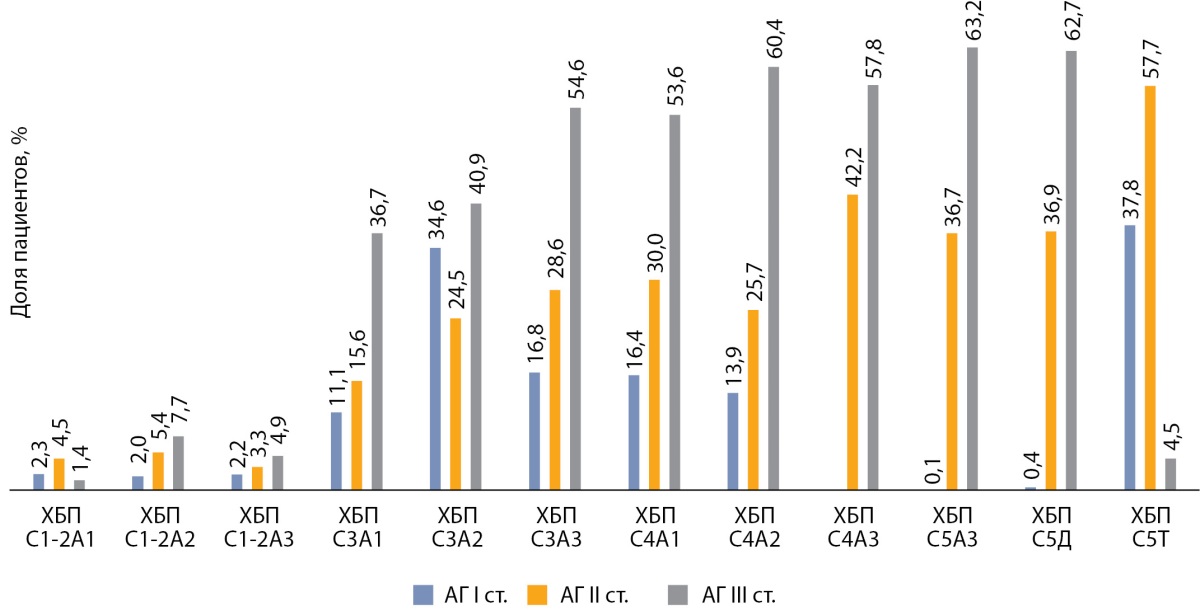
Рисунок 8. Распределение пациентов
с артериальной гипертензией (обследуемая группа)
в зависимости от стадий хронической болезни почек.
Примечание. АГ — артериальная гипертензия,
ХБП — хроническая болезнь почек
Манифестация СД1 в 1996–2002 гг. снижала риск развития ХБП в 10,75 раза (95% ДИ 4,37–27,03) vs манифестация СД ранее. Возраст дебюта СД1 6–17 лет повышал риск достижения тХБП и трансплантации vs возраст дебюта >18 лет: ОШ=2,4 (95% ДИ 1,22–5,022; р=0,012). Наличие выраженной АГ повышало риск прогрессирования до тХБП и трансплантации почки: ОШ=15,3 (95% ДИ 2,1–112,3; р=0,007).
Нами были определены факторы повышения риска развития ССЗ: рСКФ<60 мл/мин/1,73 м² (ОШ=7,1; 95% ДИ 3,6–8,4; p<0,001), рСКФ<30 мл/мин/1,73 м² (ОШ=8,7; 95% ДИ 2,8–8,4; p<0,001), рСКФ<15 мл/мин/1,73 м² (ОШ=14; 95% ДИ 6,3–31,3; p<0,001); альбуминурия более 30 мг/г (ОШ=2,4; 95% ДИ 1,6–3,6; p<0,001), диализ (ОШ=14,1; 95% ДИ 6,2–32,1; p<0,001), трансплантация почки (ОШ=11,7; 95% ДИ 5,4–24,9; p<0,001).
ОБСУЖДЕНИЕ
ХБП и особенно ее терминальная стадия по-прежнему являются бременем с точки зрения качества жизни, избыточной смертности, экономической нагрузки для общества. Всплеск оптимизма в конце XX в. по снижению риска ХБП у лиц с СД1 во многом был связан с применением блокаторов РААС, возможностями ранней диагностики, улучшением качества инсулинов, средств доставки инсулина, широким использованием средств самоконтроля, обучением. Действительно, по результатам нашего исследования манифестация СД1 в 1996–2002 гг. снижала риск развития ХБП в 10,75 раза (95% ДИ 4,37–27,03) по сравнению с манифестацией СД1 ранее. Тем не менее пожизненный риск заболевания почек при СД1 традиционно оценивается примерно в 50–70% [8]. Общеизвестен факт нарастания ХБП по мере увеличения длительности заболевания, зафиксированный в ФРСД [9]. По данным базы ФГБУ «НМИЦ эндокринологии» за период 2011–2023 гг., среди 500 пациентов (преимущественно стационарных) с длительным течением СД1 почти у 90% зарегистрирована та или иная степень почечной дисфункции. Столь высокий показатель может быть отнесен на счет смещения выборки (концентрация пациентов в специализированном учреждении 3 уровня), возможности диагностики осложнения на самых ранних (доклинических стадиях). При среднем периоде наблюдения 27 лет в когорте DCCT/EDIC было зарегистрировано в общей сложности 192 случая макроальбуминурии (частота 5 событий на 1000 человеко-лет) и 189 случаев снижения рСКФ (частота 4,9 события на 1000 человеко-лет) [10]. Исследование DCCT/EDIC продемонстрировало причинное и длительное влияние гипергликемии на риск альбуминурии и снижения рСКФ. По результатам нашего исследования количество пациентов, чей уровень HbA1с соответствовал индивидуальным целевым значениям, составило всего 20%, у 80% пациентов данный показатель составлял более 8,0% с медианой HbA1с 8,4 % [ 7,5; 9,4]. Таким образом, целевых показателей гликемического контроля в нашей группе достигла всего одна пятая доля пациентов. Оптимальное управление гликемией у пациентов с СД1 и ХБП может быть сложной задачей, особенно при поздних стадиях осложнения. С одной стороны, у пациентов рано развивается инсулинорезистентность (наиболее выраженная у скелетных мышц). Она носит многофакторный характер, во многом вторичный по отношению к нарушениям, характерным для заболеваний почек, включая низкую физическую активность, хроническое воспаление, окислительный стресс, дефицит витамина D, метаболический ацидоз, анемию, адипокиновые нарушения и изменение микробиома кишечника [11]. С другой стороны, у пациентов отмечен высокий риск гипогликемий, причинами которых являются снижение почечного глюконеогенеза, нарушения регуляции контррегуляторных гормонов, снижение клиренса инсулина, аккумуляция уротоксинов [12]. Кроме того, показатель HbA 1c при ХБП может быть искажен отклонениями в гемоглобине крови, применением терапии препаратами железа и препаратами, стимулирующими эритропоэз, а также хроническим воспалением, вызванным уремией, т.е. агентами, изменяющими эритропоэз и продолжительность жизни эритроцитов [13]. Внедрение непрерывного мониторинга глюкозы предлагает альтернативу более надежной и комплексной оценки гликемии у пациентов с ХБП. Ситуация еще больше осложняется «разъединяющим» эффектом контроля гликемии на клинические маркеры ХБП. Снижение гликемического воздействия с помощью терапии инсулиновой помпой, трансплантации островковых клеток или трансплантации поджелудочной железы влияло на улучшение (снижение) альбуминурии без улучшения рСКФ, даже несмотря на улучшение морфологических характеристик клубочков, наблюдаемых при биопсии почек [14].
Медиана возраста дебюта СД1 в обсуждаемой группе пациентов составила 13 лет, что соответствует каноническим представлениям о формирующемся риске ХБП при дебюте заболевания в пубертате. Подростки и молодые люди с хроническим заболеванием хуже соблюдают режим приема препаратов и общего ухода. Невысокая приверженность лечению связана с возрастающей независимостью в сочетании с неполной зрелостью мозга, что приводит к выбору действий краткосрочного, а не долгосрочного вознаграждения. Плохой гликемический контроль в дебюте и в последующем может привести к полиурии с результирующим сокращением объема и гиповолемией, которая связана с риском развитием преренального ОПП. В дебюте заболевания каждый пятый пациент даже без ДКА переживает ОПП, а при ДКА эти эпизоды отмечены у 2/3 пациентов [15]. Поэтому так важен «терапевтический компромисс» между слишком медленной заместительной инфузионной терапией (ОПП) и слишком быстрой регидратацией (отек мозга). Возраст дебюта СД1 и его проблемы обсуждаемой когорты, вероятно, отразились на достаточно раннем начале ХБП (через 12 лет), что соответствует и данным ФРСД (14,8 года) [9]. В попытке определить потенциальные риски развития ХБП в зависимости от возраста дебюта заболевания, по данным шведского детского регистра СД, было показано, что общая частота тХБП при СД1, диагностированном в возрасте 0–9 лет, была ниже, чем диагностированном в возрасте 10–19 лет [16]. В Норвегии общая частота тХБП среди детей с СД1, диагностированным в возрасте 0–5 лет и 5–9 лет, была ниже, чем в 10–14 лет [17]. По данным датского регистра СД, дети более старшего возраста с СД1, диагностированным в возрасте 6–17 лет (по сравнению с более маленькими детьми с диагностированным СД1 в возрасте 0–5 лет) и дети с большей продолжительностью СД1 (по сравнению с более короткой продолжительностью СД1) чаще имели ХБП как в целом, так и в рамках диабетической нефропатии [18]. В нашем исследовании возраст дебюта СД1 6–17 лет повышал риск достижения тХБП и трансплантации vs возраст дебюта >18 лет (ОШ=2,4; 95% ДИ 1,22–5,022; р=0,012).
Пациенты с длительным анамнезом СД1 по мере прогрессирования ХБП демонстрируют широкий спектр других осложнений диабета. Особенно примечательна «связь» с ДР, достигающей 100% выраженности на терминальных стадиях ХБП. Это высокочувствительный и специфичный маркер ХБП при СД1 в отличие от СД2.
Современный прогноз для пациентов с почечной патологией определяют ССЗ, для которых ХБП является независимым фактором риска. Патофизиология ССЗ при ХБП многогранна и уникальна, поскольку наряду с популяционными факторами риска активно включаются нетрадиционные факторы (анемия, гиперпаратиреоз, дефицит витамина D, гипоальбуминемия, гиперфосфатемия, снижение СКФ, альбуминурия и др.). Действуя совместно, они ускоряют развитие не только атеросклеротических, но и неатеросклеротических ССЗ (гипертрофия миокарда левого желудочка, аритмии, кальцификация артерий, кальцификация клапанов и другие) [19]. Значимость для лиц с СД1 и ХБП сердечной недостаточности, частота которой превосходит сердечно-сосудистую смерть, теперь не вызывает сомнений. В популяционном исследовании риска госпитализации из-за ХСН среди пациентов с СД1, включающем 13 781 пациентов, снижение рСКФ являлось предиктором последующих госпитализаций вследствие ХСН. У пациентов со значительно сниженной рСКФ (<30 мл/мин/1,73 м²) риск последующей госпитализации из-за ХСН был в 3 раза выше, чем для пациентов с нормальной почечной функцией (>90 мл/мин/1,73 м²). Обнаруженные тенденции определяют целесообразность проведения скрининга ранних признаков ХСН в определенных подгруппах пациентов с СД1 вне зависимости от их возраста [20]. Так, среди наших пациентов ХСН была диагностирована у 36% пациентов. Спектр и выраженность ССЗ в обследуемой популяции убедительно демонстрируют высокий кардиоваскулярный риск. В обсервационном продольном полнопопуляционном исследовании в Швеции и Норвегии скорректированная по возрасту заболеваемость ССЗ в целом была выше при СД1, чем при СД2, с несколько более высоким риском инсульта в более молодом возрасте и более высоким риском ИМ и сердечной недостаточности в старшем возрасте. При этом ХБП чаще встречалась при СД1, чем СД2, во всех возрастах [21]. В нашем исследовании высокая частота ССЗ у лиц с длительным СД1 согласуется с повышенным риском ХБП в этой группе. В когорте пациентов с СД1 исследования EDIC исходная рСКФ была более точным предиктором конечных точек ССЗ, чем HbA1c, и определяла прогноз смертности от любых причин [22]. В исследовании DCCT исходный уровень рСКФ также являлся прогностически значимым в отношении развития ИБС и микрососудистых осложнений, тогда как наличие компонентов метаболического синдрома не влияло на те же исходы диабета [23]. В нашем исследовании факторами повышения риска развития ССЗ оказались рСКФ<60 мл/мин/1,73 м² (ОШ=7,1; 95% ДИ 3,6–8,4; p<0,001), рСКФ<30 мл/мин/1,73 м² (ОШ=8,7; 95% ДИ 2,8–8,4; p<0,001), рСКФ<15 мл/мин/1,73 м² (ОШ=14; 95% ДИ 6,3–31,3; p<0,001); альбуминурия разовой мочи более 30 мг/л (ОШ=2,4; 95% ДИ 1,6–3,6; p<0,001), диализ (ОШ=14,1; 95% ДИ 6,2–32,1; p<0,001), трансплантация почки (ОШ=11,7; 95% ДИ 5,4–24,9; p<0,001).
Отдельного обсуждения заслуживают вопросы контроля промежуточных факторов риска ХБП — АГ и дислипидемии. По данным нашего исследования, АГ выявлена у 82% пациентов с длительным течением СД1. Контроль АД является краеугольным камнем в лечении ХБП. Патофизиология гипертонии при ХБП сложна, но в значительной степени связана со снижением массы нефронов, гиперактивацией симпатической нервной системы, вовлечением РААС и генерализованной эндотелиальной дисфункцией. Маскированная неконтролируемая гипертензия широко распространена у пациентов с ХБП, и для диагностики необходимы внеофисные измерения, такие как домашний или амбулаторный мониторинг АД. Лечение АГ при ХБП снижает риск сердечно-сосудистых заболеваний и замедляет прогрессирование заболевания почек. Существующие рекомендации приблизились к согласованным целевым показателям АД (<130/80 мм рт. ст.), хотя остаются вопросы, связанные с интенсивным снижением АД (полипрагмазия, риски нежелательных явлений, дополнительные затраты) [24][25].
Дислипидемический профиль при ХБП характеризуется более высоким атерогенным потенциалом липопротеинов низкой плотности даже при низких уровнях, преобладанием триглицеридемии, потерей полезных свойств липопротеинов высокой плотности. Липиды могут откладываться в почках, что приводит к «липоидной нефротоксичности». Высокие уровни холестерина липопротеинов низкой плотности и окисление этих частиц улавливаются мезангиальными клетками, что способствует их пролиферации и, наконец, гломерулярному склерозу. Свободные жирные кислоты продемонстрировали свою способность вызывать прямое повреждение подоцитов, особенно при наличии альбуминурии [26]. Но при этом эффекты гиполипидемической терапии при ХБП менее выражены. Возможное объяснение состоит в том, что у пациентов с ХБП другие механизмы, такие как кальцификация сосудов и воспаление, играют более важную роль, чем липопротеины, в развитии ССЗ.
Таким образом, более агрессивное вмешательство с применением препаратов для профилактики ССЗ следует рассматривать на более ранней стадии заболевания и, следовательно, в более молодом возрасте у пациентов с СД1, чем это делается в рамках рутинной помощи. Однако лимитирующим фактором успешной терапии ССЗ является прямое влияние жизненно важных методов лечения на почечную гемодинамику. В свете поиска новых нефро- и кардиопротективных стратегий для пациентов с СД1 закономерным является интерес к ингибиторам натрий-глюкозного котранспортера 2 типа, неселективному антагонисту минералокортикоидных рецепторов финеренону, которые продемонстрировали потрясающие результаты у пациентов с СД2. Требуются согласованные усилия научных, регулирующих, фармакологических, правозащитных организаций для разработки и проведения клинических испытаний для лиц, живущих с СД1 и ХБП, чтобы обратить вспять неприемлемо высокий риск сердечно-сосудистых осложнений и терминальной почечной недостаточности.
ЗАКЛЮЧЕНИЕ
Систематический анализ крупной когорты пациентов с СД1 на протяжении длительного времени свидетельствует о широкой распространенности ХБП и связанных с ней проблем управления гликемией, ограниченных возможностей контроля промежуточных факторов риска, профилактики эпизодов ОПП, низкой осведомленности о патологии, нарастающей частоты других поздних осложнений диабета, о трудности с соблюдением сложных схем терапии. Решение этих проблем, а также оптимизация нефро- и кардиопрогноза возможны в рамках реализации государственной политики повышения качества профилактики, диагностики и лечения пациентов с СД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование проведено в рамках выполнения Государственного задания Минздрава РФ № 123021000038-6.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Участие авторов. Евлоева М.И., Арутюнова М.С., Северина А.С., Трубицына Н.П., Зайцева Н.В., — анализ и интерпретация результатов исследования, написание текста статьи; Шамхалова М.Ш., Шестакова М.В. — финальный анализ результатов и редактирование текста рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Gregory GA, Robinson TIG, Linklater SE, et al. Global incidence, prevalence, and mortality of type 1 diabetes in 2021 with projection to 2040: a modelling study. Lancet Diabetes Endocrinol. 2022;10(10):741-760. doi: https://doi.org/10.1016/S2213-8587(22)00218-2
2. Heerspink HJ, Cherney DZ, Groop P-H, et al. People with type 1 diabetes and chronic kidney disease urgently need new therapies: a call for action. Lancet Diabetes Endocrinol. 2023;11(8):536-540. doi: https://doi.org/10.1016/S2213-8587(23)00168-7
3. de Boer IH, Khunti K, Sadusky T, et al. Diabetes management in chronic kidney disease: a consensus report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Kidney International. 2022;102(5):974-989. doi: https://doi.org/10.1016/j.kint.2022.08.012
4. Melena I, Piani F, Tommerdahl KL, et al. Aminoaciduria and metabolic dysregulation during diabetic ketoacidosis: Results from the diabetic kidney alarm (DKA) study. J Diabetes Complications. 2022;36(6):108203. doi: https://doi.org/10.1016/j.jdiacomp.2022.108203
5. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг // Сахарный диабет. —2023. — Т. 26. — №2. — С. 104-123. doi: https://doi.org/10.14341/DM13035
6. de Boer IH, Gao X, Cleary PA, et al. Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group. Albuminuria Changes and Cardiovascular and Renal Outcomes in Type 1 Diabetes: The DCCT/EDIC Study. Clin J Am Soc Nephrol. 2016;11(11):1969-1977. doi: https://doi.org/10.2215/CJN.02870316
7. Jansson Sigfrids F, Groop P-H, Harjutsalo V. Incidence rate patterns, cumulative incidence, and time trends for moderate and severe albuminuria in individuals diagnosed with type 1 diabetes aged 0–14 years: a population-based retrospective cohort study. Lancet Diabetes Endocrinol. 2022;10(7):489-498. doi: https://doi.org/10.1016/S2213-8587(22)00099-7
8. Costacou T, Orchard TJ. Cumulative kidney complication risk by 50 years of type 1 diabetes: the effects of sex, age, and calendar year at onset. Diabetes Care. 2018;41(3):426-433. doi: https://doi.org/10.2337/dc17-1118
9. Шамхалова М.Ш., Викулова О.К., Железнякова А.В., и др. Эпидемиология хронической болезни почек у пациентов с диабетом в Российской Федерации: данные Федерального регистра сахарного диабета, динамика 2010–2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №5. — С. 404-417.
10. Perkins BA, Bebu I, de Boer IH, et al. Diabetes Control and Complications Trial (DCCT)/Epidemiology of Diabetes Interventions and Complications (EDIC) research group. risk factors for kidney disease in type 1 diabetes. Diabetes Care. 2019;42(5):883-890. doi: https://doi.org/10.2337/dc18-2062
11. Spoto B, Pisano A, Zoccali C. Insulin resistance in chronic kidney disease: a systematic review. Am J Physiol Renal Physiol. 2016;311(6):F1087-F1108. doi: https://doi.org/10.1152/ajprenal.00340.2016
12. Rhee CM, Kovesdy CP, Kalantar-Zadeh K. Glucose homeostasis, hypoglycemia, and the burnt-out diabetes phenomenon in kidney disease. Semin Nephrol. 2021;41(2):96-103. doi: https://doi.org/10.1016/j.semnephrol.2021.03.004
13. Shurraw S. Association between glycemic control and adverse outcomes in people with diabetes mellitus and chronic kidney disease. Arch Intern Med. 2011;171(21):1920. doi: https://doi.org/10.1001/archinternmed.2011.537
14. Goel G, Perkins BA. Can improved glycemic control slow renal function decline at all stages of diabetic nephropathy? Semin Nephrol. 2012;32(5):423-431. doi: https://doi.org/10.1016/j.semnephrol.2012.07.004
15. Rivetti G, Hursh BE, Miraglia del Giudice E, Marzuillo P. Acute and chronic kidney complications in children with type 1 diabetes mellitus. Pediatr Nephrol. 2023;38(5):1449-1458. doi: https://doi.org/10.1007/s00467-022-05689-w
16. Toppe C, Mollsten A, Waernbaum I, et al. Decreasing cumulative incidence of end-stage renal disease in young patients with type 1 diabetes in Sweden: a 38-year prospective nationwide study. Diabetes Care. 2019;42(1):27-31. doi: https://doi.org/10.2337/dc18-1276
17. Gagnum V, Saeed M, Stene LC, et al. Low incidence of endstage renal disease in childhood-onset type 1 diabetes followed for up to 42 years. Diabetes Care. 2018;41(3):420-425. doi: https://doi.org/10.2337/dc17-0906
18. Sun J, Wang C, Zhao M, et al. Childhood diabetes mellitus and early-onset kidney diseases later in life: a nationwide population-based matched cohort study [Erratum in: BMC Med. 2023;21(1):200]. BMC Med. 2022;20(1):428. doi: https://doi.org/10.1186/s12916-022-02634-4
19. Sarnak M, Amann K, Bagalore S, et al. Chronic kidney disease and coronary artery disease. JACC State-of-the-Art Review. 2019;74(14):1823-1838. doi: https://doi.org/10.1016/J.JACC.2019.08.1017
20. Vestberg D, Rosengren A, Olsson M, et al. Decreased eGFR as a Risk Factor for Heart Failure in 13 781 Individuals With Type 1 Diabetes. J Diabetes Sci Technol. 2015;10(1):131-136. doi: https://doi.org/10.1177/1932296815596174
21. Kristófi R, Bodegard J, Norhammar A, et al. Cardiovascular and renal disease burden in type 1 compared with type 2 diabetes: A two-country nationwide observational study. Diabetes Care. 2021;44(5):1211-1218. doi: https://doi.org/10.2337/dc20-2839
22. Olson JC, Erbey JR, Williams KV, et al. Subclinical atherosclerosis and estimated glucose disposal 428 rate as predictors of mortality in type 1 diabetes. Ann Epidemiol. 2002;12(5):331-337. doi: https://doi.org/10.1016/s1047-2797(01)00269-1
23. Danielson KK, Drum ML, Estrada CL, Lipton RB. Racial and ethnic differences in an estimated measure of insulin resistance among individuals with type 1 diabetes. Diabetes Care. 2010;33(3):614-619. doi: https://doi.org/10.2337/dc09-1220
24. de Boer IH, Khunti K, Sadusky T, Tuttle KR et al. Diabetes management in chronic kidney disease: a consensus report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Kidney International 2022;102(5):974-989. doi: https://doi.org/10.1016/j.kint.2022.08.012
25. Cheung AK, Chang TI, Cushman WC, et al. Executive summary of the KDIGO 2021 clinical practice guideline for the management of blood pressure in chronic kidney disease. Kidney Int. 2021;99(3):559-569. doi: https://doi.org/10.1016/j.kint.2020.10.026
26. Theofilis P, Vordoni A, Koukoulaki M, et al. Dyslipidemia in chronic kidney disease: Contemporary concepts and future therapeutic perspectives. Am J Nephrol. 2021;52(9):693-701. doi: https://doi.org/10.1159/000518456
Об авторах
М. И. ЕвлоеваРоссия
Евлоева Мадина Иссаевна, аспирант
г. Москва, ул. Дмитрия Ульянова, д. 11, 117036
М. С. Арутюнова
Россия
Арутюнова Маргарита Станиславовна, аспирант
г. Москва
А. С. Северина
Россия
Северина Анастасия Сергеевна, к.м.н., в.н.с.
г. Москва
Н. П. Трубицына
Трубицына Наталья Петровна, к.м.н., в.н.с.
г. Москва
Н. В. Зайцева
Зайцева Наталья Владиславовна, к.м.н., в.н.с.
г. Москва
М. Ш. Шамхалова
Шамхалова Минара Шамхаловна, д.м.н
г. Москва
М. В. Шестакова
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
г. Москва
Дополнительные файлы
|
|
1. Рисунок 1. Возрастная характеристика исследуемой выборки. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(73KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Распределение пациентов с длительным (более 20 лет) сахарным диабетом 1 типа в соответствии с расчетной скоростью клубочковой фильтрации и альбуминурией. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(209KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Распространенность форм диабетической автономной нейропатии у обследуемой группы пациентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(91KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Распространённость диабетической ретинопатии среди обследуемых пациентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(65KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Распространенность различных стадий диабетической ретинопатии у обследуемой группы пациентов в зависимости от стадий хронической болезни почек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(357KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Распространенность макрососудистых осложнений у обследуемой группы пациентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(80KB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. Распределение пациентов с макрососудистыми осложнениями (обследуемая группа) в зависимости от стадии хронической болезни почек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(470KB)
|
Метаданные ▾ | |
|
|
8. Рисунок 8. Распределение пациентов с артериальной гипертензией (обследуемая группа) в зависимости от стадий хронической болезни почек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(231KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Евлоева М.И., Арутюнова М.С., Северина А.С., Трубицына Н.П., Зайцева Н.В., Шамхалова М.Ш., Шестакова М.В. Хроническая болезнь почек у пациентов с длительным течением сахарного диабета 1 типа. Сахарный диабет. 2023;26(6):504-514. https://doi.org/10.14341/DM13108
For citation:
Yevloyeva M.I., Arutyunova M.S., Severina A.S., Trubitsyna N.P., Zaitseva N.V., Shamhalova M.S., Shestakova M.V. Chronic kidney disease in patients with long-term type 1 diabetes mellitus. Diabetes mellitus. 2023;26(6):504-514. (In Russ.) https://doi.org/10.14341/DM13108
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































