Перейти к:
Влияние глибенкламида на функциональную активность КАТФ-каналов церебральных артерий у крыс со стрептозотоциновым сахарным диабетом
https://doi.org/10.14341/DM13103
Аннотация
АКТУАЛЬНОСТЬ. В терапии сахарного диабета (СД) для стойкого снижения уровня глюкозы в крови широко применялся глибенкламид — блокатор КАТФ-каналов. Однако его воздействие на мозговую циркуляцию исследовано очень мало. Понижение функциональной активности КАТФ-каналов вследствие их блокирования глибенкламидом на фоне развившейся эндотелиальной дисфункции может привести к нарушению мозговой циркуляции (особенно на микроциркуляторном уровне) и способствовать ремоделированию сосудистой сети.
ЦЕЛЬ. Оценить влияние глибенкламида на реактивность церебральных артерий у крыс со стрептозотоциновым сахарным диабетом (СТЗ-СД).
ЗАДАЧИ. 1. Изучить изменение функционального состояния КАТФ-каналов пиальных артерий при СТЗ-СД. 2. Оценить влияние глибенкламида на участие КАТФ-каналов в формировании базального тонуса и эндотелий-зависимой дилатации пиальных артерий.
МАТЕРИАЛЫ И МЕТОДЫ. Работа проведена на 54 крысах-самцах линии Sprague Dawley. СТЗ-СД был смоделирован посредством содержания животных на высокожировой диете и введении стрептозотоцина (35 мг/кг). С помощью установки для прижизненного изучения реактивности пиальных сосудов через 3 мес с начала эксперимента измеряли диаметр артерий при орошении поверхности мозга растворами Кребса-Хенселейта, ацетилхолина, глибенкламида, пинацидила и ацетилхолина на фоне действия глибенкламида или пинацидила.
РЕЗУЛЬТАТЫ. При моделировании СТЗ-СД крыс развились толерантность к глюкозе, инсулинорезистентность (ИР); относительно контрольных животных масса тела была больше в 1,3 раза, процентное содержание висцерального жира — в 3 раза, уровень глюкозы в крови — в 3,2 раза. Показали, что при СТЗ-СД число констрикций пиальных артерий под действием глибенкламида уменьшилось в 1,3–1,9 раза по сравнению с интактными крысами. Глибенкламид не блокировал эндотелий-зависимую дилатацию.
ЗАКЛЮЧЕНИЕ. У крыс со СТЗ-СД КАТФ-каналы принимают участие в формировании базального тонуса пиальных артерий, но вклад этих каналов снижен в среднем в 1,5 раза по сравнению со здоровыми крысами.
Применение глибенкламида при СТЗ-СД не влияет на эндотелий-зависимую дилатацию церебральных артерий.
Ключевые слова
Для цитирования:
Соколова И.Б., Лобов Г.И. Влияние глибенкламида на функциональную активность КАТФ-каналов церебральных артерий у крыс со стрептозотоциновым сахарным диабетом. Сахарный диабет. 2024;27(4):304-312. https://doi.org/10.14341/DM13103
For citation:
Sokolova I.B., Lobov G.I. The Effect of Glibenclamide on the Functional Activity of КATP Channels of Cerebral Arteries in Rats with Streptozotocin Diabetes Mellitus. Diabetes mellitus. 2024;27(4):304-312. (In Russ.) https://doi.org/10.14341/DM13103
Для стойкого снижения уровня глюкозы в крови больных сахарным диабетом 2 типа (СД2) широко применяют производные сульфомочевины, в том числе глибенкламид [1][2]. Механизм действия глибенкламида заключается в следующем. АТФ-чувствительные калиевые каналы (KATP-каналы) β-клеток поджелудочной железы — это гетерооктамеры, состоящие из четырех субъединиц Kir6.2 и четырех субъединиц SUR1. Посредством сульфомочевинной и бензамидной групп глибенкламид связывается с рецептором SUR1 и дезактивирует КАТФ-канал. Ингибирование КАТФ-каналов приводит к деполяризации клеточной мембраны, входу Ca2+ в β-клетки через открывшиеся кальциевые каналы и высвобождению Ca2+ из внутриклеточных депо в эндоплазматическом ретикулуме и митохондриях. Повышение концентрации Ca2+ в цитозоле β-клеток активирует выход инсулина в кровь. Однако глибенкламид является блокатором КАТФ-каналов в клетках всего организма, в том числе и в сердечно-сосудистой системе. При СД2 высок риск развития ишемических и лакунарных инсультов головного мозга и церебральной ангиопатии. Основной причиной ухудшения кровообращения при метаболическом синдроме (МС) и СД2 считается эндотелиальная дисфункция — дисбаланс в выработке вазодилататоров/вазоконстрикторов, активация процессов тромбообразования и воспаления [3]. Ранее показано, что при развитии МС и СД2 в стенках церебральных сосудов может откладываться β-амилоидный белок, вызывая повреждение эндотелиальных клеток и, как следствие, уменьшение выработки NO и снижение чувствительности артерий к ацетилхолину [4]. К эндотелиальной дисфункции также приводят инсулинорезистентность (ИР) и хроническая гипергликемия. Инсулин в высокой концентрации вызывает пролиферацию и миграцию гладкомышечных клеток, пролиферацию фибробластов, активацию системы свертывания крови, снижение активности фибринолиза [5]. При хронической гипергликемии глюкоза вступает во взаимодействие с белками и липидами крови с образованием продуктов гликирования [6]. Связывание конечных продуктов гликирования с базальной мембраной сосудистой стенки приводит к ее утолщению, снижению эластичности, развитию воспалительной реакции и повреждению эндотелиальных клеток [7][8]. Но патологические изменения реактивности церебральных сосудов могут происходить и из-за сбоя в работе ионных каналов эндотелиальных и гладкомышечных клеток (ГМК) [9][10]. Посредством КАТФ-каналов в значительной мере регулируется сосудистый тонус [11]. В литературе данных о влиянии СД2 на функционирование КАТФ-каналов мозговых артерий представлено мало, и эти данные очень противоречивы. Одни авторы утверждают, что КАТФ-каналы не участвуют в формировании сосудистого тонуса при СД2 [9], другие — что блокирование КАТФ-каналов негативно сказывается на постинсультном состоянии нейронов у больных СД2 [10]. Вопрос о влиянии глибенкламида на мозговую циркуляцию у больных СД2 в настоящее время остается открытым.
ЦЕЛЬ
Оценить влияние глибенкламида на реактивность церебральных артерий у крыс со стрептозотоциновым сахарным диабетом (СТЗ-СД).
В рамках представленного исследования были поставлены следующие экспериментальные задачи: 1. Изучить изменение функционального состояния КАТФ-каналов пиальных артерий при СТЗ-СД. 2. Оценить влияние глибенкламида на участие КАТФ-каналов в формировании базального тонуса и эндотелий-зависимой дилатации пиальных артерий.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена на животных из ЦКП «Биоколлекция ИФ РАН для исследования интегративных механизмов деятельности нервной и висцеральных систем» (Санкт-Петербург). Исследования проводили в соответствии с этическими стандартами, утвержденными правовыми актами РФ, принципами Базельской декларации и требованиями Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН (протокол №04/12 от 12.04.2022 г.). Крыс содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 в условиях искусственного освещения (цикл: 12 часов свет/12 часов темнота).
Дизайн
В экспериментальной работе были использованы линейные крысы — самцы Sprague Dawley, возраст которых в начале работы составлял 3 месяца, вес 400–420 г, 54 особи. Изначально были сформированы 2 пула животных: контрольные животные (содержались на стандартном комбикорме для лабораторных животных (Тосненский комбикормовый завод. Россия)) (Группа 1, 18 особей) и крысы, которые в течение двух месяцев получали высокожировую диету (ВЖД). ВЖД включала стандартный комбикорм (370 г/кг) и добавки в виде жира свиного (313 г/кг), казеина (253 г/кг), витаминно-минеральной смеси (61 г/кг): 58% жира, 25% белка, 17% углеводов [12][13]. Перед использованием все компоненты корма тщательно перемалывались, и из смеси формировались гранулы, подобные стандартному комбикорму. Через 2 месяца крысам, у которых моделировали СТЗ-СД (Группа 3, 18 особей), был введен внутрибрюшинно панкреотоксичный препарат стрептозотоцин в концентрации 35 мг/кг (Sigma-Aldrich, USA). Часть животных, находящихся на ВЖД, без введения стрептозотоцина являлась второй контрольной группой (Группа 2, 18 особей). Еще 1 месяц животные из групп 2 и 3 получали ВЖД. Графики изменения веса крыс из экспериментальных групп и уровня глюкозы в крови представлены на рис. 1.
Затем животные из всех экспериментальных групп были протестированы на толерантность к глюкозе с помощью глюкозо-толерантного теста (ГТТ) и на инсулинорезистентность с помощью инсулин-толерантного теста (ИТТ) (по 6 особей из каждой группы) [14] (рис. 2).
ГТТ проводили после 16-часового голодания при свободном доступе к воде. В начале эксперимента измеряли уровень глюкозы в крови из хвостовой вены с помощью глюкометра Акку-Чек Актив («Рош Диабетс Кеа ГМбХ», Германия). Затем внутрибрюшинно вводили углеводную нагрузку из расчета 2 г глюкозы на килограмм веса. Далее измерения уровня глюкозы в крови проводили через 30, 60 и 120 мин. ИТТ проводили после 4-часового голодания крыс. После фонового измерения уровня глюкозы в крови животным подкожно вводили инсулин (ООО «Завод Медсинтез», Россия) в дозе 0,75 Ед/кг. Уровень глюкозы в крови измеряли через 15, 30, 60 и 120 мин.
После эвтаназии у животных тщательно изымали висцеральный жир и определяли его вес. Висцеральная жировая ткань у грызунов включает в себя мезентериальную (располагается по ходу кишечника), забрюшинную (располагается за почками) и эпидидимальную (располагается вдоль семенников) жировую ткань [15].
Удельный вес висцерального жира в группах 1, 2 и 3 составлял 2,1±0,3%, 4,5±0,5% (*p≤0,05 относительно группы 1) и 6,1±0,3% (***p≤0,0001 относительно группы 1) соответственно.
Эксперименты проводились на наркотизированных (золетил (Virbac, Франция) (20 мг/кг) внутрибрюшинно) животных; для эвтаназии использовали повышенную дозу наркоза.
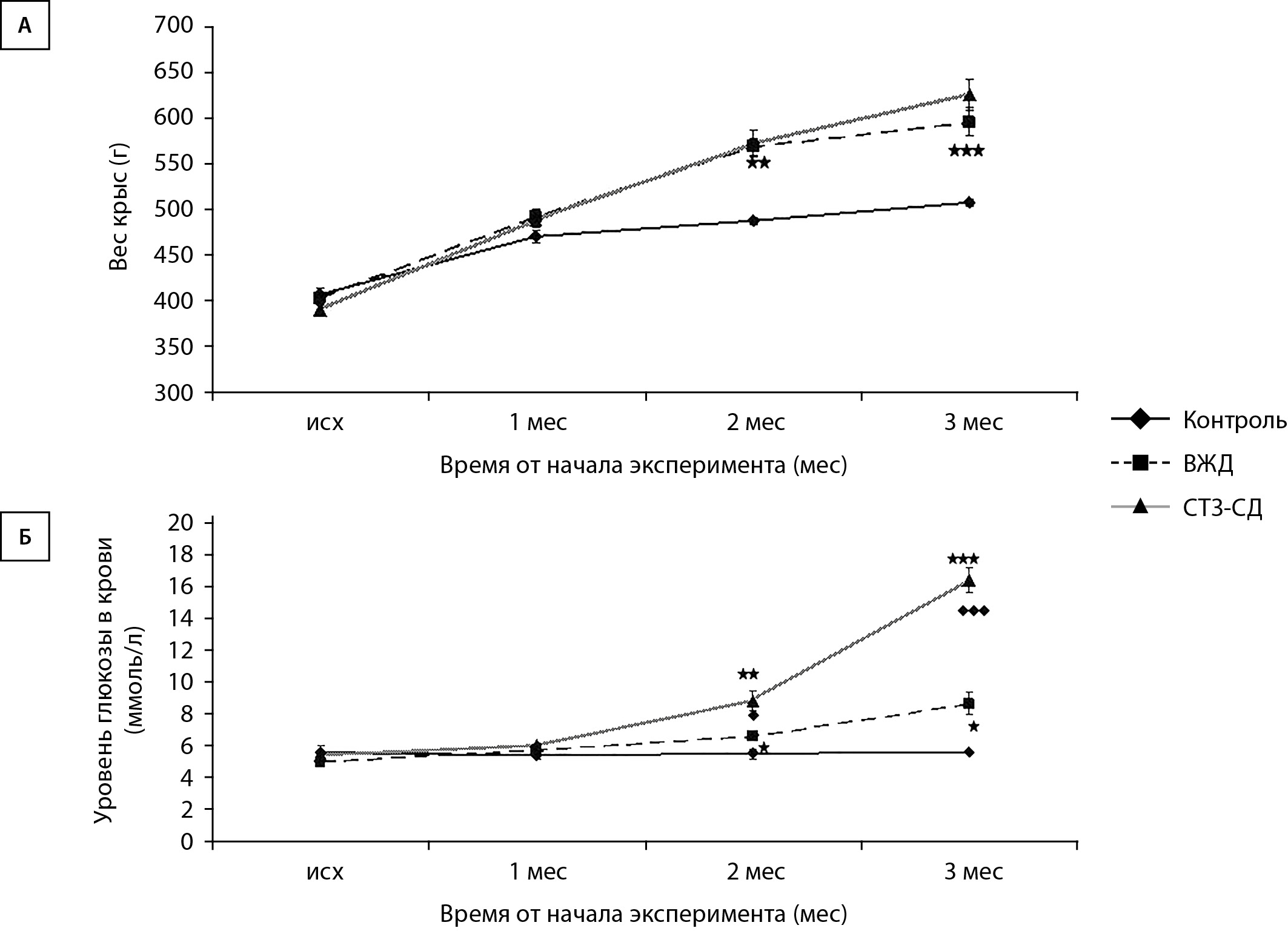
Рисунок 1. Динамика изменения веса экспериментальных крыс и уровня глюкозы в крови.
Примечание. ВЖД — высокожировая диета; СТЗ-СД — стрептозотоциновый сахарный диабет. По горизонтали — время от начала эксперимента (месяцы), по вертикали — а) вес крыс (г); б) уровень глюкозы в крови (ммоль/л). * — изменения значимы по сравнению с контрольными животными; ◊ — изменения значимы между группами ВЖД и СТЗ-СД. Данные представлены в виде среднего арифметического±ошибка среднего (*,◊р<0,05, **р<0,01, ***,◊◊◊р<0,001 непарный t-критерий).
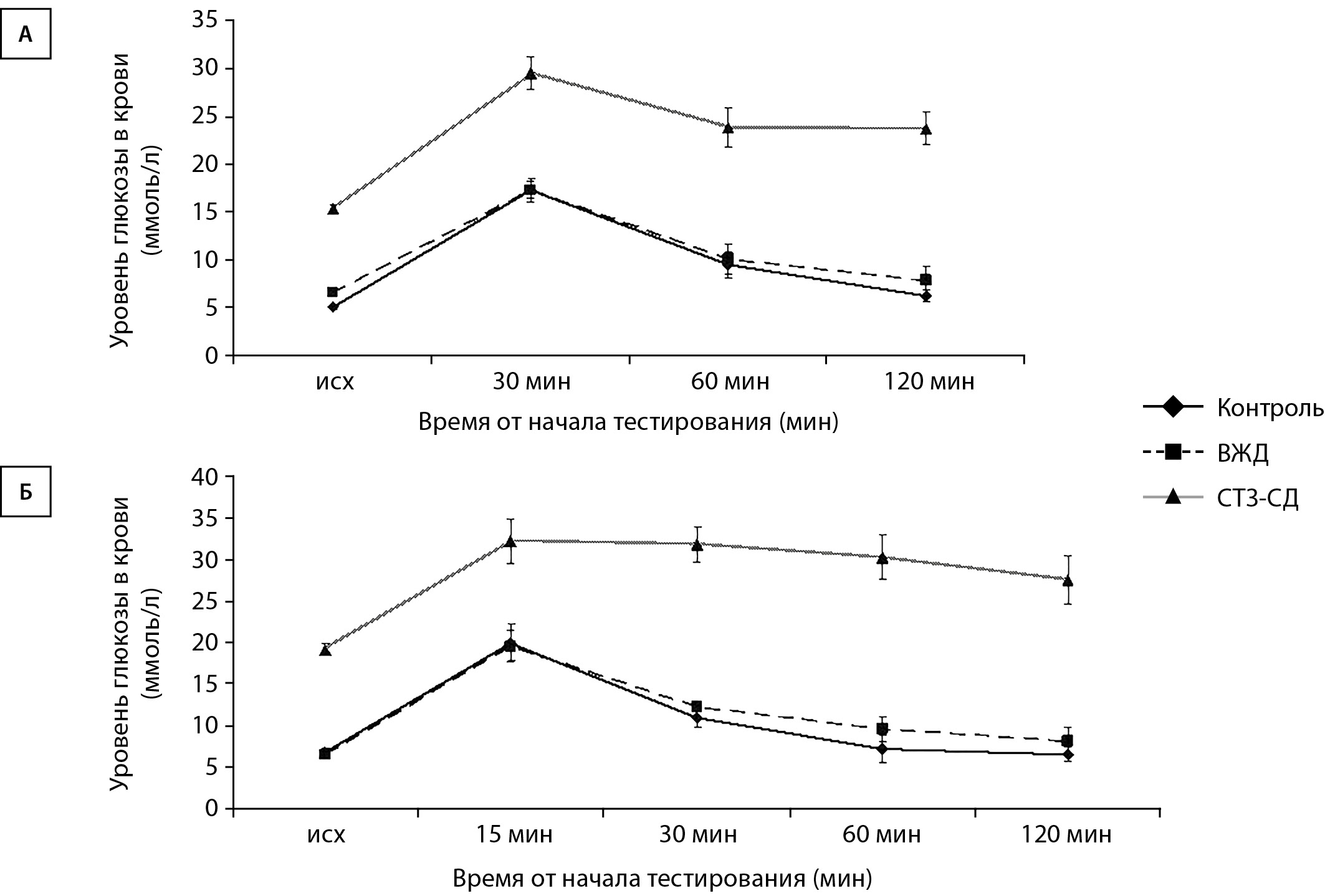
Рисунок 2. Графики тестирования экспериментальных крыс на толерантность к глюкозе с помощью глюкозо-толерантного теста (ГТТ) и на инсулинорезистентность с помощью инсулин-толерантного теста (ИТТ).
Примечание. ВЖД — высокожировая диета; СТЗ-СД — стрептозотоциновый сахарный диабет. По горизонтали — время от начала тестирования (мин), по вертикали — уровень глюкозы в крови (ммоль/л). Данные представлены в виде среднего арифметического±ошибка среднего.
Метод прижизненного микроскопирования
Для проведения прижизненного исследования реакций пиальных артерий в теменной области черепа животного на площади примерно 1 см2 удаляли кость и твердую мозговую оболочку. Во время эксперимента поверхность мозга непрерывно орошали раствором Кребса-Хенселейта (pH 7,4, температура 38 °C) и контролировали среднее АД [16]. Прямое измерение среднего АД производили через канюлю в бедренной артерии. Среднее АД составляло 125±2 мм рт.ст., 131±3 мм рт.ст. и 135±5 мм рт.ст у животных из 1, 2 и 3 групп соответственно. Температуру тела крысы поддерживали на уровне 38 оC. Экспериментальная установка состояла из стереоскопического микроскопа MC-2ZOOM («Микромед», Россия), цветной камеры — видеоокуляра для микроскопа DCM-510 (Scopetek, Китай) и персонального компьютера. Диаметры сосудов измеряли на статических изображениях, используя программу «Photo M», разработанную для цитофотометрии (автор А. Черниговский, http://www.t_lambda.chat.ru). У каждой крысы измерения проводились не менее чем на 50 артериях, которые были разбиты на группы: 60–80 мкм, 40–60 мкм, 20–40 мкм, менее 20 мкм. Исходным значением считали диаметр сосуда без воздействия (орошение раствором Кребса-Хенселейта: в мМ: NaCl 120,4; KCl 5,9; NaHCО3 15,5; MgCl2 1,2; CaCl2 2,5; NaH2PO4 1,2; глюкоза 11,5; pH 7,4), аэрированного карбогеном). В качестве вазореактивных препаратов использовали раствор ацетилхолина (AСh) (10-7М/л, 8 мин) (Sigma-Aldrich, USA) в растворе Кребса-Хенселейта. После 20-минутной отмывки поверхности мозга раствором Кребса-Хенселейта и повторной фиксации диаметров при этом воздействии на поверхность мозга наносили раствор блокатора КАТФ-каналов глибенкламида (Glybenclamide, Sigma-Aldrich, 10 мкМ, 10 мин) в диметилсульфоксиде (DMSO, Sigma–Aldrich, США) (GB) или раствор активатора КАТФ-каналов пинацидила (Pinacidil monohydrate, Sigma–Aldrich, 200 мкМ, в растворе DMSO, 5 мин) (PI). Концентрация растворителя DMSO составляла 0,1% и не влияла на реактивность исследуемых сосудов [16]. На последнем этапе эксперимента на поверхность мозга наносили раствор AСh в глибенкламиде или пинацидиле. В статистическую обработку были отобраны сосуды, у которых изменение диаметра превышало 5% от исходного [16].
Статистический анализ данных
Математический анализ данных проведен с помощью статистических программ Microsoft Excel 2003 и InStat 3.02 («GraphPad Software Inc.», США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение двух групп при нормальном распределении (проверка с помощью критерия Колмогорова-Смирнова) проводили с использованием непарного t-теста. Достоверным уровнем отличий считали вероятность не менее 95% (р<0,05).
РЕЗУЛЬТАТЫ
Результаты микроциркуляторного исследования показали, что под воздействием блокатора КАТФ-каналов глибенкламида (GB) у крыс из группы СТЗ-СД число сузившихся пиальных артерий уменьшилось в 1,3–1,9 раза относительно контрольных животных (Группа 1). При этом с контрольной группой крыс, находящихся на ВЖД (Группа 2), статистически значимой разницы по числу констрикций не выявлено (рис. 3А), кроме мельчайших артерий диаметром менее 20 мкм.
На рис. 4 на примере крупных (диаметром 40–60 мкм) и мелких (диаметром менее 20 мкм) пиальных артерий представлено влияние глибенкламида на эндотелий-зависимую дилатацию. У контрольных животных из группы 1 при применении ACh на фоне действия GB (ACh + GB) число расширившихся артерий уменьшилось в 2,2–3,5 раза по сравнению с воздействием чистого ACh. У животных из группы 2 (ВЖД) не выявлено значимой разницы в числе дилатаций на ACh и ACh + GB (данные не показаны). В группе СТЗ-СД GB также не влиял на ACh-опосредованную дилатацию пиальных артерий.
На рис. 5 представлено сравнение числа расширившихся пиальных артерий на воздействие пинацидила (PI) и пинацидила на фоне ацетилхолина (PI+ACh).
Результаты показали, что в контрольной группе 1 применение AСh на фоне действия PI привело к увеличению числа расширившихся артерий по сравнению с чистым PI (рис. 5). В контрольной группе 2 (ВЖД) не выявили статистически значимой разницы по числу дилатаций при воздействии на поверхность мозга растворами AСh, PI и PI+AСh (данные не показаны). В группе СТЗ-СД число сузившихся артерий под воздействием GB в 1,3–1,5 раза меньше, чем расширившихся под воздействием PI (кроме мельчайших артерий диаметром менее 20 мкм) (рис. 3А и 5). AСh-опосредованная дилатация на фоне действия PI не выявлена (рис. 5).
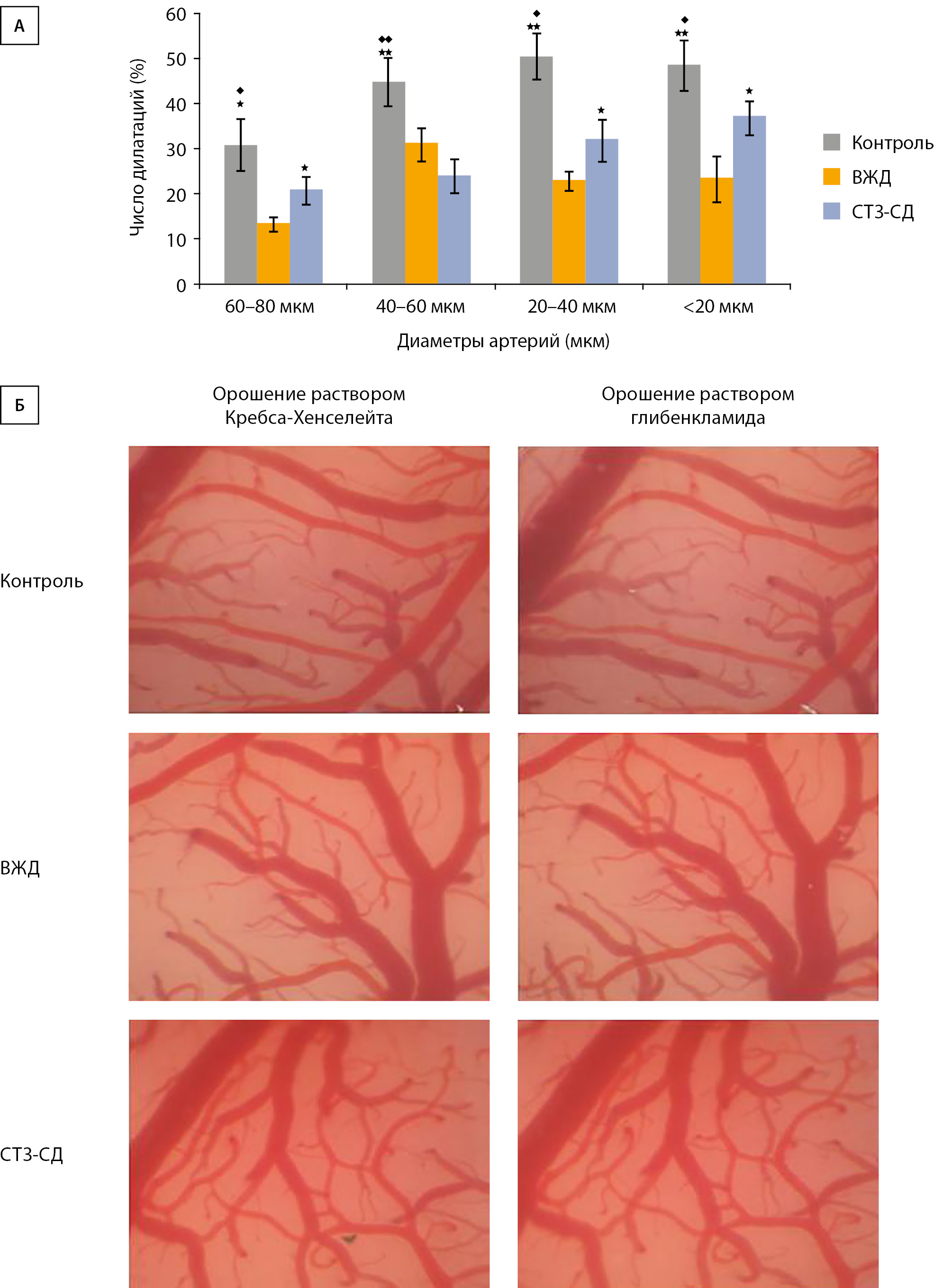
Рисунок 3. Оригинальные изображения микрососудистой сети пиальной оболочки коры головного мозга экспериментальных животных.
Примечание. ВЖД — высокожировая диета; СТЗ-СД — стрептозотоциновый сахарный диабет.
А. Число пиальных артерий, ответивших констрикцией на воздействие глибенкламида. По горизонтали — группы сосудов, по вертикали — число сосудов, сузившихся в ответ на воздействие GB (% от общего числа исследованных сосудов). Данные представлены в виде среднего арифметического±ошибка среднего. * — изменения значимы по сравнению с числом констрикций у животных ВЖД; ◊ — изменения значимы по сравнению с числом констрикций у крыс СТЗ-СД (*,◊р<0,05, **,◊◊р<0,01, непарный t-тест).
Б. Микрофотографии пиальных сосудов крыс экспериментальных животных, х140: исходное состояние (орошение поверхности мозга раствором Кребса-Хенселейта) — реакция на орошение поверхности мозга раствором глибенкламида (10 мкМ, 10 мин).
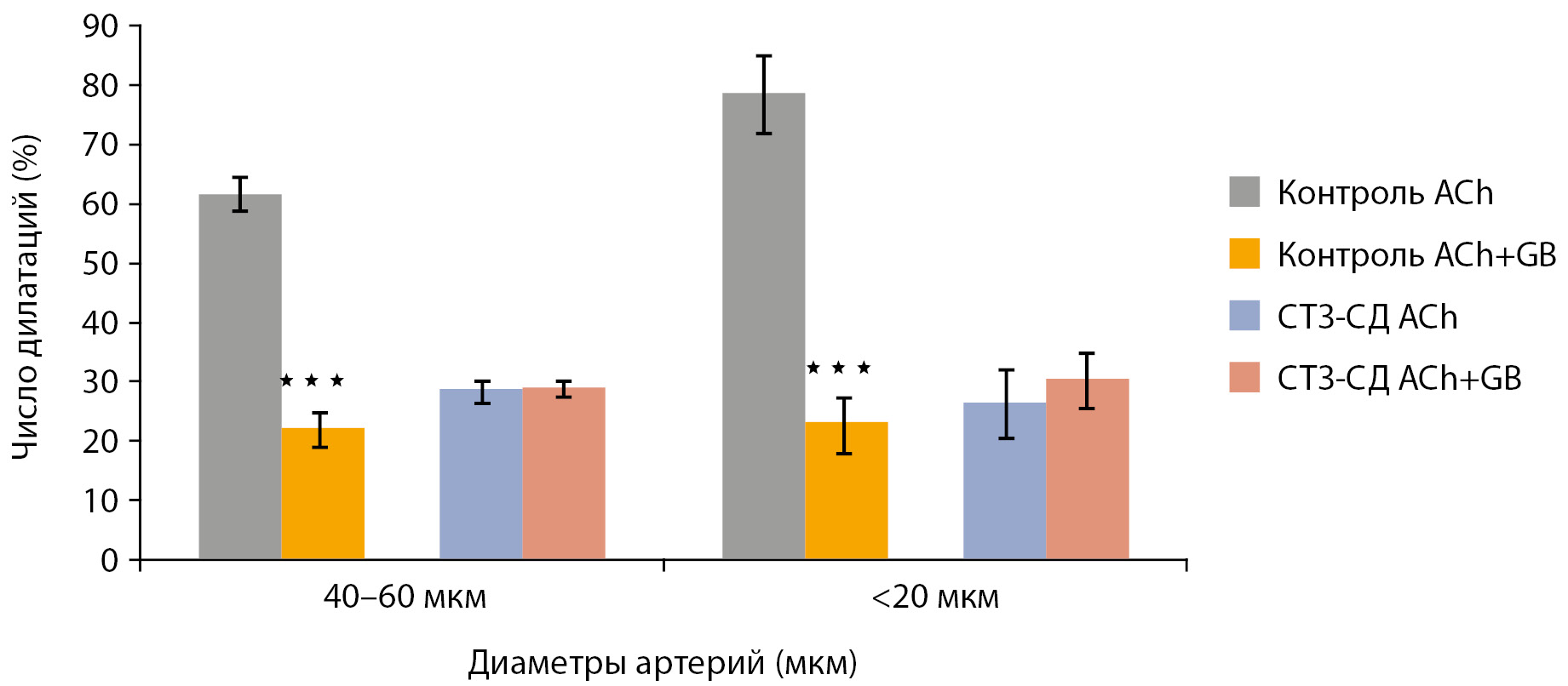
Рисунок 4. Сравнение числа пиальных артерий, ответивших дилатацией на воздействие ацетилхолина и ацетилхолина при блокировании КАТФ-каналов глибенкламидом на примере пиальных артерий диаметром 40–60 мкм и менее 20 мкм.
Примечание. ВЖД — высокожировая диета; СТЗ-СД — стрептозотоциновый сахарный диабет. По горизонтали — группы сосудов, по вертикали — число сосудов, расширившихся в ответ на воздействие ACh и AСh+ GB (% от общего числа исследованных сосудов). Данные представлены в виде среднего арифметического±ошибка среднего. * — изменения значимы по сравнению с числом дилатаций на ACh (***р<0,001, непарный t-тест).
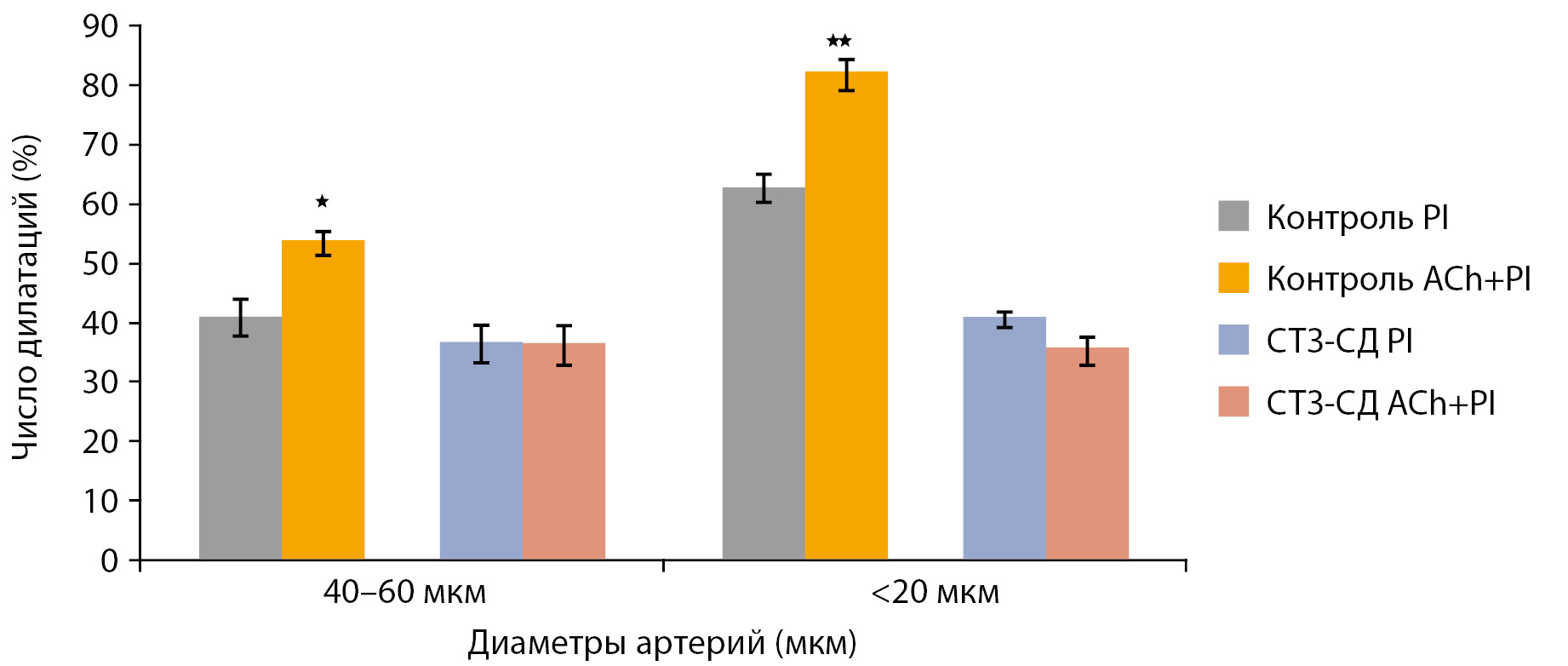
Рисунок 5. Сравнение числа пиальных артерий, ответивших дилатацией на воздействие пинацидила и ацетилхолина при активации КАТФ-каналов пинацидилом на примере пиальных артерий диаметром 40–60 мкм и менее 20 мкм.
Примечание. ВЖД — высокожировая диета; СТЗ-СД — стрептозотоциновый сахарный диабет. По горизонтали — группы сосудов, по вертикали — число сосудов, расширившихся в ответ на воздействие ACh и PI+ AСh (% от общего числа исследованных сосудов). Данные представлены в виде среднего арифметического±ошибка среднего. * — изменения значимы по сравнению с числом дилатаций на ACh ((*р<0,05, **р<0,01, непарный t-тест).
ОБСУЖДЕНИЕ
КАТФ-каналы являются определяющим звеном в поддержании тонуса церебральных артерий посредством регуляции внутриклеточной концентрации Са2+ [10][11]. Результаты нашей работы показали, что после формирования у крыс СТЗ-СД под воздействием глибенкламида сузилось 20–40% пиальных артерий, что в 1,3–1,9 раза меньше, чем у крыс из контрольной группы 1 (рис. 3А). С контрольной группой 2 (ВЖД) разницы в реакции на GB не выявлено, за исключением артерий с исходным диаметром менее 20 мкм. Воздействие GB может быть снижено из-за дезактивации KATP-каналов мозговых артерий или понижения их плотности в сосудистой стенке. Блокирование KATP-каналов при СД2 может происходить по нескольким причинам. Гипергликемия приводит к повышению концентрации глюкозы в цитозоле эндотелиальных и гладкомышечных клеток. Это, в свою очередь, вызывает повышение уровня АТФ, которая присоединяется к Kir6.1 единице и тем самым закрывает KATP-канал [17]. Но мы видим уменьшение числа констрикций пиальных артерий на воздействие GB и в группе животных, которые потребляли только высокожировой корм без введения им стрептозотоцина. Следовательно, можно предположить, что доминирующую роль в блокировании KATP-каналов пиальных артерий играет не уровень глюкозы в крови, а окислительный стресс. Как при ВЖД, так и при СД2, увеличивается количество субстратов окисления (глюкозы и липидов) и уменьшается образование и понижается активность антиоксидантных систем, таких как глутатион, супероксиддисмутаза, каталаза и глутатионовая пероксидаза [18]. В результате реакции между супероксид анионом и оксидом азота образуется пероксинитрит (ONOO−) [19], который, с одной стороны, активирует КАТФ-каналы и кальций-чувствительные калиевые каналы большой проводимости. Далее происходит гиперполяризация клеточной мембраны, расслабление ГМК и увеличение диаметра артерий. С другой стороны, ONOO− вступает в реакцию с сульфгидрильными группами в составе молекул КАТФ-каналов, тем самым понижая их функциональную активность [20], что приводит к констрикторной реакции артериальных сосудов. Вероятно, плотность КАТФ-каналов в сосудистой стенке церебральных артерий при развитии СТЗ-СД уменьшается, но функционирующие КАТФ-каналы есть и они принимают участие в поддержании базального тонуса мозговых сосудов. По нашим данным, у животных из группы СТЗ-СД глибенкламид блокировал меньшее число КАТФ-каналов, чем активировал PI (в 1,5–1,3 раза, за исключением артерий диаметром менее 20 мкм) (рис. 3А, рис. 5). Следовательно, помимо функционирующих, имеются заблокированные, но не поврежденные КАТФ-каналы, которые потенциально могут быть активированы и задействованы в регуляции сосудистой реактивности.
Открытие КАТФ-каналов ГМК с выходом ионов К+ из клетки — одно из составляющих в формировании эндотелий зависимой дилататорной реакции пиальных артерий. У контрольных животных GB блокировал AСh-зависимую дилатацию на 45–71% в зависимости от диаметра артерий (рис. 4). На фоне действия активатора КАТФ-каналов пинацидила число дилатаций на AСh было статистически значимо выше, чем на чистый PI (рис. 5). Следовательно, расслабление ГМК может происходить за счет активации других сигнальных путей, например посредством Са2+ — активируемых калиевых каналов, потенциал-зависимых калиевых каналов и т.д. [21]. У контрольных крыс, находящихся на ВЖД, не было выявлено статистически значимой разницы по числу дилатаций пиальных артерий на воздействие чистого AСh и AСh на фоне блокады КАТФ-каналов (рис. 4) или между PI и PI+ AСh (рис. 5). Вероятно, у животных на ВЖД для поддержания базального сосудистого тонуса задействованы все функционирующие КАТФ-каналы. В формировании эндотелий-зависимой дилатации церебральных артерий эти каналы у данной группы животных практически не принимают участия. В литературе представлены данные, что при употреблении больших количеств калорийной пищи в сосудистой стенке мозговых сосудов откладывается β-амилоидный пептид и развивается β-амилоидная ангиопатия [22][23]. β-амилоид нарушает функционирование митохондрий, вызывает деградацию клеточных мембран, нарушает транспорт ионов [24]. В более поздних работах было установлено, что β-амилоидная ангиопатия затрагивает и КАТФ-каналы [25], понижая их функциональную активность, хотя данный механизм до конца не изучен [26].
Применение глибенкламида не повлияло на AСh-опосредованное расширение пиальных артерий у крыс из группы СТЗ-СД (рис. 4). Можно предположить, что КАТФ-каналы практически не принимают участия в формировании эндотелий-зависимой дилатации церебральных артерий и в этом процессе задействованы другие сигнальные пути [21]. Однако, в отличие от контрольной группы 1, число дилатаций пиальных артерий на PI +AСh примерно такое же, как на PI, т.е. расширение сосудов идет преимущественно за счет открывания КАТФ-каналов. Налицо явное противоречие. Тут следует вспомнить, что СД2 приводит к эндотелиальной дисфункции и уменьшению выработки NO посредством каскада L-аргинина/еNOS/NO. При СТЗ-СД NO производится в основном за счет iNOS [27], т.е. имеет место не эндотелий-зависимая дилатация. Изучение механизмов реактивности церебральных сосудов при СТЗ-СД является следующей задачей авторского коллектива.
ЗАКЛЮЧЕНИЕ
У крыс со СТЗ-СД КАТФ-каналы принимают участие в формировании базального тонуса пиальных артерий, но вклад этих каналов снижен в среднем в 1,5 раза по сравнению со здоровыми крысами.
Применение глибенкламида при СТЗ-СД не влияет на эндотелий-зависимую дилатацию церебральных артерий.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования — госбюджет. Работа выполнена при поддержке Госпрограммы 47 ГП «Научно-технологическое развитие Российской Федерации» (2019–2030 гг.), тема 0134-2019-0001.
Конфликта интересов относительно публикации этой статьи не существует.
Участие авторов. Соколова И.Б. — концепция и дизайн исследования, сбор данных, обработка данных, написание и редактирование статьи; Лобов Г.И. — концепция исследования, редактирование и финальное утверждение рукописи. Все авторы одобрили финальную версию статьи перед публикацией выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Чернышова Т.Е., Стяжкина С.Н. Глибенкламид: место в современной терапии сахарного диабета 2 типа // Эффективная фармакотерапия. — 2023. — Т. 19. — №31. — С. 18–23. doi: https://doi.org/10.33978/2307-3586-2023-19-31-18-23
2. Faraji A, Tahamtani L, Maharlouei N, et al. Effects of oral glibenclamide versus subcutaneous insulin on perinatal outcome of patients with gestational diabetes mellitus: A randomized clinical trial. Asadi N.Obstet Med. 2023:16(2):98-103. doi: https://doi.org/10.1177/1753495X221100167
3. Sun D, Wang J, Toan S, et al. Molecular mechanisms of coronary microvascular endothelial dysfunction in diabetes mellitus: focus on mitochondrial quality surveillance. Angiogenesis. 2022;18. doi: https://doi.org/10.1007/s10456-022-09835-8
4. Price JM, Chi X, Hellermann G, Sutton ET. Physiological levels of beta-amyloid induce cerebral vessel dysfunction and reduce endothelial nitric oxide production. Neurol Res. 2001;23(5):506-12. doi: https://doi.org/10.1179/016164101101198758
5. White MF, Kahn CR. Insulin action at molecular level — 100 years of progress. Mol Metab. 2021;52. doi: https://doi.org/101304.10.1016/j.molmet.2021.101304
6. Ahmad MN, Farah AI, Al-Qirim TM. The cardiovascular complications of diabetes: a striking link through protein glycation. Rom J Intern Med. 2020;58(4):188-198. doi: https://doi.org/10.2478/rjim-2020-0021
7. Балаболкин М.И. Роль гликирования белков, окислительного стресса в патогенезе сосудистых осложнений при сахарном диабете // Сахарный диабет. — 2002. — Т.5. — №4. — С.18-16. doi: https://doi.org/10.14341/DM200248-16
8. Cao X, Xia Y, Zeng M, et al. Caffeic acid inhibits the formation of advanced glycation end products (AGEs) and mitigates the AGEs-induced oxidative stress and inflammation reaction in human umbilical vein endothelial cells (HUVECs). Chem Biodivers. 2019;16(10):e1900174. doi: https://doi.org/10.1002/cbdv.201900174
9. Nichols CG, York NW, Remedi MS. ATP-Sensitive Potassium Channels in Hyperinsulinism and Type 2 Diabetes: Inconvenient Paradox or New Paradigm? Diabetes. 2022;71(3):367-375. doi: https://doi.org/10.2337/db21-0755
10. Szeto V, Chen NH, Sun HS, Feng ZP. The role of KATP channels in cerebral ischemic stroke and diabetes. Acta Pharmacol Sin. 2018;39(5):683-694. doi: https://doi.org/10.1038/aps.2018.10
11. Syed AU, Koide M, Brayden JE, Wellman G. Tonic regulation of middle meningeal artery diameter by ATP-sensitive potassium channels. Journal of Cerebral Blood Flow and Metabolism. 2019;39(4):670-679. doi: https://doi.org/10.1177/0271678X17749392
12. Srinivasan K, Viswanad B, Asrat L, et al. Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: A model for type 2 diabetes and pharmacological screening. Pharmacological Res. 2005;52(4):313-320. doi: https//doi.org/10.1016/j.phrs.2005.05.004
13. Спасов А.А., Бабков Д.А., Мулеева Д.Р., Майка О.Ю. Моделирование сахарного диабета типа 2 у крыс на высокожировой диете с индукцией стрептозотоцином // Вестник ВолгГМУ. — 2017. — Т. 1. — №61. — С. 30-32
14. Balog M, Ivic V, Scitovski R, et al. A mathematical model reveals sex-specific changes in glucose and insulin tolerance during rat puberty and maturation. Croat Med J. 2020;61(2):107-118. doi: https://doi.org/10.3325/cmj.2020.61.107
15. Якимов И.Ю., Бородин Д.А., Подрезов И.К. и др. Морфометрические параметры белой жировой ткани разной локализации у крыс при высокожировой диете // Современные проблемы науки и образования. — 2015. — №5.
16. Gorshkova OP, Sokolova IB. H2S-mediated dilation of pial arteries in rats of different ages: contribution of КАТФ and BKCa cannels. Journal of Evolutionary Biochemistry and Physiology. 2023;59(4):1414-1425. doi: https://doi.org/10.1134/S1234567823040328
17. Tseng CH. Dementia risk in type 2 diabetes patients: acarbose use and its joint effects with metformin and pioglitazone. Aging Dis. 2020;11(3):658-667. doi: https://doi.org/10.14336/AD.2019.0621
18. Arshad NA, Lin TS, Yahaya MF. Metabolic syndrome and its effect on the brain: possible mechanism. CNS Neurol Disord Drug Targets. 2018;17(8):595-603. doi: https://doi.org/10.2174/1871527317666180724143258
19. Sancho M, Fletcher J, Welsh DG. Inward rectifier potassium channels: membrane lipid-dependent mechanosensitive gates in brain vascular cells. Front Cardiovasc Med. 2022;9:869481. doi: https://doi.org/10.3389/fcvm.2022.869481
20. Zeidner G, Sadja R, Reuveny E. Redox-dependent gating of G protein-coupled inwardly rectifying K+ channels. J Biol Chem. 2001;76(38):35564-70. doi: https://doi.org/10.1074/jbc.M105189200
21. Гусакова С.В., Смаглий Л.В., Бирулина Ю.Г. и др. Молекулярные механизмы действия газотрансмиттеров NO, CO и H2S в гладкомышечных клетках и влияние NO-генерирующих соединений (нитратов и нитритов) на среднюю продолжительность жизни // Успехи физиологических наук. — 2017. — Т. 48. — №1. — С. 24-52.
22. Weber S, Patel R, Lutsep H. Cerebral amyloid angiopathy: diagnosis and potential therapies. Expert Rev Neurother. 2018;18(6):503-513. doi: https://doi.org/10.1080/14737175.2018.1480938
23. Kakoty V, Kc S, Kumari S, et al. Brain insulin resistance linked Alzheimer’s and Parkinson’s disease pathology: An undying implication of epigenetic and autophagy modulation. Inflammopharmacology. 2023;23. doi: https://doi.org/10.1007/s10787-023-01187-z
24. Greenberg SM, Bacskai BJ, Hernandez-Guillamon M, et al. Cerebral amyloid angiopathy and Alzheimer disease - one peptide, two pathways. Nat Rev Neurol. 2020;16(1):30-42. doi: https://doi.org/10.1038/s41582-019-0281-2
25. Maqoud F, Scala R, Hoxha M, et al. ATP-sensitive potassium channel subunits in neuroinflammation: novel drug targets in neurodegenerative disorders. CNS Neurol Disord Drug Targets. 2022;21(2):130-149. doi: https://doi.org/10.2174/1871527320666210119095626
26. Nuñez-Diaz C, Pocevičiūtė D, Schultz N, et al. Contraction of human brain vascular pericytes in response to islet amyloid polypeptide is reversed by pramlintide. Mol Brain. 2023;16(1):25. doi: https://doi.org/10.1186/s13041-023-01013-1
27. Sokolova IB. Invovement of inducible nitric oxide synthase in pial arterial tone formation under metabolic disorders and streptozotocin-induced diabetes in rats kept on a high-fat diet. J of Evolutionary Biochemistry and Physiology. 2022;58(5):1482-1490. doi: https://doi.org/10.1134/S0022093022050180
Об авторах
И. Б. СоколоваРоссия
Соколова Ирина Борисовна - к.б.н.
188680, Ленинградская обл., с. Павлово, ул. Быкова, д. 36
Конфликт интересов:
конфликт интересов отсутствует
Г. И. Лобов
Россия
Лобов Геннадий Иванович - д.м.н., профессор.
188680, Ленинградская обл., с. Павлово, ул. Быкова, д. 36
Конфликт интересов:
конфликт интересов отсутствует
Дополнительные файлы
|
|
1. Рисунок 1. Динамика изменения веса экспериментальных крыс и уровня глюкозы в крови. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(230KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Графики тестирования экспериментальных крыс на толерантность к глюкозе с помощью глюкозотолерантного теста (ГТТ) и на инсулинорезистентность с помощью инсулин-толерантного теста (ИТТ). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(228KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Оригинальные изображения микрососудистой сети пиальной оболочки коры головного мозга экспериментальных животных. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(475KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Сравнение числа пиальных артерий, ответивших дилатацией на воздействие ацетилхолина и ацетилхолина при блокировании КАТФ-каналов глибенкламидом на примере пиальных артерий диаметром 40–60 мкм и менее 20 мкм. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(117KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Сравнение числа пиальных артерий, ответивших дилатацией на воздействие пинацидила и ацетилхолина при активации КАТФ-каналов пинацидилом на примере пиальных артерий диаметром 40–60 мкм и менее 20 мкм. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(114KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Соколова И.Б., Лобов Г.И. Влияние глибенкламида на функциональную активность КАТФ-каналов церебральных артерий у крыс со стрептозотоциновым сахарным диабетом. Сахарный диабет. 2024;27(4):304-312. https://doi.org/10.14341/DM13103
For citation:
Sokolova I.B., Lobov G.I. The Effect of Glibenclamide on the Functional Activity of КATP Channels of Cerebral Arteries in Rats with Streptozotocin Diabetes Mellitus. Diabetes mellitus. 2024;27(4):304-312. (In Russ.) https://doi.org/10.14341/DM13103

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































